β-桐酸抑制膀胱癌T24细胞生长及其与ROS的关系
2014-02-23李倩,王晗,孙仲琰,叶淑红,肖珊,谢煜萍,王际辉
李 倩,王 晗,孙 仲 琰,叶 淑 红,肖 珊,谢 煜 萍,王 际 辉
(大连工业大学 食品学院,辽宁 大连 116034)
0 引 言
β-桐酸(β-ESA)(t9,t11,t13-18:3)是共轭亚麻酸的一组位置和几何异构体,少量存在于种子油中[1],可经α-桐酸异构化生成[2]。近年来研究表明,β-桐酸具有抗癌、降血脂、减肥等一系列有益的生理功能,因而引起了研究人员的极大兴趣[3-4]。已有研究表明β-桐酸可以抑制结肠癌细胞caco-2 生长,且作用比α-桐酸更显著[5],但β-桐酸抑制癌细胞生长的内在机制并不清楚。 本实验采用不同浓度的β-桐酸处理人膀胱癌细胞T24,通过研究ROS的产生及GSH 含量的变化,初步探究β-桐酸抑制T24细胞生长的可能机制。
1 实 验
1.1 材料与试剂
α-亚麻酸、β-桐酸,美国Cayman化学公司;膀胱癌T24 细胞,中国科学院细胞库;RPMI-1640细胞培养液,美国Sigma 公司;胎牛血清,美国HyClone 公 司;2′,7′-二氯荧光素双乙酸盐,DCFH-DA,杭州碧云天生物技术研究所;四甲基偶氮唑盐MTT,美国Sigma公司;谷胱甘肽检测试剂盒,南京建成生物技术有限公司。
1.2 仪器与设备
酶标仪,TECAN SUNRISE,奥地利TECAN公司;荧光分光光度计,RF-5301PC 型,日本岛津公司。
1.3 实验条件
1.3.1 细胞培养
将T24 细胞接种于含10% 胎牛血清、100IU/L青霉素、100μg/L链霉素的RPMI-I640培养基(pH 7.2~7.4),于37 ℃、5%CO2培养箱中培养。传2~3代后,取对数生长期细胞用于实验。
1.3.2 MTT 实验检测细胞活力
取对数生长期T24细胞以1×105个/mL 的密度接入96孔板,37 ℃、5%CO2培养24h后,换无血清培养基同步化。4h 后,加入终浓度为10、20、40、80μmol/L的α-亚麻酸和β-桐酸,每个浓度设6个重复实验。继续培养24h后,每孔加入终质量浓度为5 mg/mL 的MTT,于37 ℃、5%CO2培养箱中培养4h后,小心吸弃上清液,每孔加入DMSO 150μL,静置10 min 后振荡60s,于酶标仪上测570nm 处吸光度。NAC 拮抗β-桐酸作用的实验中,细胞随机分为4组:对照组、20μmol/Lβ-桐酸、10 mmol/L NAC、β-桐酸和NAC共培养。各组加入相应药物处理后,培养24h,按前文方法测定吸光度值。细胞存活率=实验组A值/对照组A值×100%。
1.3.3 ROS水平的测定
取对数生长期T24细胞2~5×105个/mL接种于6孔板,细胞随机分为2组:20μmol/Lβ-桐酸,20μmol/Lβ-桐酸加入10 mmol/L NAC,各组加入相应药物处理0、24、48h后,胰酶消化,重悬,计数1×105个T24 细胞,加入含20μmol/L DCHF-DA 的PBS,37 ℃避光孵育30min,用PBS洗2遍,洗去多余荧光,用荧光分光光度计在激发光480nm,发射光530nm 处检测各处理组的荧光强度。
1.3.4 GSH 质量分数的测定
取对数生长期T24细胞2~5×105个/mL接种于6孔板,细胞随机分为4个处理组:对照组,20μmol/Lβ-桐酸、10 mmol/L NAC、β-桐酸和NAC 共培养,各组加入相应药物处理后,培养24h,收集细胞,PBS漂洗2次,重悬细胞,反复冻融,使细胞充分裂解。按照谷胱甘肽检测试剂盒要求,采用DNTB 法测定GSH 质量分数,用Bradford法测定蛋白含量。每个实验重复3次。
1.3.5 统计学分析方法
实验数据以x±sd表示,采用Origin Pro7.5进行t检验分析。P<0.05具有统计学意义。
2 结果与分析
2.1 β-桐酸对T24细胞活力的影响
如图1所示,随着β-桐酸处理浓度的升高,膀胱癌细胞T24存活率显著下降,且呈明显剂量相关性(P<0.05)。与12h处理组相比,β-桐酸处理细胞24h后,20和40μmol/L 处的细胞活力分别为53.96%和6.98%,48h 为24.38%和4.74%,呈明显时间效应关系(P<0.05)。

图1 β-桐酸抑制T24细胞生长的时间和剂量相关性Fig.1 Time-and-dose dependent effects of β-eleostearic acid on T24cells
如图2所示,与对照组相比,β-桐酸和α-亚麻酸处理T24细胞24h后,细胞活力均明显降低,且在一定浓度范围内呈剂量依赖性,表明β-桐酸和α-亚麻酸对T24 细胞生长均有抑制作用。但在相同浓度下,β-桐酸对T24细胞生长的抑制作用强于α-亚麻酸(P<0.05)。
2.2 β-桐酸对细胞内ROS的影响
细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF。检测DCF 的荧光就可以检测出细胞内活性氧的水平。结果如图3 所示,β-桐酸处理T24细胞24、48h后,细胞内ROS的水平显著提高。同时加入ROS清除剂N-乙酰半胱氨酸(NAC),则可以拮抗β-桐酸的作用,降低ROS水平(P<0.05)。

图2 β-桐酸和α-亚麻酸对T24细胞生长的影响Fig.2 Effect ofβ-eleostearic acid andα-linolenic acid on T24cells growth

图3 T24细胞内活性氧的变化Fig.3 Changes of intracellular ROS level of T24cells
2.3 ROS清除剂NAC对β-桐酸的拮抗作用
为了进一步检测ROS在β-桐酸抑制细胞生长中的作用,用MTT 法检测了ROS 清除剂NAC 对细胞生长的影响,结果如图4 所示。NAC 单独处理对细胞活力没有影响,加入20μmol/Lβ-桐酸显著抑制细胞生长,两者协同作用,NAC则可以拮抗β-桐酸对T24 细胞的抑制作用。表明ROS参与了β-桐酸对T24细胞生长的抑制作用(P<0.05)。

图4 加入NAC后对T24细胞活力的影响Fig.4 Effect of NAC on T24cells activity treated by β-eleostearic acid
2.4 β-桐酸处理后细胞内GSH 质量分数的变化
GSH 质量分数是细胞内氧化还原水平的标志。如图5所示,T24细胞经20μmol/Lβ-桐酸处理24h后,细胞内总GSH 质量分数明显下降,为65.73%(P<0.05)。加入NAC 后,β-桐酸消耗细胞内GSH 的作用明显抑制,细胞内总GSH质量分数为97.52%。
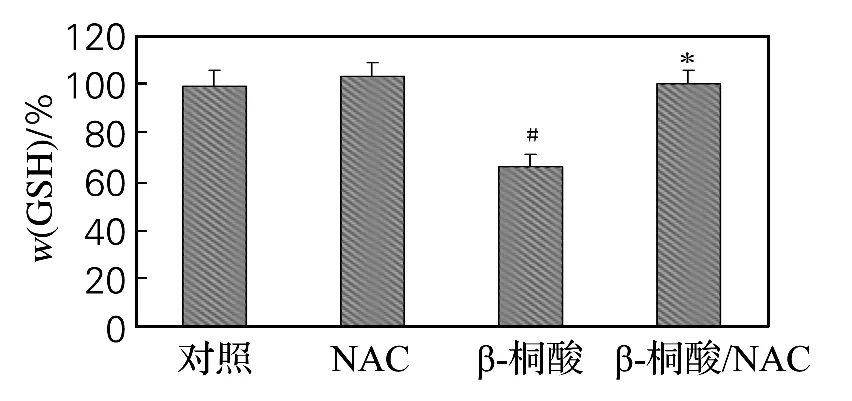
图5 β-桐酸对细胞内氧化还原水平的影响Fig.5 Effect ofβ-eleostearic acid on cellular redox level
3 讨 论
MTT 检测结果表明,β-桐酸可以抑制膀胱癌T24细胞活力,且呈现时间与剂量相关性。且β-桐酸处理T24细胞后,细胞内ROS水平显著下降,提示β-桐酸可能通过诱导ROS的积累抑制细胞生长。加入ROS清除剂NAC 检测细胞活力,发现NAC 可以拮抗β-桐酸的作用,表明β-桐酸对T24细胞的生长抑制作用是通过ROS的产生介导的。GSH 是一种重要的细胞内自由基清除剂,细胞内氧化还原水平很大程度上取决于GSH的质量分数。通过测定T24细胞内GSH 质量分数表明,β-桐酸可以通过诱导ROS 的产生,改变细胞内GSH 质量分数,从而改变细胞氧化还原水平。β-桐酸抑制细胞生长是通过诱导坏死还是凋亡还需进一步的研究,从而为进一步预防和治疗肿瘤提供新的靶点。
[1]TANAKA T,HOSOKAWA M,YASUI Y,et al.Cancer chemopreventive ability of conjugated linolenic acids[J].International Journal of Molecular Sciences,2011,12(11):7495-7509.
[2]张根旺.油脂化学[M].北京:中国财政经济出版社,2000:19-21.
[3]IGARASHI M,MIYAZAWA T.Newly recognized cytotoxic effect of conjugated trienoic fatty acids on cultured human tumor cells[J].Cancer Letters,2000,148(2):173-179.
[4]YASUI Y,HOSOKAWA M,KOHNO H,et al.Growth inhibition and apoptosis induction by alltrans-conjugated linolenic acids on human colon cancer cells[J].Anticancer Research,2006,26(3A):1855-1860.
[5]HENNESSY A A,ROSS R P,DEVERY R,et al.The health promoting properties of the conjugated isomers of alpha-linolenic acid[J].Lipids,2011,46(2):105-119.
