养殖环境细菌微生物气溶胶粒径分布及其健康危害评估
2014-02-22,
,
(泰安市岱岳区畜牧兽医局,山东泰安 271000)
养殖环境细菌微生物气溶胶粒径分布及其健康危害评估
钟召兵,王宁
(泰安市岱岳区畜牧兽医局,山东泰安 271000)
为深入了解畜禽舍环境中气载细菌微生物的空气动力学粒径分布规律,并评估其潜在的健康危害风险,采用Andersen-6级微生物空气采样器以血-琼脂培养基、沙氏培养基和高氏合成1号培养基为采样介质,对鸡舍、猪舍、牛舍环境中空气样品进行系统定点取样、测定及分析。研究结果表明,鸡舍环境中气载需氧菌含量最高,猪舍次之,牛舍最低;空气细菌粒径分布均为第Ⅰ级最高,鸡舍空气粒径呈偏态分布,牛舍、猪舍分别在第Ⅲ级和第Ⅳ级出现第2个峰值。携带细菌可吸入微粒在猪舍环境中比例最大。空气真菌与放线菌均在第Ⅳ级最高,携带真菌和放线菌可吸入粒子的比例显著大于细菌(P<0.05)。鸡舍、猪舍、牛舍空气微生物粒径各级分布比例基本一致。在鸡舍、猪舍、牛舍每天约有6.1×105CFU、4.7×104CFU和3.6×104CFU气载细菌微生物可分别进入人和动物小支气管或直接进入肺泡,从而对人和动物健康构成潜在危害。
畜禽舍;细菌微生物气溶胶;粒径分布;潜在威胁
空气微生物对人类的危害除了与微生物种类和浓度有关外,还与微生物气溶胶大小有关[1]。微生物附着在固、液颗粒上进入空气形成微生物气溶胶,粒谱范围较广,为0.002~30mm[2]。微生物气溶胶可以借助空气介质扩散和传输,引发人类急、慢性疾病(如传染病、过敏症或中毒)以及动植物疾病的流行传播[3]。畜禽许多重大烈性传染病的传播为气源性传播,其病原微生物形成气溶胶后更容易扩散,并且传播距离很远。例如1981年口蹄疫病毒(FMDV)由法国布列塔尼地区通过空气传播到英格兰南部,导致英格兰口蹄疫爆发[4];2001-2002年在美国由于空气传载炭疽引起多人死亡[5];肺炎克雷波氏菌也可经空气传播等。同时,高浓度微生物气溶胶也与养殖人员的呼吸道过敏和哮喘症状相关[6-7]。大量研究证明,人们要重视畜禽环境气溶胶的危害。
国外在畜禽舍环境与人类和动物健康方面已做过很多研究,证实了空气中微生物及其代谢产物(内毒素、氨、硫化氢等)是影响动物健康的重要因素[8],而国内对畜禽养殖环境细菌微生物气溶胶的研究甚少。因此,本研究对鸡舍、猪舍、牛舍空气细菌微生物粒径结构与分布规律进行了系统、全面的研究并评估其危害,这对控制畜禽环境及周边地区的空气污染具有重要意义。
1 材料与方法
1.1 养殖场情况
研究在鸡场、猪场、牛场内进行,各场的具体情况见表1。

表1 研究用鸡舍、猪舍和牛舍场情况
1.2 采样介质和样本采集
采样平皿用9cm的玻璃平皿,气载细菌用血-琼脂培养基,气载真菌用沙氏培养基,气载放线菌用高氏1号培养基。
每月取样3天,上午9:00~11:00采集样品,采样高度距离地面1.2~1.5m。采样器流量28.3L/ min,气载细菌和真菌采样时间为3~5min,气载放线菌采样时间为5~10min。采样前2天及当日无雨、雾、雪,尽可能消除由气温与含水量变化引起的误差。采样时在同等条件下进行不采样空白对照,以检查采样过程中有无其他染菌因素存在。
1.3 采样方法和培养方法
应用国际通用的Andersen-6空气微生物采样器进行采样,该采样器是模拟人呼吸道的解剖结构和空气动力学特征,利用惯性撞击原理设计,分为6级,每级400个孔,从上至下孔的直径逐级缩小,空气流量一定,流速逐级增大,从而将空气中带菌粒子按粒径不同分别收集在采样器各级培养皿上。采样器各级特征见表2。
空气细菌样品在37℃培养箱内培养48h,空气真菌样品在28℃培养72h,空气放线菌样品在28℃培养120h。
1.4 计算方法
1.4.1 空气细菌微生物粒子数校正公式
当通过各级筛孔的菌粒子超过一定数量时,会出现菌粒撞击在一点的重叠现象,故各级采集活性生物粒子数按下式校正:

式中:
Pr—校正后的菌落数;
N—采样器各级采样孔数;
r—实际菌落数;
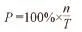
1.4.2 各级带菌粒子百分比计算公式
式中:
P—各级带菌粒子百分比;
n—各级菌落数;
T—6级总菌落数;
1.5 数据统计分析
对微生物气溶胶粒径进行平均数差异显著性检验(t检验),以P<0.05为差异显著性。用SPSS Version13.0和Microsoft Excel 2003进行数据分析和图表绘制。
1.6 细菌气溶胶潜在危害评估
细菌气溶胶在人和动物呼吸道不同部位的到达量,以及每分钟吸入细菌的CFU表示,即由人或动物的呼吸量(m3/min)乘以可到达小支气管及肺泡细菌含量求得。Andersen-6级生物空气微生物采样器Ⅰ-Ⅱ级收集的细菌粒子(>6.0mm)可通过上呼吸道,Ⅲ-Ⅵ级收集的粒子(≤6.0mm)可沉着在小支气管或直接进入肺泡。到达上呼吸道或小支气管、肺泡的需氧量为Ⅰ-Ⅱ级或Ⅲ-Ⅵ级所占比例乘以样本总含量。
2 结果与讨论
2.1 鸡舍、猪舍、牛舍微生物气溶胶粒径分布
2.1.1 细菌气溶胶粒径分布
鸡舍、猪舍、牛舍细菌气溶胶均在Ⅰ级分布比例最高,分别为33%、24%、26%(图1)。鸡舍空气粒径呈偏态分布,牛舍、猪舍分别在第Ⅲ级和Ⅳ级出现第2个峰值。携带细菌可吸入微粒在猪舍环境中比例最大。3个畜禽舍携带细菌的可吸入微粒(<8.2mm)分别为67%、76%和74%。
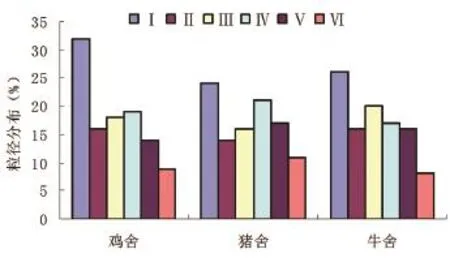
图1 鸡舍、猪舍和牛舍细菌气溶胶粒径分布
鸡舍由于封闭并安装雨帘和排气等装置,舍内空气细菌气溶胶可以随气体交换进入舍外环境中;而牛场有绿地和树木、地表灰尘等,空气中存在细菌气溶胶;猪舍地面硬化,用人工除粪,污水中的细菌随水滴进入空气中,在采样过程中高速气流使水滴风干或变小,细菌气溶胶粒径变小,可以更多进入采样器的高级。细菌气溶胶的粒径在Ⅳ~Ⅵ级(<3mm)占44.2%,比鸡舍高11%左右。
2.1.2 鸡舍、猪舍和牛舍真菌气溶胶粒径分布
真菌气溶胶的分布主要集中在Ⅲ~Ⅴ级,约占总数的73%。均在Ⅳ级出现峰值(2~3mm),约占总数的31%。最低值分布在Ⅵ级(<1mm),分别占6.8%、2.8%、4.3%,携带真菌的可吸入微粒(<8.2mm)约占87%,显著大于可吸入的细菌气溶胶所占比例(P<0.05)如图2所示。
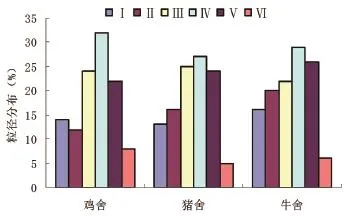
图2 鸡舍、猪舍和牛舍真菌气溶胶粒径分布
与同一地点细菌气溶胶的粒径分布比较,真菌粒子在Ⅰ、Ⅱ级上的分布比例明显减少。这可能是由于细菌附着在固液颗粒上形成细菌气溶胶,而真菌则是以孢子或菌丝的形式独立存在于空气中。研究中观察到,细菌菌落的形成与颗粒物撞击在培养基上的分布一致;而真菌菌落的分布与颗粒物的分布规律没有明显的关系。
2.1.3 鸡舍、猪舍和牛舍放线菌气溶胶粒径分布
3个畜禽场放线菌气溶胶粒径分布趋势相似(图3)。放线菌气溶胶分布峰值出现在Ⅳ级(2-3mm),约占总数的30%。猪场<1mm的粒子数超过20%。携带放线菌的可吸入微粒(<8.2mm)约占80%~90%,这一比例略小于真菌气溶胶,但显著大于细菌气溶胶(P<0.05)。这可能是由于放线菌与真菌一样,以孢子或菌丝状态存在于空气中。

图3 鸡舍、猪舍和牛舍放线菌气溶胶粒径分布
2.1.4 鸡舍、猪舍和牛舍总细菌微生物气溶胶粒径分布
3个畜禽舍可吸入带菌微粒(<8.2mm)分别为81.7%、86.8%、78.4%(图4),其中猪舍所占比例最大。
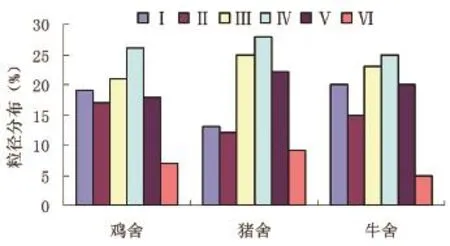
图4 鸡舍、猪舍和牛舍微生物气溶胶粒径分布
细菌微生物气溶胶在Ⅳ级(2-3mm)分布最高,约占28%。如此大小的颗粒能进入人畜的气管支气管甚至支气管,对饲养员及动物健康构成一定的危害。6%~11%的细菌微生物气溶胶分布Ⅵ级(<0.65mm)上,,如此大小的微粒在空气中做BROWNSCH运动,停留较长时间,它们能进出人畜的肺泡直接感染动物。本研究结果表明畜禽舍内53%~65%的粒子可入侵呼吸道深部,且波动范围广,其危害性相对较大,可能会导致畜禽各种呼吸系统疾病。
2.2 畜禽舍空气细菌微生物气溶胶潜在危害评估
2.2.1 畜禽舍空气微生物的吸入量
本研究采用Andersen-6级空气微生物收集器,可以采集到粒谱范围在0.2~20 mm的粒子,并统计各种直径的粒子数量,了解细菌微生物气溶胶颗粒空气动力学直径(Dae50)大小,可以估计它们传播距离和进入呼吸道的深度,判断能否进入肺泡和在空气中悬浮时间,间接推断其对人及动物造成的危害程度。
气溶胶在人和动物呼吸器官不同部位的到达量,以每分钟吸入微生物的CFU表示,即由人或动物的呼吸量(m3/min)乘以可到达小支气管及肺泡微生物含量求得。根据人的吸气量(6.94×10-3m3/ min)以及在舍内的停留时间(8h),饲养人员在一天内可吸入6.1×105CFU(鸡舍)、4.7×104CFU(猪舍)和3.6×104CFU(牛舍)空气细菌微生物,其中Ⅰ级和Ⅱ级上的空气细菌微生物可进入饲养人员的鼻腔和上呼吸道,这些颗粒空气动力学直径大于6mm,如此大小的颗粒在空气中悬浮时间短,其最多能通过鼻腔到达气管,但由于重力作用将很快沉落,在一般情况下,对人和动物的威胁不大。但是Ⅲ~Ⅵ的气载微生物可以在空气中做BROWNSCH运动,停留较长时间,能进入呼吸道深部,沉着在人和动物的小支气管或直接侵入肺泡,且波动范围广,其危害性相对较大,对人和动物的健康构成威胁[9]。
2.2.2 畜禽舍空气细菌微生物气溶胶潜在危害
气溶胶的粒径范围通常为1~100mm,其中1~10mm内的细菌气溶胶与呼吸道疾病密切相关。所致疾病主要由粒径为1~5mm的细菌气溶胶引起,其中铜绿假单胞菌((Pseudomonas aeruginosa ,PAE),是重要且常见的条件致病菌,感染途径主要通过呼吸道引起人及动物的肺炎、肺栓塞,也可引起菌血症与败血症等病症[10];而多杀性巴氏杆菌是一种常见的呼吸道致病菌,导致上呼吸道感染;溶血性巴氏杆菌能引起反刍动物如牛、绵羊、山羊发生肺炎,导致羔羊发生急性败血症[11]。此菌也可感染人,对饲养人员的健康有潜在的危害。有研究表明每克肺可培养出2.2×106CFU/m3细菌的雏火鸡5d即全部死亡;如果低于5.2×105CFU/m3,发病延迟,死亡减少,感染后3~4d出现死亡[12]。
采样点畜禽舍空气中细菌含量没有达到上述浓度,并不会引起畜禽群的发病,这说明检测畜禽舍内空气中细菌浓度可以为疾病的爆发流行提供预警资料。虽然采样点的细菌气溶胶浓度不会对人或动物产生急性危害,但少量而长期暴露可能会产生无急性表现隐匿发展的慢性疾病[13]。舍内空气微生物对动物和饲养人员的健康会产生多大危害及含量在多少之内不会影响动物和人的健康等问题,还有待进一步研究。
2.2.3 畜禽舍微生物气溶胶的控制
畜禽舍环境卫生污染来源首先是动物本身包括粪便和其他排泄物、垫料、饲料甚至饲养人员等,其中粪便为重要来源。通过气体交换向周围环境扩散,为了减少舍内气载细菌微生物浓度,须采取合理的养殖方式和密度,采取必要的通风和消毒措施。畜禽疾病发生与舍内外空气细菌微生物浓度大小也有密切关系,为了动物保健和提高生产效益,集约化、规模化畜禽养殖场布局应合理,畜禽舍结构、设施须有利于动物粪便等排泄物及时、迅速的排除、防止尘埃的产生 ;有利于舍内新鲜空气的充分供给;采用现代化的废弃过滤装置,尤其是在城市近郊或养殖密集地区更有必要。采取以上措施,可以有效地减少细菌微生物气溶胶的产生与扩散,达到高效益而又不污染环境。
3 结论
本研究对不同饲养环境的畜禽场舍内气载细菌微生物进行了检测,并对气载细菌微生物的空气动力学粒径分布规律进行了分析,畜禽舍细菌气溶胶在Ⅰ级所占比例最高,在鸡舍呈偏态分布,在猪舍、牛舍分别在Ⅳ级和Ⅲ出现第二个峰值。携带细菌可吸入微粒在猪舍比例最大。真菌与放线菌气溶胶在3个畜禽舍中均在Ⅳ级分布最高,携带真菌和放线菌的可吸入粒子的比例显著大于细菌(P<0.05)。客观评价了舍内空气微生物对动物和饲养人员健康的影响,细菌微生物气溶胶能侵入呼吸道深部,引起呼吸道等疾病。应合理控制饲养密度及调整舍内温度、湿度等措施来降低舍内空气中细菌微生物浓度,以免对人员和周边环境造成危害。
[1] Reponen T,Willeke K,Ulevicius V,et al. Effect of relative humidity on the aerodynamic diameter and respiratory deposition of fungdal spores[J]. Atmospheric Environment,1996,30(30):3967-3974.
[2] 于玺华.现代空气微生物学[M].北京:人民军医出版社,2002.
[3] Ho J,Duncan S. Estimating aerosol hazards from an anthrax letter [J]. Journal of Aerosol Science,2005,36(5/6):701-719.
[4] Donaldson A I,Gloster J,Harvey L D,et al. Use of prediction models to forecast and analyze airborne spread during the foot-and-mouth disease outbreaks in Brittany,Jersey and the Isle of Wight in 1981 [J]. Vet Rec,1982,110:53-57.
[5] Centers for Disease Control and Prevention (CDC). Follow-up of deaths among U.S. Postal Service workers potentially exposed to Bacillus anthracis-District of Columbia,2001-2002[J]. MMWR Morb Mortal Wkly Rep,2003,52:937-938.
[6] Ross M A,Curtis L,Scheff P A,et al. Association of asthmasymptoms and severity with indoor bioaerosols[J]. Allergy,2000,55(8):705-711.
[7] 阚海东,宋伟民,蒋蓉芳,等. 大气微生物污染对居民呼吸系统疾病影响的研究[J]. 中国公共卫生,1999,15(9):817-818.
[8] Prazmo Z,Dutkiewicz J,Skorska C,et al.Exposure to airborne Gram-negative bacteria,dust and endotoxin in paper factories[J]. Ann Agric Environ Med,2003,52:937-938.
[9] Clark M L,Reynolds S J,Burch J B,et al. Indoor air pollution,cook stove quality and housing characteristics in two Honduran communities[J]. Environ Res,2010,110(1):12-18.
[10]Oie S,Kamiya A,K Hironaga,et al. Microbial contamination of enteral feeding solution and its prevention[J]. American Journal of Infection Control,1992,20(4):202-205.
[11]Halloy D J,Kirschvink N A,et al. A screening method to investigate airway reactivity and acute lung injuries in freely moving pigs[J]. The Veterinary Journal,2004 ,168 (3):276-284.
[12] B.W 卡尔尼克.禽病学[M].10版.北京;高等教育出版社,2002:136.
[13] Horvath H,Kasahara M,Pesava P. The size distribution and composition of atmospheric aerosol at a rural and nearby urban location[J]. J Aerosol Sci,1996,27:417-435.
The Size Distrition and Health Risk Assessment of Microbe Bacterial Aerosol in Livestock and Poultry House
Zhong Zhaobing,Wang Ning
(Taian Daiyue District Animal Husbandry and Veterinary Bureau,Taian,Shandong 271018)
In order to determine the size distribution of aerodynamic particles of bacterial microbe in livestock and poultry house,and to evaluate the potential health threats,air samples were collected systematically at fxed points by Andersen six stages air sampler,using blood agar medium,Sabouraud agar medium and Gause’s synthetic agar medium no.1 in chicken,pig and cow houses,and tested and analyzed for microbe aerosol size distribution. The results showed that bacterial aerosol in livestock and poultry houses were mostly distributed in stage I. Bacterial aerosol appeared skew distribution in chicken house. The second peak appeared in stage Ⅲ and Ⅳ separately in cow and pig houses. The inhalable particles carrying bacteria in chicken house accounted the maximum proportion. The highest distribution peak of fungus aerosol and actinomycetes aerosol appeared in stage Ⅳ. The ration of fungi and actionomycetes carried by inhalable particles were signifcantly higher than bacteria(P<0.05). The microbe aerosol size distribution proportions were basically identical at all stages. About 6.1×105CFU、4.7×104CFU and 3.6×104CFU airborne aerobic bacteria in livestock and poultry house could be inhaled into the small bronchia or even directly invaded into alveoli,posing potential threats to human and animals health.
livestock and poultry house;microbe aerosol;particle size distribution;potential threat
X172
:B
:1005-944X(2014)11-0101-05
国家自然科学基金项目:“动物舍微生物气溶胶传播模式研究”[30571381]。
