含1,2,4-三唑希夫碱结构的6-取代吲哚衍生物的微波合成及其抗菌活性研究
2014-02-21刘兴利石治川赵志刚王晓红
刘兴利, 石治川,赵志刚,王晓红
(西南民族大学化学与环境保护工程学院, 四川 成都 610041)
含1,2,4-三唑希夫碱结构的6-取代吲哚衍生物的微波合成及其抗菌活性研究
刘兴利, 石治川,赵志刚,王晓红
(西南民族大学化学与环境保护工程学院, 四川 成都 610041)
在微波辐射条件下, 以吲哚-6-甲酸甲酯为原料, 设计合成了8个含1, 2, 4-三唑结构单元的希夫碱型吲哚衍生物.通过微波法和常规法的研究对比发现, 使用微波法后, 产率从54% ~ 72% 提高到75% ~ 92%, 反应时间从80 ~ 120分钟缩短到8 ~ 10分钟. 所有化合物的结构经1H NMR, IR, ESI-MS及元素分析确证. 初步的抗菌活性表明, 化合物5b和5c分别对大肠杆菌和金黄色葡萄球菌有一定的抑制作用.
1, 2, 4-三唑; 吲哚; 微波合成; 抗菌活性
1, 2, 4-三唑类希夫碱衍生物因其具有抗炎、抗菌、抗癌、除草和植物生长调节等广泛的生物活性, 一直是杂环化学研究领域的热点[1-5]. 在生物化学研究中, 杂环化合物中含有的N、O、S等杂原子可以参与生物体中氢键的形成, 并且与生物环境有亲和性, 在生物体内易发生相互作用而导致活性因子叠加; 将含有N、O、S等杂原子的杂环基团引入到1, 2, 4-三唑母体中有可能增强此类化合物的生物活性[6]. 而吲哚及其衍生物因其结构中含有N原子, 是一种重要的杂环化合物, 广泛应用于医药、农药、香料等领域[7-9]. 因此, 设计合成新的含1, 2, 4-三唑结构的吲哚希夫碱衍生物用于各种药物开发并且与其他希夫碱衍生物进行比较具有重要的理论和现实意义.
随着人们环保意识的提高, 绿色合成的方法受到广泛的关注. 微波合成技术在有机合成中的应用日益普遍,为有机合成提供了一个独特和环境友好的合成过程, 是绿色化学的一个重要组成部分[10-11]. 本课题组在微波促进有机合成的研究已经取得了相当大的进展[12-14]. 纵观国内外文献, 合成含有1, 2, 4-三唑结构的吲哚希夫碱化合物还少见报道. 为了进一步拓展希夫碱化合物的合成和抗菌活性研究, 结合我们课题组在微波合成方面的研究基础. 本文在微波辐射条件下从吲哚-6-甲酸甲酯出发, 经过肼解、成盐、成环等多步反应在吲哚6位引入带氨基的1, 2, 4-三唑环, 然后三唑环上的氨基在微波辐射条件下再与各种芳香醛作用形成含三唑结构单元的新型吲哚希夫碱化合物. 其合成线路见Scheme 1.

Scheme1. 目标化合物5a ~ 5h的合成路线
1 实验部分
1.1 仪器和试剂
INOVA-400 MHz核磁共振仪 (Me4Si作内标, DMSO-d6作溶剂, 美国Varian 公司); FINNIGAN-LCQDECA型质谱仪(美国菲立根公司); IR-200型红外光谱仪 (KBr压片, 美国Nicolet 公司); Vario Micro Cube型元素分析仪(德国元素公司); X-4型数字显示显微熔点测定仪 (温度计未经校正,北京泰克仪器有限公司); XH-100A商用微波反应器(北京祥鹄科技发展有限公司).
所用试剂均为市售化学纯或分析纯.
1.2 中间体2的合成
将3.15 g (0.018 mol) 吲哚-6-甲酸甲酯 1溶于15 mL 80%的水合肼中, 在微波辐射 (350W)下反应10 min (TLC监测反应进程), 冷却后析出黄色固体2.65 g; 产率为97%; m.p. 193 ~ 194℃;1H NMR (DMSO-d6, 400 MHz) δ: 11.38 (s, 1H, indole-NH), 9.65 (s, 1H, CONH), 7.93 (s, 1H, indole-CH in 2-moiety), 7.56 (d, J = 8.4 Hz, 1H, ArH), 7.51 ~ 7.48 (m, 2H, ArH), 6.47 (s, 1H, indole-CH in 3-moiety), 4.44 (s, 2H, NH2); IR (KBr) v: 3438, 3312, 1628, 1527, 1459, 1271, 777 cm-1; ESI-MS m/z (%): 174 [(M-1)-, 100]. Anal.calcd for C9H9N3O: C 61.70, H 5.18, N 23.99; found C 61.65, H 5.17, N 23.98.
1.3 中间体3的合成
在100 mL圆底烧瓶中加入3 mmol制备好的中间体2, 7 mmol KOH, 6 mmol CS2及30 mL无水乙醇, 室温搅拌15 h, 然后加入大量无水乙醚, 析出黄色沉淀, 过滤, 干燥, 得中间体3.
1.4 中间体4的合成
将中间体3溶于1.5 mL水合肼, 再加入1 mL水, 加热回流5h (TLC监测反应进程), 冷却后倒入冰水中, 用稀盐酸中和反应液至PH ≈ 3, 析出大量沉淀, 滤出固体, 用冷水洗涤几次, 干燥, 得黄色粗品, 用乙醇重结晶得纯品, 产率为83%; m.p. 207 ~ 209℃;1H NMR (DMSO-d6, 400 MHz) δ: 13.81 (s, 1H, NCH), 11.47 (s, 1H, indole-NH), 8.30 (s, 1H, indole-CH in 2-moiety), 7.65 (s, 2H, ArH), 7.51 (s,1H, ArH), 6.51 (s, 1H, indole-CH in 3-moiety), 5.84 (s, 2H, NH2); IR (KBr) v: 3317, 3228, 3118, 2933, 1622, 1560, 1501, 1460, 1320, 954, 717 cm-1; ESI-MS m/z (%): 230 [(M-1)-, 100]. Anal.calcd for C10H9N5S: C 51.93, H 3.92, N 30.28; found C 51.85, H 3.93, N
30.29.
1.5 化合物5的合成通法
微波合成: 将1 mmol 中间体4、1 mmol 芳香醛和3 mL冰醋酸加到10 mL烧瓶中, 然后将混合物放入微波炉中, 在微波辐射 (500W) 下反应8 ~10 min (TLC监测反应进程), 停止反应, 冷至室温, 过滤, 得粗品, DMF-H2O混合溶剂重结晶得纯品.
常规合成: 称取1 mmol芳香醛, 加入10 mL冰醋酸, 微热使之全部溶解; 再取1 mmol化合物4加入其中,加热回流1 ~ 2 h (TLC监测反应进程), 冷却, 有固体析出, 抽滤, 固体用DMF-H2O的混合溶剂重结晶纯品.
5a: 白色晶体, 收率80%; m.p. 235 ~ 237 ℃;1H NMR (DMSO-d6, 400 MHz) δ: 14.02 (s, 1H, NCH), 11.46 (s, 1H, indole-NH), 10.07 (s, 1H, OH), 9.39 (s, 1H, N=CH), 7.99 (s, 1H, indole-CH in 2-moiety), 7.67 (d, J = 8.0 Hz, 1H, ArH), 7.55 ~ 7.35 (m, 4H, ArH), 6.96 (d, J = 8.0 Hz, 1H, ArH), 6.50 (s, 1H, indole-CH in 3-moiety), 3.83 (s, 3H, OCH3); IR (KBr) v: 3357, 3102, 2937, 1582, 1511, 1463, 1409, 1354, 1288, 818 cm-1; ESI-MS m/z (%): 366 [(M+1)+, 100]. Anal.calcd for C18H15N5O2S: C 59.16, H 4.14, N 19.17; found C 59.14, H 4.13, N 19.19.
5b: 红色晶体, 收率88%; m.p. 220 ~ 222 ℃;1H NMR (DMSO-d6, 400 MHz) δ: 14.15 (s, 1H, NCH), 11.45 (s, 1H, indole-NH), 9.79 (s, 1H, N=CH), 7.94 (s, 1H, indole-CH in 2-moiety), 7.89 (d, J = 8.0 Hz, 2H, ArH), 7.80 (d, J = 8.0 Hz, 2H, ArH), 7.67 (d, J = 8.0 Hz, 1H, ArH), 7.51 ~ 7.49 (m, 2H, ArH), 6.51 (s, 1H, indole-CH in 3-moiety); IR (KBr) v: 3317, 3100, 2932, 1552, 1482, 1399, 1352, 1279, 812 cm-1; ESI-MS m/z (%): 399 [(M+1)+, 100]. Anal.calcd for C17H12BrN5S: C 51.27, H 3.04, N 17.58; found C 51.30, H 3.04, N 17.59.
5c: 黄色晶体, 收率82%; m.p. 220 ~ 222 ℃;1H NMR (DMSO-d6, 400 MHz) δ: 13.65 (s, 1H, NCH), 11.48 (s, 1H, indole-NH), 9.87 (s, 1H, N=CH), 7.95 (d, J = 8.0 Hz, 3H, ArH, indole-CH in 2-moiety), 7.65 (d, J = 8.0 Hz, 3H, ArH), 7.52 ~ 7.48 (m, 2H, ArH), 6.49 (s, 1H, indole-CH in 3-moiety); IR (KBr) v: 3421, 3098, 2929, 1599, 1552, 1485, 1405, 1354, 1278, 817 cm-1; ESI-MS m/z (%): 252 [(M-1)-, 100]. Anal.calcd for C17H12ClN5S: C 57.71, H 3.42, N 19.79; found C 57.73, H 3.41, N 19.80.
5d: 黄色晶体, 收率90%; m.p. 231 ~ 233 ℃;1H NMR (DMSO-d6, 400 MHz) δ: 14.22 (s, 1H, NCH), 11.44 (s, 1H, indole-NH), 10.01 (s, 1H, N=CH), 8.70 (s, 1H, ArH), 8.48 (d, J = 8.0 Hz, 1H, ArH), 8.39 (d, J = 8.0 Hz, 1H, ArH), 7.94 (s, 1H, indole-CH in 2-moiety), 7.88 (t, J = 8.0 Hz, 1H, ArH), 7.68(d, J=8.0 Hz, 1H, ArH), 7.52~7.50(m, 2H, ArH), 6.52 (s, 1H, indole-CH in 3-moiety); IR (KBr) v: 3426, 3105, 2938, 1617, 1531, 1470, 1350, 1268, 727 cm-1; ESI-MS m/z (%): 365 [(M+1)+, 100]. Anal.calcd for C17H12N6O2S: C 56.04, H 3.32, N 23.06; found C 56.05, H 3.32, N 23.07.
5e: 黄色晶体, 收率88%; m.p. 250 ~ 252 ℃;1H NMR (DMSO-d6, 400 MHz) δ: 14.23 (s, 1H, NCH), 11.47 (s, 1H, indole-NH), 10.07 (s, 1H, N=CH), 8.40 (d, J = 8.0 Hz, 2H, ArH), 8.20 (d, J = 8.0 Hz, 2H, ArH), 7.96 (s, 1H, indole-CH in 2-moiety), 7.69 (d, J = 8.0 Hz, 1H, ArH), 7.53 ~ 7.50 (m, 2H, ArH), 6.52 (s, 1H, indole-CH in 3-moiety); IR (KBr) v: 3391, 3097, 2943, 1508, 1408, 1346, 1271, 843cm-1; ESI-MS m/z (%): 365 [(M+1)+, 100]. Anal.calcd for C17H12N6O2S: C 56.04, H 3.32, N 23.06; found C 56.07, H 3.31, N 23.05.
5f: 粉红色晶体, 收率78%; m.p. 233 ~ 235 ℃;1H NMR (DMSO-d6, 400 MHz) δ: 14.11 (s, 1H, NCH), 11.48 (s, 1H, indole-NH), 9.86 (s, 1H, OH), 9.58 (s, 1H, N=CH), 7.93 (s, 1H, indole-CH in 2-moiety), 7.68 (d, J = 8.0 Hz, 1H, ArH), 7.51 ~ 7.32 (m, 5H, ArH), 7.04 ~ 7.02 (m, 1H, ArH), 6.52 (s, 1H, indole-CH in 3-moiety); IR (KBr) v: 3429, 3320, 2936, 1621, 1577, 1494, 1369, 1286, 723 cm-1; ESI-MS m/z (%): 336 [(M+1)+, 100]. Anal.calcd for C17H13N5OS: C 60.88, H 3.91, N 20.88; found C 60.85, H 3.91, N 20.87.
5g: 粉红色晶体, 收率75%; m.p. 259 ~ 261 ℃;1H NMR (DMSO-d6, 400 MHz) δ: 14.03 (s, 1H, NCH), 11.46 (s, 1H, indole-NH), 10.41 (s, 1H, OH), 9.38 (s, 1H, N=CH), 7.98 (s, 1H, indole-CH in 2-moiety), 7.79 (d, J = 8.0 Hz, 2H, ArH), 7.66 (d, J = 8.0 Hz, 1H, ArH), 7.52 ~ 7.49 (m, 2H, ArH), 6.95 (d, J = 8.0 Hz, 2H, ArH), 6.50 (s, 1H, indole-CH in 3-moiety); IR (KBr) v: 3419, 3146, 1599, 1512, 1445, 1357, 1264, 826 cm-1; ESI-MS m/z (%): 336 [(M+1)+, 100]. Anal.calcd for C17H13N5OS: C 60.88, H 3.91, N 20.88; found C 60.90, H 3.90, N 20.87.
5h: 黄色晶体; 收率92%; m.p. 240~242 ℃;1H NMR(DMSO-d6, 400 MHz) δ: 14.19(s, 1H, NCH), 11.43(s, 2H, OH, indole-NH), 10.35(s, 1H, N=CH), 8.73(d, J=8.0 Hz, 1H, ArH), 8.09(d, J=8.0 Hz, 1H, ArH), 7.94 (s, 1H, indole-CH in 2-moiety), 7.91 (s, 1H, ArH), 7.68 (d, J = 8.0 Hz, 1H, ArH), 7.57 ~ 7.40 (m, 4H, ArH), 7.27 (d, J = 8.0 Hz, 1H, ArH), 6.51 (s, 1H, indole-CH in 3-moiety); IR (KBr) v: 3393, 3109, 2930, 1562, 1466, 1366, 1319, 1282, 732 cm-1; ESI-MS m/z (%):386 [(M+1)+, 100]. Anal.calcd for C21H15N5OS: C 65.44, H 3.92, N 18.17; found C 65.40, H 3.92, N 18.18.
2 结果与讨论
2.1 合成方法比较
微波与常规合成化合物5a ~ 5h的实验结果见表1. 由表1可以看出, 在微波辐射条件下, 以优良产率得到了8个含1, 2, 4-三唑结构的吲哚希夫碱化合物. 微波法与常规法比较具有以下优势: (1) 反应速率增大了7.5 ~ 15倍, 反应所需时间由常规法的80 ~ 120 min缩短到微波法的8 ~ 10 min, 大大缩短了反应时间; (2) 目标分子钳的产率得到较大的提高, 微波法的产率在75% ~ 92%之间, 而常规加热法的产率只在54% ~ 72%之间; 这主要是因为微波反应是具有极强的热效应, 可以从物质分子的内部进行加热, 可以大大的降低反应的活化能, 使反应速度极大地提高, 所以反应的时间短, 同时副反应少, 副产物也少, 故产率提高; (3) 大大节省了溶剂的用量, 由常规法的10 mL减少到3 mL. 因此在微波辐射, 是一种快捷、高效、安全、绿色化的合成6-取代吲哚衍生物的好方法.

表1 微波法与常规法合成目标物5a ~ 5h的比较
2.2 目标物5a ~ 5h的结构确证
在1H NMR 谱图中, δ 13.65 ~ 14.23 ppm处的单峰属于亚胺-CH=N-键, 证明该氢原子两边的芳环与三唑环具有加大的去屏蔽效应; 没有出现化合物4的NH2(δ 5.84 ppm)峰, 表明希夫碱已经完全生成. 在IR谱图中, 大约在3317 ~ 3429 cm-1附近出现强的N-H键的伸缩振动吸收峰, 在1604 cm-1附近出现强吸收带为三唑环中C=N的吸收峰; 1300 cm-1附近出现的吸收峰是C=S的伸缩振动峰, 这说明衍生物中的硫原子是以硫羰基的形式存在,根据这些特征峰的存在, 证明目标产物特征结构的正确性. 从质谱图中可见, 化合物5a ~ 5h均能给出分子离子峰, 其m/z与相应分子式的分子量是一致的. 元素分析结果表明, 所有化合物的组成与其实验式相符. 综上所述,化合物5a ~ 5h所有光谱和元素分析数据与其结构式符合, 表明所合成的化合物为目标化合物.
2.3 生物活性测试
化合物5a ~ 5h的抗菌活性测试采用了纸片扩散法和微量稀释法. 选取了革兰氏阳性菌(枯草芽孢杆菌和金黄色葡萄球菌)和革兰氏阴性菌(大肠杆菌和绿脓杆菌)作为受试菌种; 阿莫西林和环丙沙星作为标准对照药品. 测试结果表明, 我们所合成的含三唑席夫碱的6-取代吲哚衍生物5b对大肠杆菌有一定的抑制作用, 同时5c对金色葡萄球菌也具有一定的抗菌活性. 有关化合物的其他抗菌活性和结构与抗菌活性之间的关系有待进一步研究.
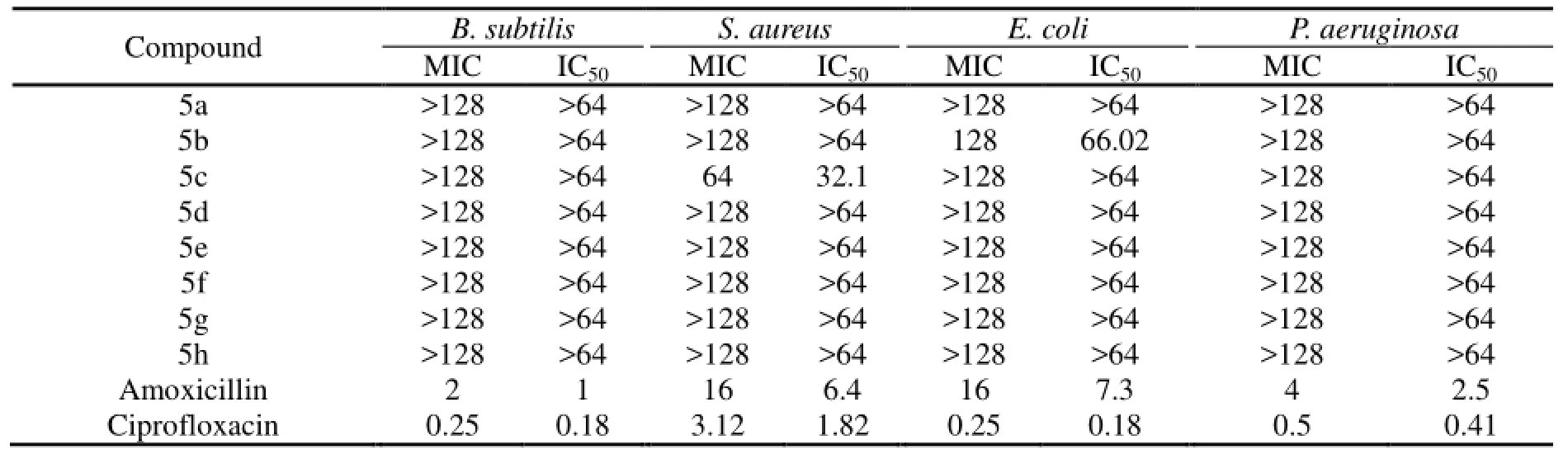
表2 化合物5a ~ 5h的抗菌活性测试
[1] KUMAR B M, MOHANA K N, MALLESHA L. Synthesis and antiproliferative activity of some new fluorinated Schiff bases derived from 1,2,4-triazoles [J]. Journal of Fluorine Chemistry, 2013, 156 (1): 15-20.
[2] BEKIRCAN O, BEKTAS H. Stnthesis of new bis-1,2,4-triazole derivatives [J]. Molecules, 2006, 11 (6): 469-477.
[3] CZOLLNER L, SZILAGYI G, JANAKY J. Synthesis of new 1,5-diphenyl-3-H-1,2,4-triazoles substituted with H-, Alkyi, or Carboxyl groups at C-3 [J]. Archiv der Pharmazie, 1990, 323 (4): 225-227.
[4] AGGARWAL N, KUMAR R, DUREJA P, et al. Synthesis, antimicrobial evaluation and QSAR analysis of novel nalidixic acid based 1,2,4-triazole derivatives [J]. European Journal of Medicinal Chemsitry, 2011, 46 (9): 4089-4099.
[5] 王喜存, 权正军, 李政. 微波促进下3-(2-苯并呋喃基)-4-氨基-5-巯基-1,2,4-三唑及其衍生物的合成 [J]. 有机化学, 2005, 25 (9): 1089-1093.
[6] 陈水生, 杨松, 李慧泉, 等. 含杂环基团的1,2,4-三唑衍生物的合成及其结构表征 [J]. 化学试剂, 2009, 31 (7): 507-510.
[7] DAREHKORDI A, RAHMANI F, HASHEMI V. Synthesis of new trifluoromethylated indole dericatives [J]. Tetrahedron Lett, 2013, 54 (35): 4689-4692.
[8] PENG QIONG, WANG HUIQUAN, TONG JIANHUA, et al. Effects of indole-2-acetic acid and auxin transport inhibitor on auxin distribution and development of peanut at pegging stage [J]. Scientia Gorticulturae, 2013, 162: 76-81.
[9] POLITANSKAYA L V, CHUIKOV I P, SHTEINGARTS V D. Synthesis of indoles with a polyfluorinated benzene ring [J]. Tetrahedron, 2013, 69 (39): 8477-8486.
[10] NGUYEN H H, KURTH M J. Microwave-assisted synthesis of 3-nitroindoles from N-aryl enamines via intramolecular arene-alkene coupling [J]. Org Lett, 2013, 15(2): 362-365.
[11] READ L M, GUNDERSEN L L. Synthesis of phenanthridine derivatives by microwave-mediated cyclization of o-furyl (allyamino) arenes[J]. J Org Chem 2013, 78(3): 1311-1316.
[12] ZHAO ZHI-GANG, SHI ZHI-CHUAN, LIU MIN, et al. Microwave-assisted synthesis and in vitro antibacterial activity of novel steroidal thiosemicarbazone derivatives [J]. Bioorg Med Chem Lett, 2012, 22 (24): 7730-7734.
[13] ShI ZHI-CHUAN, ZHAO ZHI-GANG, LIU XING-LI, et al. Synthesis of new hyodeoxycholic acid thiosemicarbazone derivatives under solvent-free conditions using microwave [J]. Chin Chem Lett, 2011, 22 (4): 405-408.
[14] 杨学军, 石治川, 赵志刚. 单缩二氨基硫脲的微波合成及其抗菌活性 [J]. 合成化学, 2011, 19 (3): 352-355.
Synthesis and inhibitory activities of novel 6-substituted indole derivatives containing 1,2,4-triazole Schiff base units promoted by microwave irradiation
LIU Xing-li, SHI Zhi-chuan, ZHAO Zhi-gang, WANG Xiao-hong
(School of Chemistry and Environmental Protection Engineering, Southwest University for Nationalities, Chengdu 610041, P.R.C.)
Eight novel indole derivatives containing 1,2,4-triazole Schiff base units are efficiently synthesized via a method employing microwave irradiation by using Methyl indole-6-carboxylate as starting material. Compared with a conventional method, the yields are increased from 54% ~ 72% to 75% ~ 92% and the reaction times are reduced from 80 ~ 120 min to 8 ~ 10 min. The structures of these novel molecular tweezers are characterized by1H NMR, IR, ESI-MS spectra and elemental analysis. The preliminary bioassay test indicates that compounds 5b and 5c exhibit inhibitory activity againstEscherichia coliandStaphylococcus aureus.
1,2,4-triazole; indole; microwave synthesis; inhibitory activity
O626, R914
A
1003-4271(2014)01-0044-05
10.3969/j.issn.1003-4271.2014.01.09
2013-12-12
刘兴利(1966-), 女, 教授, 从事药物分析与药物合成研究.
四川省应用基础研究项目(No. 2012JY0028)和国家外专局外国文教专家项目(No. 2012-13)
