红尾皇冠鱼无乳链球菌病LAMP检测方法的建立与应用
2014-02-15姚学良徐晓丽李贺密包海岩任涵玮郑艳坤
姚学良,徐晓丽,李贺密,包海岩,任涵玮,郑艳坤
(天津市水产技术推广站,天津300221)
红尾皇冠鱼Aequidens rivulatus 又名绿面皇冠,隶属于慈鲷科,原产于南美洲,为当地的食用鱼。1999年作为观赏鱼被引入中国香港,2000年在中国大陆繁殖成功。红尾皇冠鱼饲养要求不高,深受广大观赏鱼爱好者的喜爱,但随着其养殖的规模化、集约化发展,红尾皇冠鱼病害问题凸显。中国学者一直致力于食用鱼的病害诊断与防治,对观赏鱼病害的诊断和防治基本沿用食用鱼的方法,有关观赏鱼疾病诊断与防治的研究目前鲜有报道。
无乳链球菌Streptococcus agalactiae是在慈鲷科观赏鱼中流行的一种细菌病,目前该菌的诊断主要通过对病原菌的分离培养和血清学方法检测[1],该方法费时且缺乏准确性。PCR和Real time PCR的应用提高了微生物检测的准确性[2-3],但复杂的操作技术使其在生产实践中一直未得到广泛应用。因此,操作简单、快速的野外现场检测方法亟待研发。环介导等温扩增技术(loop -mediated isothermal mplification,LAMP)是由Notomi等[4]于2000年首次建立的体外链置换核酸扩增方法,近年来被广泛研究与应用。它利用靶序列上6 个关联区域设计的4 条特异引物和1种高活性链置换DNA 聚合酶(BstDNA polymerase),在恒温下对目的片段的扩增效率可达109~1010个数量级,基于该原理的LAMP 技术已在水产动物细菌、病毒、寄生虫病原的快速检测中被广泛研究与应用[5-8]。与常规的基因诊断技术相比,该技术因其检测时间短、对设备的要求低、结果判断简便等,在现场操作方面具有更大的优势。
1 材料与方法
1.1 材料
1.1.1 菌株 无乳链球菌标准株购自中国普通微生物菌种保藏管理中心;无乳链球菌、美人鱼发光杆菌Photobacterium damselae、柱状黄杆菌Flavobacterium cloumnare、哈维氏弧菌Vibrio harveyi、嗜水气单胞菌Aeromonas hydrophila、诺卡氏菌Nocardia asteroides、爱德华氏菌Edwardsiella tarda、维氏气单胞菌Aeromonas veronii、鳗利斯顿氏菌Listonella anguillarum、创伤弧菌Vibrio vulnificus 参考株为天津市水产技术推广站保藏。
1.1.2 主要试剂 BstDNA ploymerase 购自New England Biolab 公司,DL2000 DNA Marker 购自大连宝生物工程有限公司,钙黄绿素购自Sigma公司,FTA 卡购自GE 公司。
1.2 方法
1.2.1 LAMP 引物设计 依据GenBank 报道的无乳链球菌的 cfb 基因保守序列(登录号:X72754.1),设计两对LAMP 引物,包括两条外引物(F3、B3)和两条内引物(FIP、BIP),引物序列见表1。

表1 无乳链球菌cfb 基因LAMP 检测的引物序列Tab.1 Details of LAMP primers designed for detection of cfb gene of Streptococcus agalactiae
1.2.2 LAMP 反应及条件优化
(1)LAMP 扩增。LAMP 反应体系(共25 μL):10 × Thermo Polbuffer 2.5 μL,10 mmol/L dNTP 1.5 μL,5 μmol/L 内 引 物 各1 μL,40 μmol/L外引物各1 μL,模板1 μL,BstDNA polymerase(8 U)1 μL,钙黄绿素1 μL,ddH2O 14 μL。于65 ℃下孵育40 min,85 ℃下终止反应10 min。肉眼观察产物的反应情况,并用10 g/L 琼脂糖凝胶进行电泳分析。
(2)条件优化试验。分别改变LAMP 扩增条件:反应时间、反应温度、内外引物浓度,用电泳观察扩增结果。
(3)特异性试验。用上述建立的LAMP 方法分别对无乳链球菌、美人鱼发光杆菌、柱状黄杆菌、哈维氏弧菌、嗜水气单胞菌、诺卡氏菌、爱德华氏菌、维氏气单胞菌、鳗利斯顿氏菌和创伤弧菌10 个菌株进行扩增,验证方法的特异性。
(4)灵敏度验证试验。将浓度为3 ×108cfu/mL的原始菌液进行10 倍梯度稀释,分别作为模板,进行LAMP 灵敏度检测。另取1.0 mL 浓度为3 ×108cfu/mL的无乳链球菌培养液,按文献[9]中的方法进行稀释、倾注培养和细菌计数。
(5)LAMP 产物的酶切鉴定。利用限制性内切酶BamHⅠ对LAMP 扩增产物进行酶切鉴定。反应体系(共20 μL):10 ×K Buffer 2 μL,100 ×BSA 0.2 μL,BamHⅠ内切酶0.5 μL,LAMP 扩增产物2 μL,ddH2O 15.3 μL。于37 ℃条件下作用16 h,电泳观察酶切结果。
(6)LAMP在无乳链球菌病检测中的应用。为评价无乳链球菌LAMP 检测方法的有效性,分别对攻毒红尾皇冠鱼、健康无病的红尾皇冠鱼进行LAMP 检测。取红尾皇冠鱼的肝脏约0.1 g,置于采样管中,用研磨棒快速将样品研磨至浆状;用吸管吸取浆状的样品使FTA 膜片充分润湿,再吸取快速干燥液滴于FTA 膜片上,将FTA 膜片在室温下静置5 min,然后转移到漂洗管内,将漂洗管剧烈震荡3 min,再将漂洗管内的FTA 膜片转移到扩增检测管内,于65 ℃下保温40 min。同时取无乳链球菌标准株和双蒸水分别做阳性对照和阴性对照。同步取样品鱼组织进行细菌分离、培养鉴定。
2 结果与分析
2.1 LAMP 检测方法的建立
本研究中建立了无乳链球菌肉眼可判读的LAMP 检测技术(图1),并对反应时间、反应温度和内外引物浓度等条件进行优化。试验结果表明:就本研究中拟定的反应体系而言,65 ℃时效果最佳(图2);体系在30 min 时即有扩增反应,60 min 时效果最佳(图3);内外引物浓度除(0.4,0.05)μmol/L 组条带较弱外,其余3 组均无明显差异(图4)。

图1 无乳链球菌的LAMP 检测结果Fig.1 Detected result of Streptococcus agalactiae LAMP
2.2 特异性试验
本研究中建立的扩增方法,对无乳链球菌标准菌株和无乳链球菌参考株呈阳性反应;对美人鱼发光杆菌、柱状黄杆菌、哈维氏弧菌、嗜水气单胞菌、诺卡氏菌、爱德华氏菌、维氏气单胞菌、鳗利斯顿氏菌、创伤弧菌9 株病原菌均呈阴性反应(图5)。

图2 反应温度对LAMP 扩增的影响Fig.2 Effect of temperatures on LAMP amplification
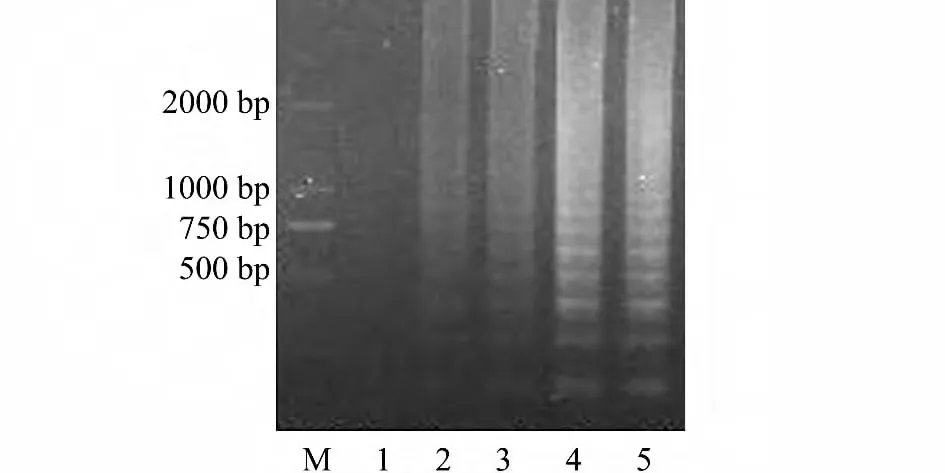
图3 反应时间对LAMP 扩增的影响Fig.3 Effect of time on LAMP amplification

图4 内外引物浓度对LAMP 扩增的影响Fig.4 Effect of primer concentration on LAMP amplification
2.3 灵敏度试验
当菌液稀释1 ×107倍及以上时扩增无产物。计数结果表明:1 ×106倍稀释的细菌培养液的菌浓度为3.7 ×102cfu/mL,即LAMP 检测的灵敏度为3.7 ×101~3.7 ×102cfu/mL(图6)。

图5 LAMP 特异性试验结果Fig.5 Results of specificity test on LAMP
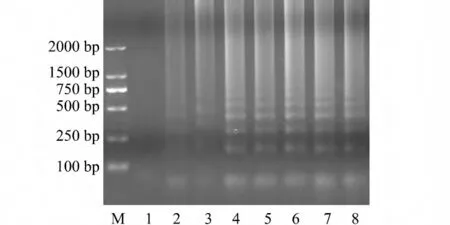
图6 无乳链球菌LAMP 检测的灵敏度Fig.6 Sensitivity of LAMP in the detection of Streptococcus agalactiae
2.4 酶切试验
采用限制性内切酶BamHⅠ进行酶切,以确定所得产物为cfb 基因的扩增产物。BamHⅠ内切酶位于内引物B1c 上,根据Notomi等[4]已报道的计算方法,计算出经BamHⅠ酶切后得到的片段分别为198、246、327 bp。酶切产物电泳后得到与预期相同的片段(图7),说明建立的LAMP 扩增产物为无乳链球菌cfb 基因的目的片段。

图7 LAMP 产物的BamHⅠ酶切分析Fig.7 Analysis of LAMP products digested with BamHⅠ
2.5 LAMP 技术在无乳链球菌检测中的应用
对取自健康红尾皇冠鱼的肝脏组织进行LAMP检测,结果呈阴性。而对取自攻毒红尾皇冠鱼的肝脏组织进行LAMP 检测,结果呈阳性(图8),且用该技术检测的结果与同步对所取鱼组织样品进行的常规生化鉴定和16S rRNA 细菌分离鉴定的结果一致。此结果验证了LAMP 技术的准确性和灵敏度均较高,可以在病害流行之前发现养殖鱼类携带病原菌的情况,有利于及时采取有效防控措施。

图8 患病红尾皇冠鱼肝脏组织中无乳链球菌的LAMP检测结果Fig.8 Result of LAMP in the detection of S.agalactiae in liver of green terror A.rivulatus
3 讨论
链球菌病是一种广泛危害水产养殖鱼类的致死性细菌病,给水产养殖业造成了巨大的经济损失。无乳链球菌属人、畜、鱼共患病原菌,是女性生殖道、新生儿感染和奶牛乳腺炎的重要病原菌[10-11]。近年来,国内鱼源无乳链球菌对水产行业威胁多集中在罗非鱼产业[12-14],已引起有关部门的重视,而由其引起的观赏鱼疾病鲜有报道。观赏鱼病害防治与食用鱼大体相同,但因其观赏性,在防治上要求更高的技术支持,如突眼、竖鳞等疾病,即使治愈,也会严重影响其商业价值。而名贵观赏鱼因其价格昂贵,对传统的疾病检测技术提出了新的挑战。因此,能够在观赏鱼养殖生产现场,快速、准确地检测早期病原的方法亟待研发。
cfb 基因为B 群链球菌特有基因(GBS - specificgene cfb,CAMP factor - specificgene),编 码CAMP 因子或溶血促进因子(cohemolysin)的膜外蛋白,它能与金黄色葡萄球菌分泌的B 溶血毒素神经磷脂酶(sphingomyelinase)作用呈CAMP 反应[15-16],即促进绵羊红细胞的溶血及胞膜成分的溶解。CAMP 因子是一种强毒力因子,在抗吞噬作用与细菌入侵宿主细胞等方面起着重要作用。其类似因子在A、C和G 群链球菌中也存在,但它们编码的基因间同源性较低。因此,CAMP 因子编码基因cfb 已成为鉴定无乳链球菌的重要指标之一。
本研究中,利用cfb 基因保守序列设计两对LAMP 特异引物对无乳链球菌进行扩增。结果显示:仅无乳链球菌扩增出特异性片段,而其他9 株致病菌株均未扩增出该片段,这证明cfb 基因作为链球菌种间鉴定依据的可行性。为了确定最佳检测条件,本研究中,针对反应温度、反应时间和内外引物浓度等条件进行优化,初步建立了较稳定、特异的无乳链球菌LAMP 检测体系。温度优化试验显示,60、63、65 ℃下反应效率差异不大,为综合考虑酶的催化效率、反应的稳定性和特异性,将最终的反应温度确定为65 ℃。为提高反应特异性,检测时间确定为40 min。内外引物浓度参照Notomi等[4]的方法,内引物(1.6 μmol/L)与外引物(0.20 μmol/L)的比例为8∶ 1,为了提高反应的特异性对该引物浓度做了稀释,但内外引物浓度比例不变,内外引物浓度分别为(0.4,0.05)、(0.8,0.10)、(1.2,0.15)、(1.6,0.20)μmol/L。结果表明,(0.8,0.10)μmol/L 内 外 引 物 浓 度 组 与(1.6,0.20)μmol/L 内外引物浓度组无明显差异,最后将反应的内外引物浓度确定为(0.8,0.10)μmol/L。此外,反应显色剂采用钙黄绿素,浓度参照张琳等[17]的方法,采用0.05 mmol/L 钙黄绿素和0.6 mmol/L MnCl2的混合物。钙黄绿素直接加入反应体系,从反应开始至结果判读无需再打开反应管,可以有效地避免因形成气溶胶而导致假阳性的产生。此外,试验直接以菌体作为检测模板,无需煮沸或提取DNA,制备LAMP 模板。现场应用结合FTA 卡快速提取核酸,排除了病鱼组织对试验的影响。两种制备模板的方法均具有简便、快速的特点。该方法从样本处理到结果判读仅需1 h。
综上所述,本研究中建立了操作简便、灵敏度高、判读简单的检测方法,在红尾皇冠鱼无乳链球菌病的野外快速检测方面具有极大的实用性。
[1]汤炜,周雪,于立权,等.无乳链球菌及其血清型的PCR 方法鉴定[J].中国预防兽医学报,2013,35(7):595 -598.
[2]樊海平,吴斌,张新艳,等.双重PCR 检测罗非鱼源无乳链球菌方法的建立[J].福建农业学报,2014,29(1):8 -11.
[3]李莉萍,王瑞,黄婷,等.2007—2012年中国罗非鱼无乳链球菌流行菌株血清型分析[J].大连海洋大学学报,2014,29(5):469 -475.
[4]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):63.
[5]Itano T,Kawakam I H,Kono T,et al.Detection of fish nocardiosis by loop-mediated isothermal amplification[J].J App Microbiol,2006,100(6):1381 -1387.
[6]Cai S H,Lu Y S,Wu Z H,et al.Loop-mediated isothermal amplification method for rapid detection of Vibrio alginolyticus,the causative agent of vibriosis in mariculture fish[J].Applied Mrcobiology,2010,50(5):480 -485.
[7]He L,Xu H S.Development of a multiplex loop-mediated isothermal amplification(mLAMP)method for the simultaneous detection of white spot syndrome virus and infectious hypodermal and hematopoietic necrosis virus in penaeid shrimp[J].Aquaculture,2011,311:94 -99.
[8]Ei -matboul I M,Soliman H.Rapid diagnosis of Tetracapsuloides bryosalmonae,the causative agent of proliferative kidney disease(PKD)in salmonid fish by a novel DNA amplification method,loop mediated isothermal amplification(LAMP)[J].Parasitol Res,2005,96(4):277 -284.
[9]卫生部食品卫生监督检验所.GB4789.2—1994 食品卫生微生物学检验:菌落总数测定[S].北京:中华人民共和国卫生部,1994.
[10]El Aila N A,Tency I,Claeys G,et al.Genotyping of Streptococcus agalactiae(group B streptococci)isolated from vaginal and rectal swabs of women at weeks of pregnancy[J].BMC Infectious Diseases,2009(9):153.
[11]白龙,郝永清,范利霞,等.奶牛乳腺炎无乳链球菌的分离鉴定[J].畜牧与饲料科学,2010,31(1):96 -97.
[12]柯剑,赵飞,罗理,等.广东省罗非鱼主养区无乳链球菌的分离、鉴定与致病性[J].广东海洋大学学报,2010,30(3):22 -27.
[13]黄艳华,彭亚,刘杰,等.罗非鱼致病性无乳链球菌的分离鉴定及药敏试验[J].南方农业学报,2014,45(3):498 -504.
[14]马艳平,李嘉彬,郝乐,等.广州市罗非鱼源无乳链球菌分离鉴定与致病性研究[J].广东农业科学,2014(6):132 -135.
[15]Jurgens D,Sterzik B,Fehrenbeeh F J.Unspecific binding of group B streptococcal cocytdysin(CAMP factor)to immunoglobulins and its possible role in pathogenicity[J].Journal of Experimental Medicine,1987,165(3):720 -732.
[16]Hensler M E,Quach D,Hsieh C J,et al.CAMP factor is not essential for systemic virulence of Group B Streptococcus[J].Microbial Pathogenesis,2008,44(1):84 -88.
[17]张琳,马利,丁雅苓,等.基于荧光显色的IBVLAMP 检测方法研究[J].西北农林科技大学学报,2012,40(10):38 -44.
