急性温度胁迫对虹鳟肝脏代谢酶活性及生长相关基因表达的影响
2014-02-15管标温海深刘群王金环王庆龙
管标,温海深,刘群,王金环,王庆龙
(中国海洋大学海水养殖教育部重点实验室,山东 青岛266003)
变温动物的生长、代谢、发育等都受到环境温度的影响,在可能的情况下鱼类总是选择在最适宜的环境中生存。许多鱼类会通过降低代谢速率和生长速度来应对较低温度,而温度迅速升高后,鱼类又会很快达到耐受范围,但只能存活很短的时间。温度骤变是鱼类在运输、养殖生产甚至自然条件下都可能面临的胁迫,能抑制鱼类的摄食、生长,从而对鱼类的生理适应和代谢产生重大影响[1]。
鱼类通过内分泌系统来调节新陈代谢和生长,以应对环境的变化和不同的生长阶段[2]。与许多高等脊椎动物一样,鱼类生长发育很大程度上也是通过生长激素(GH)——类胰岛素样生长因子(IGF)轴进行调控的[3]。生长激素能够调控机体的生长、免疫、代谢、渗透调节等多种行为,并通过靶组织与生长激素受体(GHR)结合发挥生理作用[4]。生长激素存在两种受体,即GHR1和GHR2,在多种鱼中均有发现,并且在大多数组织中广泛表达[5]。GH 对生长的促进作用直接或间接地通过IGFs 来实现,包括IGF-1和IGF-2,IGFs具有胰岛素类似物的作用,同时又可促进个体的细胞分化与增殖[6]。其中,IGF -1 通过自分泌和旁分泌作用在多个器官内产生,但主要在肝脏内合成[7],通过血液运送到各个组织,促进细胞的分裂和分化,促进蛋白质的合成,抑制蛋白质的降解,促进机体生长[8]。Shepherd等[9]研究发现,海水养殖罗非鱼Oreochromis mossambicus 脑垂体中的GH 升高,血浆中IGF-1 基因表达水平也升高。而IGF-2在鱼类新陈代谢中的作用尚不清楚。在哺乳动物中,IGF -2 基因表达主要是在胚胎发育阶段[10],而Reinecke等[11]研究发现,IGF-2在幼鱼和成鱼体内均有广泛的表达。IGF-2和IGF-1 有较高的同源性,在鱼类的不同组织中二者的基因表达受到GH 的调控[12],Chen等[13]试验证明,IGF-1和IGF-2 均可刺激罗非鱼快速生长。
血清谷草转氨酶(AST)、谷丙转氨酶(ALT)是联系蛋白质代谢和糖代谢的重要氨基转移酶,是检测肝脏功能是否正常的重要指标。正常情况下,AST和ALT 主要存在于肝脏和其他组织的线粒体内,只有少量被释放到血浆中,因此,血清中的ALT 活性较小[14]。碱性磷酸酶(ALP)是一种在生物界中分布广泛的磷酸酯酶,通常分布于溶酶体内,在溶酶体外的胞浆基质内和内质网内也有少量分布。ALP 的主要生理功能是参与磷及磷酸酯的代谢调节,同时还参与调节机体代谢、钙磷比例和机体信号传导等许多生理活动[15]。而关于这些生理学指标对温度胁迫响应机制的研究目前鲜有报道。
虹鳟Oncorhynchus mykiss 隶属于鲑形目Salmoniformes、鲑科Salmonidae、大马哈鱼属Oncorhynchus,为冷水性优良养殖品种。但虹鳟生活温度适宜区间小,其适宜生长水温为12 ~18 ℃[16],这对虹鳟的养殖和运输等都会产生不利影响。本研究中,进行了高温和低温胁迫对虹鳟血清中转氨酶ALT、AST和ALP 活性的影响以及对血清IGF -1激素含量变化的试验研究,同时分析了急性温度胁迫对虹鳟GHR1、IGF -1和IGF -2 mRNA表达的影响。通过该项研究,探究急性温度胁迫对虹鳟生理适应及代谢机制的影响,尤其是对其肝脏功能的危害程度,旨在丰富鱼类生理学内容,为鱼类运输与养殖提供科学依据。
1 材料与方法
1.1 材料
试验用虹鳟共135 尾,于2012年3月采自山东潍坊某养殖场,试验鱼健康活泼,为同一批次卵孵化。试验开始时虹鳟体质量为(240 ±18)g,体长为(25.7 ±1.7)cm。
试验用仪器和试剂主要有:BS -180 生化分析仪,由深圳迈瑞生物医疗电子股份有限公司生产;ALT、AST、ALP 试剂盒均购自深圳迈瑞生物医疗电子股份有限公司;IGF -1 试剂盒购自天津九鼎医学生物有限公司;RNAiso Reagent 试剂、Taq 酶、DNaseⅠ(RNasefree)、RNasin、RNA 酶和SYBR Premix Ex Taq 均购自TaKaRa 公司。
1.2 方法
1.2.1 试验条件与饲养管理 试验于2012年4月在中国海洋大学鱼类生理与繁育实验室全循环水系统中进行,试验鱼在循环水系统中暂养驯化2 周,暂养及试验期间全循环流水,连续充气,温度为(16 ±1)℃,pH 为7.8 ~8.1,溶解氧(DO)>6 mg/L。试验期间,虹鳟的投喂量和投喂方式与驯化期间相同,每天8:00和16:00 饱食投喂鲟鱼配合饲料。
1.2.2 试验设计与样品采集 试验设计1 个对照组和2 个处理组,分别为A 组(常温对照组,水温为16 ℃)、B 组(低温处理组,水温为6 ℃)、C 组(高温处理组,水温为24 ℃),每组温度变化在1 ℃以内。每个处理组设3 个平行,每个平行放5 尾鱼,共45 尾鱼。将驯化后的虹鳟放入2 个处理组中热应激2 h,再放入正常养殖的循环水系统中恢复。分别在恢复0、6、12、24、48 h 时采样,每个试验组每次采样3 尾。
采样前将试验鱼放入MS -222 麻醉剂(40 ~45 g/L)中麻醉,以减少采样操作等对试验的影响。从鱼尾静脉采血,将采集的血液放于冰箱(4℃)中静置4 ~6 h 后,以12 000 r/min 离心15 min,提取血清并置于超低温冰箱(-80 ℃)中保存备用。采集完血样后迅速解剖试验鱼,取新鲜的肝脏组织于液氮中速冻,然后转移至超低温冰箱(-80 ℃)中保存备用。
1.2.3 ALT、AST和ALP 活性的测定 采用BS -180 生化分析仪测定血清中ALT、AST和ALP 活性。
1.2.4 IGF-1 激素含量的测定 采用放射性同位素(125I)标记的放射免疫法(RIA)测定血清中IGF-1 激素含量。根据IGF-1 试剂盒说明书并结合本实验室条件进行改进,采用半量法进行测定,每个样品设置2 个平行。
1.2.5 实时定量PCR 标准曲线的建立以及目的基因的定量测定 根据Flores等[17]的方法设计GHR-1 实时定量表达引物。根据NCBI 已经克隆得到的IGF -1(M95183.1)和IGF -2(M95184.1)cDNA 的序列,利用Primer 5.0 软件设计实时定量表达。表达所需的引物均由生工生物工程(上海)股份有限公司合成。具体引物如表1所示。
对样品cDNA 进行4 倍梯度稀释,以稀释后的cDNA 为模板进行实时定量PCR,每个模板设3 个平行。PCR 反应体系(共20 μL):SYBR Premix Ex Taq 10 μL,上、下游引物各0.4 μL,模板2 μL,ddH2O 7.2 μL。反应条件:95 ℃下预变性1 min;95 ℃下变性10 s,相应基因退火温度下退火40 s,72 ℃下延伸40 s,共进行40 个循环。实时连续测定扩增过程中产生的荧光,建立标准曲线。

表1 虹鳟GHR-1、IGF-1、IGF-2和18 S 基因表达所用引物Tab.1 Primers used in expression of GHR -1,IGF -1,IGF-2 and 18 S genes in rainbow trout Oncorhynchus mykiss
对样品中的cDNA 进行目的基因扩增,反应体系以及反应条件与标准曲线的建立一致,每个样品设3 个重复。根据实时荧光定量PCR 的结果,以18 S 为内参基因,根据目的基因以及18 S 的Ct值,按照2-ΔΔCt法计算目的基因的相对表达情况。
1.3 数据处理
试验数据均用平均值± 标准误表达。采用SPSS 13.0 软件进行单因素方差分析和邓肯多重比较,显著性水平设为0.05。
2 结果与分析
2.1 急性温度胁迫对虹鳟血清中AST、ALT和ALP 活性的影响
温度胁迫2 h 后,虹鳟血清中AST 活性在低温和高温两个处理组中的变化趋势相同,在胁迫后恢复0 h 时均略有升高,恢复6 h 时达到最大值,且与对照组有显著性差异(P<0.05);恢复12 h 后,AST 活性逐渐降低并恢复至接近对照组水平(图1 -A)。
高温处理组的ALT 活性变化趋势与AST 相同;而低温处理组在胁迫后恢复0 h 时就显著升高(P<0.05),随后逐渐降低至对照组水平(图1 -B)。
低温处理组的ALP 活性,在温度胁迫后恢复6 h 时后均显著低于对照组(P<0.05);而高温组的ALP 活性在温度胁迫后虽有所降低,但与对照组无显著性差异(P >0.05)(图1 -C)。
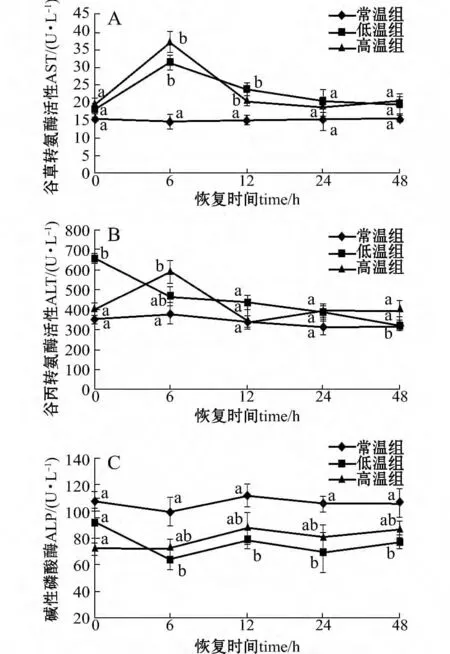
图1 温度胁迫后虹鳟血清中AST、ALT和ALP 活性的变化Fig.1 Changes in serum activities of AST,ALT and ALP in rainbow trout exposed to acute temperature stress
2.2 急性温度胁迫对虹鳟血清中IGF -1 激素含量的影响
温度胁迫对虹鳟血清IGF -1 含量有显著的影响。从图2可见:温度胁迫后恢复0 h 时,两个处理组血清IGF-1 含量均急剧降低,且与对照组有显著性差异(P<0.05);低温处理组血清IGF -1含量在整个试验过程中均处于较低水平,恢复6、12、48 h 时与对照组有显著性差异(P<0.05);而高温处理组血清IGF -1 含量在12 h 后逐渐恢复,在48 h 时达到对照组水平。
2.3 急性温度胁迫对虹鳟肝脏GHR1、IGF-1和IGF-2 mRNA表达的影响
急性温度胁迫对3种基因表达有不同程度的影响。对于GHR1 基因,低温和高温处理组mRNA表达量均有减少,但与对照组无显著性差异(P >0.05),整个试验过程中GHR1 mRNA表达量处于较稳定水平(图3 -A)。

图2 温度胁迫后虹鳟血清中IGF-1 含量的变化Fig.2 Changes in serum IGF-1 level in rainbow trout exposed to acute temperature stress

图3 温度胁迫后虹鳟肝脏中GHR1、IGF-1和IGF-2 mRNA表达量的变化Fig.3 Changes in GHR1,IGF -1,and IGF -2 mRNA expression in liver of rainbow trout exposed to acute temperature stress
对于IGF-1 基因,低温处理组mRNA表达量在整个试验过程中有所降低,但与对照组无显著性差异(P >0.05);而高温处理组IGF -1 mRNA表达量在恢复6、12 h 时显著低于对照组(P<0.05),12 h 后逐渐恢复至对照组水平(图3-B)。
对于IGF -2 基因,温度胁迫后恢复0 h 时,两个处理组mRNA表达量都急剧下降,高温组与对照组有显著性差异(P<0.05),且在整个试验过程中均显著低于对照组(P<0.05),其中高温处理组的下降程度大于低温处理组(图3 -C)。
3 讨论
ALT和AST是两种重要的转氨酶。正常情况下两种酶多存在于细胞的线粒体中,其中尤以肝脏中含量丰富,而血清中活性很低。当机体受到损害时,细胞膜的通透性会发生改变,故胞浆酶释放较多,导致血液中ALT和AST 活力明显升高。Vaglio等[18]给金头鲷Sparus aurata 注射剂量为2.5 mg/kg(体质量)的CdCl2,6 d 后血液中的AST和ALT活性显著升高;Dela Torre等[19]将鲤Cyprinus carpio幼鱼暴露在半致死剂量(1.5 ~1.7 mg/L)的Cd溶液中14 d 后,鲤肝脏中的AST和ALT 活性显著升高,表明Cd 暴露对鲤肝脏已造成损伤。本试验中,虹鳟血清中的ALT和AST 活性都在恢复6 h时有显著升高,表明急性温度胁迫对虹鳟的肝脏产生了破坏作用;24 h 后,随着机体的恢复,两种酶活性逐渐降低。ALP在生物体内能够直接参与调节磷代谢,保持体内钙磷比例相对稳定,同时还能够参与蛋白的分泌和脂质代谢等,是一种重要的代谢调控酶[20]。鱼类处于应激状态时,如饥饿、温度胁迫等,将影响血清中ALP 的活性[21]。本试验中,温度胁迫后低温和高温两个处理组虹鳟血清中的ALP 活性均有降低,表明虹鳟体内代谢受到温度胁迫的影响,且随着常温恢复过程,ALP 活性有升高趋势。
鱼类的生长受到“下丘脑- 垂体- 肝脏轴”的调控,GH是促进机体生长的主要激素。但单独的GH 不能促进鱼类的生长,IGF-1是GH 发挥促生长作用的重要中介因子。Bolton等[22]研究发现,直接给虹鳟注射一定剂量的GH 对其生长无促进作用;而McComick等[23]研究发现,给大西洋鲑Salmo salar 注射猪的IGF -1 后,其生长率能快速提高。许多作者都有报道,有害刺激对于鱼类的生长有较强烈的消极影响。捕捞和禁闭暂养刺激会影响到虹鳟血液中GH、IGF -1和IGF -2 的含量,导致其血液中激素含量降低,从而抑制鱼类正常生长[24]。温度胁迫也会影响罗非鱼的摄食与代谢,Bradley等[25]研究发现,罗非鱼的GH 存在耐受机制,IGF-1 迅速降低,而GH 变化较慢。本试验中,急性温度胁迫后,两个处理组的血清IGF-1含量均显著降低,且在整个试验过程中均低于对照组,虹鳟生长相关基因的mRNA表达量也受到温度的影响,且通常与激素含量的变化相对应。
GH是促进生长的主要基因,而GH 发挥作用需要GHR 介导。Ayson等[26]研究发现,饥饿和恢复投喂能使点斑蓝子鱼Siganus guttatus GH mRNA表达量略有降低;Matejka[27]研究发现,小鼠肾脏和肝脏受损后,GHR mRNA 水平显著减少。本试验中,温度胁迫后两个处理组GHR1 mRNA表达量均略有降低,这与Bradley等[25]对尼罗罗非鱼Oreochromis niloticus 禁食和投喂试验结果相类似。这也从另一方面表明,血清GH 含量可能减少。对许多鱼的研究发现,IGF -1 mRNA在很多组织中都有表达,其中肝脏中表达最丰富[28],这表明肝脏对于IGF-1 的合成和分泌起着重要作用。IGF -1的表达量受到很多环境因素的影响,Duan[29]研究表明,海鲷Pagrosomus major 较少的摄食量将导致IGF-1 mRNA 水平下降;Larsen等[30]研究发现,低温处理下银大麻哈鱼Oncorhynchus kisutch 的IGF-1 mRNA 水平明显降低。本研究中,急性温度胁迫后,虹鳟肝脏中IGF -1 mRNA 的表达量有所降低,其中高温胁迫后恢复6 h 时显著低于对照组,直到24 h 时才恢复到接近对照组水平。虹鳟属冷水性鱼类,低温胁迫时,虹鳟通过降低代谢速率、减少摄食等维持机体功能,生长速度减少较慢;而高温胁迫能快速达到虹鳟的耐受限度,生长速度急速下降。许多硬骨鱼的IGF -2 不仅在肝脏中表达丰富,而且在许多其他器官如脑、心脏、肾脏、肌肉等中都有很高的表达量[27]。快速生长的斑点叉尾鮰Ictalurus punctatus 肝脏和肌肉中的IGF-2 mRNA表达量,比慢速生长的斑点叉尾鮰更高,这表明IGF -2在鱼类生长中起重要作用[31]。本试验中,与GH和IGF -1 相比,肝脏中IGF -2 mRNA 水平下降更明显,这说明肝脏中IGF - 2 mRNA 水平更易受到水温等环境变化的影响。
总之,急性温度胁迫对虹鳟血清中ALT、AST和ALP 活性有不同程度的影响,这说明急性温度胁迫对虹鳟的代谢产生了影响。血清IGF -1 激素含量的变化以及GHR1、IGF -1和IGF -2 mRNA表达量的变化,都说明急性温度胁迫对虹鳟生长产生了不良的影响。高、低温处理组虹鳟的不同变化,表明了冷水鱼类对高温胁迫更敏感,本试验也可为虹鳟的运输及养殖条件优化提供参考。
[1]Blank J M,Morrissette J M,Landeira-Fernandez A M,et al.In situ cardiac performance of Pacific bluefin tuna hearts in response to acute temperature change[J].Experimental Biology,2004,207:881 -890.
[2]Picha M E,Strom C N,Riley L G,et al.Plasma ghrelin and growth hormone regulation in response to metabolic state in hybrid striped bass:effects of feeding,ghrelin and insulin -like growth factor -I on in vivo and in vitro GH secretion[J].General and Comparative Endocrinology,2009,161:365 -372.
[3]Wood A W,Duan C,Bern H A.Insulin-like growth factor signaling in fish[J].International Review of Cytology,2005,243:215-285.
[4]Sánchez J P,Giner J A C,Mingarro M,et al.Overview of fish growth hormone family.New insights in genomic organization and heterogeneity of growth hormone receptors[J].Fish Physiology and Biochemistry,2002,27:243 -258.
[5]Fukamachi S,Meyer A.Evolution of receptors for growth hormone and somatolactin in fish and land vertebrates:lessons from the lungfish and sturgeon orthologues[J].Mol Evol,2007,65:359-372.
[6]Cao Q P,Duguay S J,Plisetskaya E,et al.Nucleotide sequence and growth hormone - regulated expression of salmon insulin - like growth factor I mRNA[J].Molecular Endocrinology,1989,3:2005 -2010.
[7]Cohick W S,Clemmons D R.The insulin - like growth factors[J].Annual Review of Physiology,1993,55:131 -153.
[8]Ayaso E,Nolan C M,Byrnes L.Zebrafish insulin - like growth factor-I:molecular cloning and developmental expression[J].Molecular and Cellular Endocrinology,2002,191(2):137 -148.
[9]Shepherd B S,Sakamoto T,Nishioka R S,et al.Somatotropic actions of the homologous growth hormone(tGH)and prolactin(tPRL177)in the euryhaline teleost,Oreochromis mossambicus[J].Proc Natl Acad Sci,USA,1997,94:2068 -2072.
[10]Baker J,Liu J P,Robertson E J,et al.Role of insulin - like growth factors in embryonic and postnatal growth[J].Cell,1993,75:73 -82.
[11]Reinecke M,Bjornsson B T,Dickho V W W,et al.Growth hormone and insulin-like growth factors in fish:where we are and where to go[J].General and Comparative Endocrinology,2005,142(1/2):20 -24.
[12]Vong Q P,Chan K M,Cheng C H.Quantification of common carp(Cyprinus carpio)IGF - I and IGF - II mRNA by real - time PCR:differential regulation of expression by GH[J].Endocrinology,2003,178:513 -521.
[13]Chen J Y,Chen J C,Chang C Y,et al.Expression of recombinant tilapia insulin-like growth factor-I and stimulation of juvenile tilapia growth by injection of recombinant IGFs polypeptides[J].Aquaculture,2000,181:347 -360.
[14]王丙莲,张迎梅,候亚妮,等.铬铅对泥鳅组织转氨酶活性的影响[J].兰州大学学报:自然科学版,2006,42(3):67 -70.
[15]江琰,文克武,雷远成.意蜂工蜂酸性磷酸酶的纯化及其酶学特性[J].昆虫学报,2004,47(3):310 -315.
[16]曹克驹.名特水产养殖学[M].北京:中国农业出版社,2004:113 -114.
[17]Flores A M,Shrimpton J M.Differential physiological and endocrine responses of rainbow trout,Oncorhynchus mykiss,transferred from fresh water to ion - poor or salt water[J].General and Comparative Endocrinology,2012,175:244 -250.
[18]Vaglio A,Landriscina C.Changes in liver enzyme activity in the teleost Sparus aurata in response to cadmium intoxication[J].Ecotoxicology and Environmental Safety,1999,43(1):111-116.
[19]Dela Torre F R,Salibián A,Ferrari L.Biomarkers assessment in juvenile Cyprinus crapio exposed to waterborne cadmium[J].Environmental Pollution,2000,109:277 -282.
[20]陈清西,陈素丽,石艳,等.长毛对虾碱性磷酸酶性质[J].厦门大学学报:自然科学版,1996,35(2):257 -261.
[21]Mora S D,Sheikholeslami M R,Wyse E,et al.An assessment of metal contamination in coastal sediments of the Caspian Sea[J].Mar Pollut Bull,2004,48(1/2):61 -77.
[22]Bolton J P,Collie N L,Kawauchi H,et al.Osmoregulatory actions of growth hormone in rainbow trout(Oncorhynchus mykiss)[J].Endocrinology,1987,112:63 -68.
[23]McCormick S D,Regish A,O'Dea M F.Are we missing a mineralocorticoid in teleost fish?Effects of cortisol,deoxycorticosterone and aldosterone on osmoregulation,gill Na+,K+- ATPase activity and isoform mRNA levels in Atlantic salmon[J].Gen Comp Endocrinol,2008,157:35 -40.
[24]Liebert A M,Schreck C B.Effects of acute stress on osmoregulation,feed intake,IGF-I,and cortisol in yearling steelhead trout(Oncorhynchus mykiss)during seawater adaptation[J].General and Comparative Endocrinology,2006,148:195 -202.
[25]Bradley K F,Breves J P,Davis L K,et al.Tissue-specific regulation of the growth hormone/insulin - like growth factor axis during fasting and re -feeding:importance of muscle expression of IGF - I and IGF - II mRNA in the tilapia[J].General and Comparative Endocrinology,2010,166:573 -580.
[26]Ayson F G,de Jesus-Ayson E G T,Takemura A.mRNA expression patterns for GH,PRL,SL,IGF - I and IGF - II during altered feeding status in rabbitfish,Siganus guttatus[J].General and Comparative Endocrinology,2007,150:196 -204.
[27]Matejka G L.Expression of GH receptor,IGF - I recepter and IGF- I mRNA in the kidney and liver of rats recovering from unilateral renal ischemia[J].Growth Hormone and IGF Research,1988,8:77 -82.
[28]Pierce A L,Dickey J T,Larsen D A,et al.A quantitative real -time RT-PCR assay for salmon IGF-I mRNA and its application in the study of GH regulation of IGF -I gene expression in primary culture of salmon hepatocytes[J].General and Comparative Endocrinology,2004,135:401 -411.
[29]Duan C.Nutritional and developmental regulation of insulin-like growth factors in fish[J].J Nutrition,1998,128:306 -314.
[30]Larsen D A,Beckman B R,Dickhoff W W.The effect of low temperature and fasting during the winter on metabolic stores and endocrine physiology(insulin,insulin -like growth factor -I,and thyroxine)of coho salmon,Oncorhynchus kisutch[J].General and Comparative Endocrinology,2001,123:308 -323.
[31]Peterson B C,Waldbieser G C,Bilodeau L.IGF -I and IGF -II mRNA expression in slow and fast growing families of USDA 103 channel catfish(Ictalurus punctatus)[J].Comparative Biochemistry and Physiology,Part A,2004,139:317 -323.
