钒液流电池电解液的热力学研究进展
2014-02-15许维国刘建国严川伟
许维国,刘建国,秦 野,严川伟
(中国科学院金属研究所,辽宁省先进电池材料工程技术研究中心,辽宁 沈阳 110016)
目前,开发风能、太阳能等新能源是解决能源资源短缺的重要途径之一,代表着未来能源发展的方向。加快清洁能源的应用也是环境保护的大势所趋,尤其近年来在北京和我国中东部地区出现的长时间雾霾天气,更使人们对清洁能源产业化、规模化发展的渴求空前迫切。然而风能、太阳能等新能源受制于时间和地域,离网的风能、太阳能发电必须使用储能系统,否则很难全天候利用;而直接并网也必须采用储能系统对电网进行调峰和调频,否则会对电网功率和频率带来较大的冲击。因此高效、大规模的能量存储技术就成为其发展应用的关键核心。在众多的储能技术选项中,钒液流电池以其独特的性能吸引着研究者的目光,同时也逐渐受到了产业界的重视。
钒液流电池(钒氧化还原液流电池,vanadium redox flow battery)是基于与V2+/V3+电对的液流储能电池技术(图1),能量存储于电解液中[1]。与传统的蓄电池相比,钒液流电池可大电流快速充放电、自放电率低[2-3],能实现能量的大容量存储,是满足智能电网以及风能、太阳能发电对大规模储能需求的理想储能形式。

图1 钒电池工作原理及电极反应Fig.1 The principle of vanadium flow battery and its electrode reaction
自从NASA(美国国家航空航天局)发现了钒离子可作为液流电池的活性物质后,澳大利亚和日本等国对钒液流电池进行了持续研究[1-3],至今已运行多个示范系统。我国钒液流电池的研究起步于20世纪90年代末,中国科学院大连化学物理研究所、中国工程物理研究院、东北大学、中南大学、北京科技大学、清华大学以及中国科学院金属研究所等相继就钒液流电池关键材料、电堆性能以及钒液流电池储能系统的示范运行等展开了理论与应用研究[4-14]。
不同于其它传统二次电池,钒液流电池的电解液不仅是离子导体,更是实现能量存储的电活性物质,是该电池存储与释放能量的核心。在钒液流电池的实际运行中,电解液的热力学性质(如钒离子活度等)会随电池工作状态的变化而实时变化,而 非受控的溶液热力学性质的改变将直接导致电池容量的衰减,甚至导致钒溶液沉淀失效。因此要确保钒液流电池储能系统的容量稳定及有效运行,必须深刻认识电解液的热力学性质及变化规律,这是钒液流电池实现产业化的理论基础,也是钒液流电池基础研究中最重要和最紧迫的问题之一[15-20]。本文主要介绍与钒液流电池电解液有关的化合物和溶液体系的热力学性质测定及其研究进展,并对热力学在钒液流电池电解液研究中的应用前景进行展望。
1 硫酸氧钒在硫酸水溶液中溶解度的研究
在钒液流电池电解液体积一定的情况下,钒液流电池的容量取决于钒的溶解度,所以硫酸氧钒在H2SO4溶液中的溶解度是研究者最关心的问题。Skyllas-Kazacos 课题组[21]报道了VOSO4在H2SO4溶液中的溶解度。在0~9 mol/L 调整硫酸浓度,同时在10~50 ℃改变温度,来寻找VOSO4的最大溶解度,结果表明[22-23],VOSO4的溶解度随硫酸浓度的增加而减小,在低温时溶解度随硫酸浓度的增加而减小的趋势更为明显(图 2)。他们从Debye-Hückel 方程式出发,推导出了一个多变量的模型,作为温度和总浓度的函数来预测溶解度。将此模型用于实验预测,所得溶解度数值的平均绝对偏差为4.5%。将H2SO4浓度缩小到更有用的范围(3~7 mol/L),则相关溶解度的平均绝对偏差仅有3%。Oriji 等[24]研究发现,V(Ⅳ) 的电子状态完全不受硫酸浓度的影响。Shi 等[25]研究了室温时VOSO4在1~2 mol/L H2SO4中的溶解情况,结果与Skyllas-Kazacos 课题组报道的一致,VOSO4的溶解度随硫酸浓度的增加而减小,2 mol/L VOSO4+ 3 mol/L H2SO4组成的电解液具有更好的可逆性和更低的极化电阻。
2 热化学研究
钒液流电池电解液的热化学数据会给对究钒液流电池的能量变化提供有益的信息。Qin 等[26]用恒温环境的溶解-反应热量计在(298.15±0.01)K下,测定了不同含水量的VOSO4· nH2O(s)(n=4.21、3.90、3.00 和2.63)在水中的摩尔溶解焓,他们利用Archer 方法外推得到n=0 的无水VOSO4固体的标准摩尔溶解焓ΔsHm0= -(49.19±0.65)kJ/mol。他们还测定了VOSO4· nH2O(s)在不同浓度的硫酸水溶液中的摩尔溶解焓[27-28],并指出VOSO4在H2SO4水溶液中具有较高的能量状态;在VOSO4-H2SO4水溶液中,由于受到硫酸二级解离平衡的影响,氧钒自由离子浓度大于其在纯水中的浓度。Qin 等[29]利用精密低温热量计测定了VOSO4· 2.63H2O(s)的摩尔比热容(图3),脱水温度Tde=(378.9±0.3)K,脱水过程的焓变化ΔdeHm=(116.4±0.1)kJ/mol,摩尔熵变化ΔdeSm=(307.3±0.1)J/(K·mol)。
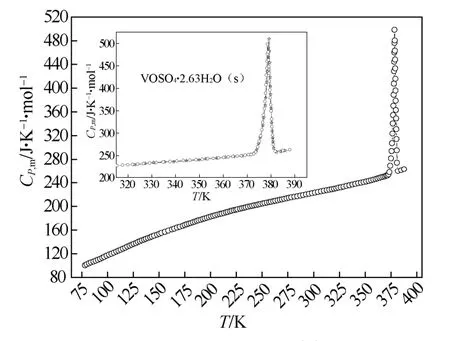
图3 实测的VOSO4⋅2.63H2O(s)摩尔比热容 对温度作图(CP,m ~ T)Fig.3 The curve of experimental molar heat capacities of VOSO4·2.63H2O(s) against the temperature (CP,m ~ T)
3 钒电池溶液的体积性质研究
在钒溶液浓度一定的情况下,钒电池的容量取决于电解液的体积,因此电解液的体积性质直接与电池性能相关[30]。由于钒液流电池电解液涉及4种价态的钒离子、氢离子、硫酸根离子、硫酸氢根离子、水等物质且溶液状态实时变化,直接测得的真实钒溶液热力学性质不能区别各组分的贡献。因此,在实际研究中把钒电池电解液分解成H2O-VOSO4等二元体系;H2O-VOSO4-H2SO4等三元体系;H2O-V2(SO4)3-VSO4-H2SO4和H2O-VOSO4- (VO2)2SO4-H2SO4等四元体系,便于实验研究,其中四元体系可以看成是在固定充放电状态下的实际钒液流电池电解液体系。
Qin 等[31]和Xu 等[32]用具有U 形振荡管的Anton Paar DMA4500M 密度计,在283.15~328.15 K 测量H2O-VOSO4二元体系和H2O-VOSO4-H2SO4三元体系的密度,计算了表观摩尔体积[33],得到了密度和表观摩尔体积随温度和浓度的变化规律和确定有关参数的数值。他们提出了用三元体系实验数据估算二元体系数据的方法。为了说明这种方法的可行性,做了以下验证。
(1)以298.15 K 下的H2O-VOSO4-H2SO4三元体系外推得到的硫酸氧钒水溶液的密度ρcal./g·cm-3对相应的实测ρexp./g·cm-3作图(图4),可得到一条斜率近似为1、截距近似为零的直线,拟合经验方程的相关系数为r=0.99998。这说明用三元体系的实验数据推导出二元体系的估算值,与相应的实验值高度相关。

图4 用三元体系实验数据外推计算的ρcal./g·cm-3对相应实测的ρexp./g·cm-3 作图Fig.4 Plot of densities ρcal./g·cm-3 extrapolated by three systems vs. the experimental data ρcal./g·cm-3
(2)利用VOSO4-H2SO4-H2O 溶液体系测定不同温度和不同浓度的密度,计算VOSO4表观摩尔体积,推导出适用于VOSO4-H2SO4-H2O 三元溶液体系的Pitzer 体积方程[34-35]

式中,上角标V 代表体积参数,下角标V、H、1和2分别代表VO2+、H+、4HSO-和4SO2-;VHVΦ和分别是二元和三元体积混合参数;AV是Debye-Hückel 体积参数,其值可由文献得到[34,36],Pitzer参数用以下方程定义

按照方程(1)拟合实验得到的表观摩尔体积,可得到标准偏摩尔体积和Pitzer 体积参数。
(3)Pitzer 体积参数随温度变化的经验方程
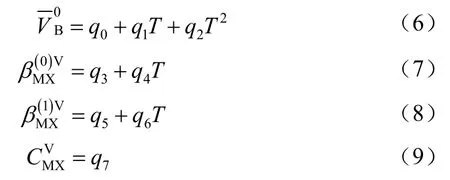
利用新参数 qi能计算得到表观摩尔体积φVB(cal.)。将φVB(cal.)对相应的实验值φVB作图(图5),得到一条很好的直线,其经验方程为:相关系数0.999,斜率接近1,说明新参数计算的表观摩尔体积与相应的实验值高度相关并十分类似。
4 用电导法测定离子对的解离常数
不同价态的钒离子和硫酸根离子在水溶液中很容易形成离子对,离子对的生成和解离会对电极反应产生影响。Liu 等[37]在不同温度下测定了不同浓度的VOSO4水溶液的电导率,借助Fouss 方法和Shedlovesky 方法推算了硫酸氧钒离子对的解离常数和极限摩尔电导(表1)。

图5 计算得到的表观摩尔体积φVB(cal)对相应的 实验值φVB 作图Fig.5 Plot ofφVB(cal.) vs. the corresponding value ofφVB(exp.)
硫酸氧钒离子对的解离过程为

表2 列出了根据硫酸氧钒离子对解离常数计算得到的热力学函数。
从表2 可知,在不同温度下硫酸氧钒离子对[VOSO4]0解离Gibbs 自由能ΔG0(kJ/mol)是比较大的正值,说明在恒温恒压下解离过程是非自发的;解离摩尔熵 ΔS0[J/(K·mol)]和解离焓 ΔH0(kJ/mol)都是绝对值较大的负值,说明主要是解离摩尔熵阻碍离子对的解离过程。
5 钒电池电解液的其它热力学研究方法
在众多的电解质溶液理论中,Pitzer 理论被广泛使用,它能够很好地处理高浓度、高价态的电解质溶液体系,但其本身是一个半经验理论,其参数必须通过实验数据拟合得到,目前关于钒离子的Pitzer 参数还很缺乏。最近,Qin 等[38]用等压法测定钒电池溶液的渗透系数φ,用实验值拟合Pitzer方程

表1 用 Fouss 和Shedlovesky 方法获得的极限摩尔电导和硫酸氧钒离子对的解离常数Table 1 The limiting molar conductivity and dissociation constant of VOSO4 ion pair calculated by Fouss and Shedlovesky’s method
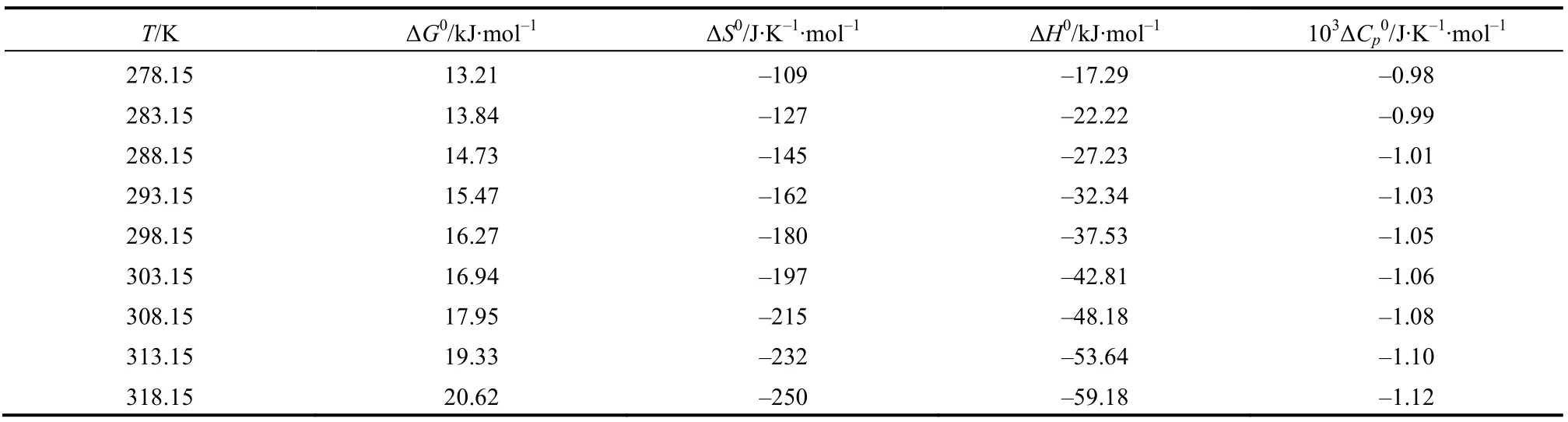
表2 硫酸氧钒离子对[VOSO4]0 解离过程的热力学函数Table 2 Thermodynamic function of the dissociation process for the [VOSO4]0 ion pair

可得到Pitzer 参数β(0)MX、β(1)MX和Cφ,其它参数的意义可以参见文献[34]。但等压法很难改变实验温度,应用受到限制。
溶液的表面张力也是溶液的重要性质之一,它可以反映溶液表面与本体之间性质的差异。Xu 等[39]用最大气泡法测定了不同温度下钒电池溶液的表面张力γ,并借助李以圭的溶液表面张力模型[40]讨论了钒溶液的表面性质
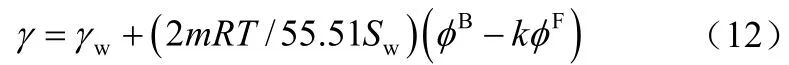
式中,γw为溶剂水的表面张力,φB和φF分别为体相和表面相的渗透系数,可用式(11)计算。用不同温度下得到的实验值γ 去拟合式(12),即可得到相应温度下的Pitzer 参数,与等压法得到的Pitzer参数作比较,进行热力学一致性的检验。
6 结 语
钒液流电池电解液是一个钒的多价态硫酸水溶液,承担着钒电池能量的储存和释放任务,它的热力学性质对提高钒电池的性能有着重要的指导作用。到目前为止,对钒溶液热力学性质的掌握还不够全面,今后需要测定更多的有关各种价态钒离子溶液的实验数据,建立热力学数据库。这些数据如能与溶液理论相结合,就可以预测不同温度、不同组成的多价态钒离子硫酸水溶液的热力学性质,为改善钒电池性能提供基础数据。另外,美国西北 太平洋国家实验室最近报道了以硫酸和盐酸的混酸为支持电解质的1 kW 钒液流电池系统[41],他们可以在混酸体系中把钒的浓度提高至2.5 mol/L,而且其稳定性也明显增强。但文中并未对加入盐酸后比能量提高和稳定性增加的原因给予解释。深入研究混酸体系中各种价态钒离子的热力学行为将有助于了解上述溶液稳定性增加的原因,所以钒溶液热力学研究的另一个重要方向是为寻找对钒溶解度更高、稳定性更强的体系提供理论依据。
[1] Rychcik M , Skyllas-Kazacos M. Characteristics of a new all-vanadium redox flow battery[J]. Journal of Power Sources,1988,22(1):59-67.
[2] Skyllas-Kazacos M. Novel vanadium chloride/polyhalide redox flow battery[J]. Journal of Power Sources,2003,124(1):299-302.
[3] Oriji G,Katayama Y,Miura T. Investigation on V(Ⅳ)/V(Ⅴ) species in a vanadium redox flow battery[J]. Electrochimica Acta,2004,49(19):3091-3095.
[4] Peng Shengqian(彭声谦),Xu Guozhen(许国镇),Yang Huashuan(杨华栓),et al. Studies on VOSO4preparation from V2O5extracted from stone like coal for vanadium flow battery[J]. Inorganic Chemicals Industry(无机盐工业),1997,38(1):3-6.
[5] Meng Fanming(孟凡明),Cui Yanhua(崔艳华), Li Maolin(李茂林),et al. Primary study of all vanadium ion flow energy storage battery[J]. Chinese Journal of Power Sources(电源技术),1998,22(1):24-25.
[6] Xu Qian(许茜),Lai Chunyan(赖春艳),Yin Yuanhong(尹远洪),et al. Improving the stability of electrolyte for vanadium redox cell[J]. Chinese Journal of Power Sources(电源技术),2002,26(1):29-31.
[7] Huang Kelong(黄可龙),Wu Qiumei(武秋美),Liu Suqin(刘素琴). Performance of graphite powder-carbon black composite electrodes for the vanadium redox flow battery[J]. Chinese Journal of Power Sources(电源技术),2004,28(2):91-93.
[8] Wang Wenhong(王文红),Wang Xindong(王新东). Preparation and characterization of graphite composite electrode for vanadium redox cell[J]. The Chinese Journal of Nonferrous Metals(中国有色金属学报),2004,14(10):393-396.
[9] Lv Zhengzhong(吕正中),Hu Songlin(胡嵩麟),Wu Zenghua(武增华),et al. Vanadium redox flow energy storage stack[J]. Chinese Journal of Power Sources(电源技术),2007,31(4):318-321.
[10] Tian Bo(田波),Yan Chuanwei(严川伟),Qu Qing(屈庆),et al. Potentiometric titration analysis of electrolyte of vanadium battery[J]. Battery Bimonthly(电池),2003,33(4):261-263.
[11] Zhao P,Zhang H,Zhou H,et al. Characteristics and performance of 10 kW class all-vanadium redox-flow battery stack[J]. Journal of Power Sources,2006,162(2):1416-1420.
[12] Zhu H,Zhang Y,Yue L,et al. Graphite-carbon nanotube composite electrodes for all vanadium redox flow battery[J]. Journal of Power Sources,2008,184(2):637-640.
[13] Chen Jinqing(陈金庆),Zhu Shunquan(朱顺泉),Wang Baoguo(王保国),et al. Model of open circuit voltage for all-vanadium redox flow battery[J]. Journal of the Chemical Industry and Engineering Society of China(化工学报),2009,60(1):211-215.
[14] Zeng J,Jiang C,Wang Y,et al. Studies on polypyrrole modified nafion membrane for vanadium redox flow battery[J]. Electrochemistry Communications,2008,10(3):372-375.
[15] Skyllas-Kazacos M,Menictas C,Kazacos M,et al. Thermal stability of concentrated V(Ⅴ) electrolytes in the vanadium redox cell[J]. Journal of the Electrochemical Society,1996,143(4):L86-L88.
[16] Kausar N,Howe R,Skyllas-Kazacos M. Raman spectroscopy studies of concentrated vanadium redox battery positive electrolytes[J]. Journal of Applied Electrochemistry,2001,31(12):1327-1332.
[17] Liu J,Xue W,Qin Y,et al. Enthalpy of solution for anhydrous VOSO4and estimated enthalpy of formation reaction for ion pair [VOSO4]0[J]. Journal of Chemical & Engineering Data,2009,54,(6):1938-1941.
[18] Rahman F,Skyllas-Kazacos M. Solubility of vanadyl sulfate in concentrated sulfuric acid solutions[J]. Journal of Power Sources,1998,72(2):105-110.
[19] Oriji G,Katayama Y,Miura T. Investigation on V(Ⅳ)/V(Ⅴ) and V( Ⅱ) /V(Ⅲ) redox reactions by various electrochemical methods[J]. Journal of Power Sources,2005,139(1):321-324.
[20] Teng Xiangguo(滕祥国),Zhao Yongtao(赵永涛),Wu Zenghua(武增华),et al. Effects of temperature on the performance of vanadium redox flow battery[J]. Chinese Journal of Power Sources(电源技术),2009,33(7):587-589.
[21] Menictas C,Cheng M,Skyllas-Kazacos M. Evaluation of an NH4VO3-derived electrolyte for the vanadium redox flow battery[J]. Journal of Power Sources,1993,45(1):43-54.
[22] Rahman F,Skyllas-Kazacos M. Solubility of vanadyl sulfate in concentrated sulfuric acid solutions[J]. Journal of Power Sources,1998,72(2):105-110.
[23] Skyllas-Kazacos M,Peng C,Cheng M. Evaluation of precipitation inhibitors for supersaturated vanadyl electrolytes for the vanadium redox battery[J]. Electrochemical Solid-State Letters,1999,3(2):121-122.
[24] Oriji G,Katayama Y,Miura T. Investigation on V( Ⅳ) /V( Ⅳ) species in a vanadium redox flow battery[J]. Electrochimica Acta,2004,49(19):3091-3095.
[25] Shi F,Zou J H,Lu H M,et al. Materials Processing and Energy Materials[M]. New Jersey:John Wiley & Sons,Inc.,2011:473-480.
[26] Qin Y,Xue W,Liu J,et al. The estimation of standard molar enthalpies of solution for VOSO4·nH2O(s) in water and in aqueous H2SO4[J]. Journal of Solution Chemistry,2010,39(6):857-863.
[27] Qin Y,Xue W,Liu J,et al. The estimation of standard molar enthalpies of solution for VOSO4·nH2O(s) in water and in aqueous H2SO4[J]. Journal of Solution Chemistry,2010,39(6):857-863.
[28] Liu Jianguo(刘建国),Qin Ye(秦野),Yan Chuanwei( 严川伟). Enthalpies of solution for VOSO4·2.76H2O(s) in water and in aqueous H2SO4[J]. Acta Chimica Sinica(化学学报),2010,68(7):722-726.
[29] Qin Y,Liu J,Di Y,et al. Thermodynamic Investigation of Electrolytes of the Vanadium Redox Flow Battery (II):A study on low-temperature heat capacities and thermodynamic properties of VOSO4·2.63H2O(s)[J]. Journal of Chemical & Engineering Data,2010,55(3):1276-1279.
[30] Zhao Yongtao(赵永涛),Xi Jingyu(席靖宇),Teng Xiangguo(滕祥国),et al. Electrolyte volume change study in all vanadium redox flow battery[J]. Acta Chimica Sinica(化学学报),2011,69(2):132-136.
[31] Qin Y,Liu J,Yan C. Thermodynamic investigation of electrolytes of the vanadium redox flow battery (III):Volumetric properties of aqueous VOSO4[J]. Journal of Chemical & Engineering Data,2012,57(1):102-105.
[32] Xu W,Qin Y,Gao F,et al. Determination of volume properties of aqueous vanadyl sulfate at 283.15 to 323.15 K[J]. Industrial & Engineering Chemistry Research,2014,53(17):7217-7223.
[33] Harned H S,Owen B B. The Physical Chemistry of Electrolyte Solutions[M]. 3nd ed. New York:Reinhold,1958.
[34] Pitzer K S. Activity Coefficients in Electrolyte Solutions[M]. 2nd ed. Boca Raton:CRC,1991.
[35] Huang Ziqing(黄子卿). Introduction to Electrolyte Solution Theory(电解质溶液理论导论)[M]. Beijing:Science Press,1983.
[36] Pitzer K S,Roy R N,Silvester L F. Thermodynamics of electrolytes 7 sulfuric acid[J]. J. Am. Chem. Soc.,1977,99(15):4930-4936.
[37] Liu G,Qin Y,Jin H,et al. Thermodynamic study of electrolytes in vanadium flow battery:Determination of disassociation constant of [VOSO4]0in the aqueous solution using conductivity measurements [C]//Wuhan : The 16th National Symposium on Chemical Thermodynamics and Thermal Analysis of Chinese Chemical Society,2012:150.
[38] Qin Y,Liu J,Yan C. Thermodynamic study of vanadium flow battery:Thermodynamic study of VOSO4aqueous solution with the isopiestic method[C]//Wuhan:The 16th National Symposium on Chemical Thermodynamics and Thermal Analysis of Chinese Chemical Society,2012:151.
[39] Xu W,Sun J,Liu J,et al. Thermodynamic study of electrolytes in vanadium flow battery( )Ⅳ:Surface properties of VOSO4aqueous solution[C]//Wuhan:The 16th National Symposium on Chemical Thermodynamics and Thermal Analysis of Chinese Chemical Society,2012:165.
[40] Li Yigui. Reply to “Comments on surface tension model for concentrated electrolyte solutions by the Pitzer equation”[J]. Industrial & Engineering Chemistry Research,1999,38:4137-4138.
[41] Kim S,Thomsen E,Xia G,et al. 1kW/1kW·h advanced vanadium redox flow battery utilizing mixed acid electrolytes[J]. Journal of Power Sources,2013,237(9):300-309.
