广西扶绥肝细胞癌家系XRCC1基因Arg194Trp多态性与肝细胞癌遗传易患性关系的病例对照研究
2014-02-09谢裕安
丁 飞,谢裕安
原发性肝癌是我国最常见的恶性肿瘤之一,发病率约为欧美地区的10倍,病死率位列我国恶性肿瘤第二位。因其起病隐匿,早期可无任何症状,发现时病情已多为中、晚期,导致治疗和预后均较差。我国原发性肝癌中,肝细胞癌(hepatocellular carcinoma,HCC)占90%。目前已证实人群HBV/HCV感染、黄曲霉素毒B1(aflatoxin B1,AFB1)的摄入、饮水污染等与HCC的发生密切相关,而遗传易患性导致的个体HCC发病风险的不同也日益受到关注。
DNA分子作为遗传的物质基础,其结构和功能的完整性对于维持机体的正常生理功能和遗传稳定性至关重要。如果细胞DNA损伤反应机制发生异常,将会导致个体的癌症易患性显著增加。XRCC1(X-ray cross complementing group 1)是一种重要的DNA修复基因,其编码的蛋白质在碱基切除修复(base excision repair,BER)和DNA单链断裂修复的过程中起重要作用。因此,目前认为XRCC1的多态性可能改变DNA修复的功能和效率,使环境因素致癌的风险增加。目前对XRCC1的单核苷酸多态性研究最多的3个位点分别位于第6、9、10外显子中,依次为C26304T、G27466A和G28152A,分别导致相应氨基酸残基的改变(Arg194Trp、Arg280His和Arg194Trp)[1]。大量的临床流行病学资料显示,上述3个位点的基因多态性与个体发生某些肿瘤的危险性有关。其中,在对XRCC1基因多态性与HCC易患性的研究方面,大多集中在399位点,而对194位点的研究较少。因此,为进一步探讨XRCC1基因Arg194Trp多态性与HCC遗传易患性之间的关系,本研究选取我国HCC高发地区之一的广西扶绥县HCC家系人群与当地正常家系人群进行病例对照研究。
1 资料与方法
1.1 一般资料 采用病例对照研究方法,于2003年1月—2011年5月在广西扶绥县采集21个HCC家系(HCC家系组,76例),于2011年1—5月在与HCC家系相同的自然村采集20个对照家系(对照组,76例)。HCC家系组年龄16~86岁,平均(45.6±14.8)岁;男42例,女34例;HBsAg阳性48例,HBsAg阴性28例;甲胎蛋白(AFP)阳性13例,阴性63例;吸烟(≥1包/d)6例,不吸烟(<1包/d)70例;饮酒(≥250 g/d)6例,不饮酒(<250 g/d)70例。对照组年龄16~85岁,平均(48.0±16.6)岁;男56例,女20例;HBsAg、AFP均阴性;吸烟34例,不吸烟42例;饮酒34例,不饮酒42例。HCC家系由HCC患者(A组,21例)及与其有血缘关系的直系亲属(B组,55例)共同组成,其中HCC患者为广西医科大学附属肿瘤医院进行外科手术的扶绥县患者,术后经组织病理学诊断为HCC,术前未经放射、化学或生物治疗,且经病史采集提示其直系亲属中至少已有1人确诊HCC。对照家系(C组)与HCC家系无血缘关系,且其家庭结构、成员数与HCC家系相似,体检结果均正常,无肝炎病史、肿瘤病史、肿瘤家族史。
1.2 方法 本研究采取匹配设计,通过严格选择受检者,经不同人员对具体信息进行核实和检查以及对潜在的混淆因素进行校正来控制偏倚。然后检测各组受检者XRCC1 Arg194Trp基因型。
1.2.1 DNA提取 按照天根生化科技(北京)有限公司生产的试剂盒说明,从手术切除的癌组织标本或外周血标本中提取XRCC1的基因组DNA。
1.2.2 XRCC1 Arg194Trp基因型分析 以限制性片段长度多态性聚合酶链式反应(PCR-RFLP)方法进行XRCC1基因Arg194Trp多态性分析。参照文献[2]设计引物序列:上游引物5′-GCCCCGTCCCAGGTA-3′,下游引物5′-AGCCCCAAGACCCTTTCACT-3′,由生工生物工程(上海)股份有限公司合成。
PCR反应体系:1 μl模板DNA,2×Taq PCR MasterMix 12.5 μl,上游引物1 μl,下游引物1 μl,加双蒸水(ddH2O)到反应体系为25 μl。反应条件:95 ℃预变性5 min,95 ℃变性30 s、59 ℃复性30 s、72 ℃延伸30 s(进行30个循环),72 ℃最后延伸5 min。
RFLP酶切反应体系:10×Buffer 1 μl、PCR产物6.5 μl、10 μg/μl小牛血清(BSA)0.1 μl、10 U/μl PvuⅡ内切酶0.8 μl、灭菌去离子水1.6 μl,总反应体系为10 μl。放入37 ℃恒温仪温育4 h。酶切产物经2%琼脂糖凝胶电泳,于Thermo荧光成像仪下观察结果。同时,PCR产物送测序(上海英骏生物技术有限公司)。
结果判断:XRCC1密码子194位点存在野生型Arg和突变型Trp两种等位基因,野生型纯合子Arg/Arg(CC基因型)不能被限制性内切酶PvuⅡ酶切,只有一个长491 bp的片段;突变型纯合子Trp/Trp(TT基因型)能完全被限制性内切酶PvuⅡ酶切,产生分别为197 bp和294 bp的两个片段;突变型杂合子Arg/Trp(CT基因型)酶切后则产生分别为197、294、491 bp的3个片段。
1.3 统计学方法 根据Hardy-Weinberg遗传平衡定律进行吻合度检验。采用SPSS 17.0软件包进行统计分析。以比值比(OR)及95%可信区间(CI)表示各种基因型与发生HCC风险之间的相关性。OR值以非条件Logistic回归法计算,所有统计采用双侧概率检验,以P<0.05为差异有统计学意义。
2 结果
2.1 酶切结果 XRCC1基因Arg194Trp多态性的各基因型通过凝胶电泳分析鉴定并经测序证实:图1为Arg194Trp的PCR扩增的目的片段(491 bp);图2为Arg194Trp的PCR产物的RFLP分析;图3~5为不同基因型的PCR扩增产物的DNA测序分析结果。

注:M为Marker 2,1~10为PCR产物(491 bp)
图1 XRCC1基因Arg194Trp PCR扩增目的片段
Figure1 PCR amplification of XRCC1 gene C26304T site Arg194Trp
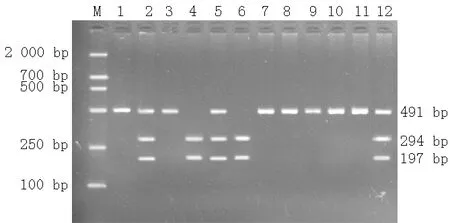
注:M为Marker DL2000,第2、5、12泳道为CT基因型,第4、6泳道为TT基因型,其他泳道均为CC基因型
图2 XRCC1基因Arg194Trp PCR-RFLP分析
Figure2 Genotyping of XRCC1 gent C26304T site Arg194Trp polymorphism by PCR-RFLP analysis
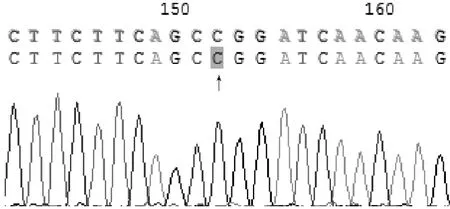
图3 XRCC1基因194位点DNA测序分析(CC基因型)Figure 3 DNA sequencing of XRCC1 gene site 194(CC genotype)
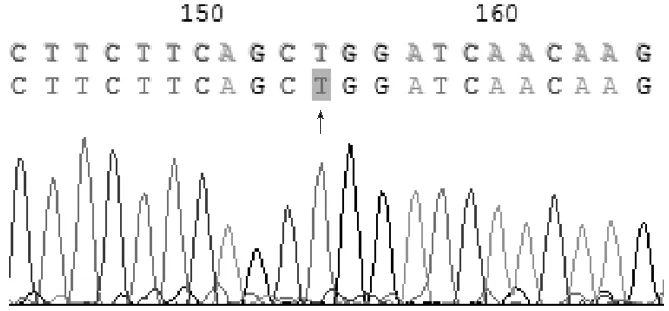
图4 XRCC1基因194位点DNA测序分析(TT基因型)Figure 4 DNA sequencing of XRCC1 gene site 194(TT genotype)
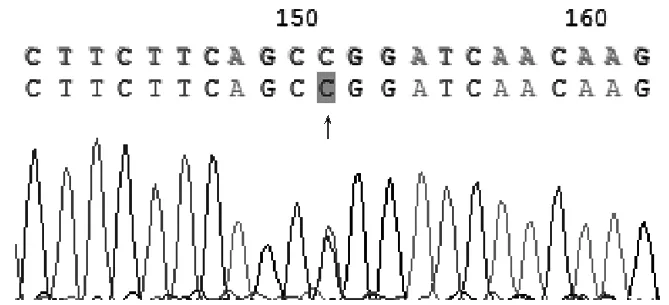
图5 XRCC1基因194位点DNA测序分析(CT基因型)Figure 5 DNA sequencing of XRCC1 gene site 194(CT genotype)
2.2 XRCC1基因194位点基因型吻合度检验 经Hardy-Weinberg遗传平衡定律检验,各组人群中XRCC1 Arg194Trp等位基因型频率与期望值吻合度较好(A组:χ2=1.80,P=0.18;B组:χ2=1.51,P=0.22;C组:χ2=1.70,P=0.19),符合 Hardy-Weinberg遗传平衡,表明具有良好的代表性。
2.3 XRCC1 Arg194Trp基因型分布及等位基因分布 3组受检者中XRCC1基因194位点基因型分布及等位基因频率比较,差异有统计学意义(P<0.05);其中A组基因型分布及等位基因频率与C组比较,差异有统计学意义〔P<0.012 5(α′),见表1〕。
2.4 XRCC1基因194位点基因多态性与HCC的关系 采用非条件Logistic回归分析,对性别、年龄、吸烟和饮酒4个因素进行校正,结果发现B组CT、TT基因型个体发生HCC的风险分别是CC基因型个体的0.473倍和0.426倍。C组CT、TT基因型个体发生HCC的风险分别是CC基因型个体的0.206倍和0.240倍。可见,CT、TT基因型个体发生HCC的风险可能较CC基因型个体减低,但差异无统计学意义(P>0.05,见表2)。
3 讨论
肿瘤的发生、发展是一个多基因、多细胞、多阶段的过程,与个体遗传和外部环境的作用关系密切。由于外部环境损伤机体主要是通过DNA发挥作用,因此,DNA损伤后是否能够得到及时、准确的修复对于防止细胞癌变至关重要。BER是DNA损伤后最主要的修复机制之一,涉及切除损伤碱基和核心BER反应两个重要过程,由多种蛋白参与,其中XRCC1起重要作用[3]。XRCC1自身不具有催化酶的活性,但其编码的蛋白与DNA聚合酶β、DNA连接酶Ⅲ、多聚ADP核糖聚合酶(PARP)结合形成复合体,发挥重要的支架蛋白作用,参与BER和DNA单链断裂修复[4-5]。目前研究已发现XRCC1基因的多态性与食管癌、胃癌、结肠癌、肺癌等多种肿瘤的发生存在相关性,如Xing等[6]对XRCC1基因194位点的研究发现携带TT基因型者比携带CC、CT基因型者发生鳞状细胞食管癌的危险性增加;Hung等[7]研究发现,CC基因型个体与肺癌风险无相关性。在对XRCC1基因多态性与HCC易患性的研究方面,Kiran等[8]在印度人群中进行的研究结果显示,Arg194Trp、Arg280His基因多态性会增加患肝炎相关HCC的风险,当Arg280His与Arg194Trp或Arg399Gln联合作用时患肝炎相关HCC的风险将显著提高。
本研究选取我国HCC高发地区之一的广西扶绥县HCC家系人群为研究对象。研究结果显示,HCC家系中未患HCC者CT基因型个体发生HCC的风险是CC基因型个体的0.473倍〔95%CI(0.117,1.914)〕;TT基因型个体发生HCC的风险是CC基因型个体的0.426倍〔95%CI(0.064,2.858)〕。对照家系中CT基因型个体发生HCC的风险是CC基因型的0.206倍〔95%CI(0.035,1.201)〕;TT基因型个体发生HCC的风险是CC基因型个体的0.240倍〔95%CI(0.027,2.168)〕。无论是对照家系还是HCC家系人群中,CT基因型和TT基因型的个体较CC基因型发生HCC的风险差异无统计学意义,故结果仅提示T等位基因可能会减低HCC的发生。
HCC的发生是遗传因素和环境因素共同作用的结果,其中作为分子遗传学基础的遗传因素可以改变个体对环境中致HCC因素的易患性。对于XRCC1基因Arg194Trp多态在不同人群、不同地区的研究结果出现的分歧,可能与其遗传背景、生活地域、习惯及环境中接触的致癌物不同有关。
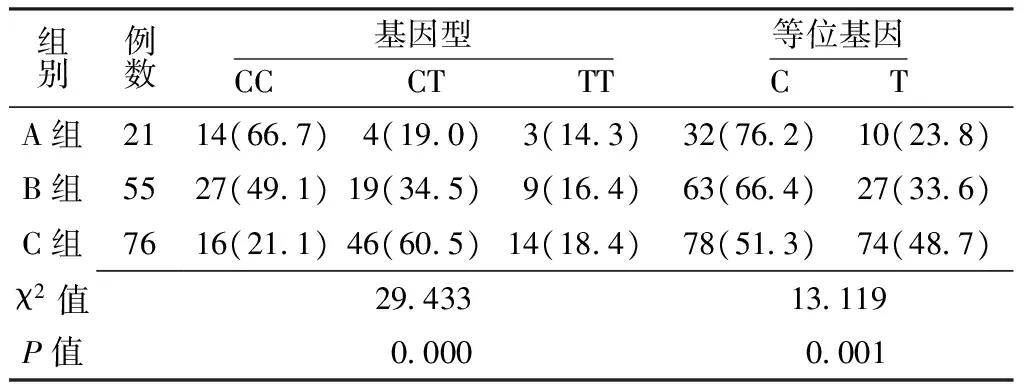
表1 3组受检者中XRCC1 Arg194Trp基因型分布及等位基因频率比较〔n(%)〕Table 1 Comparison of genotype distribution and allele frequency of XRCC1 Arg194Trp
注:C组基因型与A组比较,χ2=12.091,P=0.002;C组等位基因频率与A组比较,χ2=8.294,P=0.004

表2 XRCC1 Arg194Trp基因型与HCC患病风险的关系〔n(%)〕Table 2 Association between XRCC1 Arg194Trp genotype and HCC
注:ref代表参照,即以CC基因型作为参照;-无数据;*表示B组与A组比较,△表示C组与A组比较
综上所述,本研究尚未发现XRCC1基因Arg194Trp多态性与HCC发病具有相关性,但提示CT基因型和TT基因型的个体患HCC的风险可能较CC基因型的个体减低。本研究未得到预期的阳性结果的主要原因,可能与收集到的样本量不够大有关。如果在今后的研究中加大HCC家系人群样本量的收集,继续上述研究可能会得到预期的阳性结果。另外,本研究结果对于进一步研究扶绥县乃至其他地区HCC高危人群的发病风险提供了分子遗传学的依据,并对HCC的预防具有一定的参考意义。
1 Shen MR,Jones IM,Mohrenweiser H.Nonconservative amino acid substitution variants exist at polymorphic frequency in DNA repair genes in healthy humans[J].Cancer Res,1998,58(4):604-608.
2 吴昊.广西扶绥人群XRCC1、Caspase9基因单核苷酸多态性与肝细胞癌遗传易感性研究[D].南宁:广西医科大学,2009.
3 Wood RD,Mitchell M,Sgouros J,et al.Human DNA repair genes[J].Science,2001,291(5507):1284-1289.
4 Caldecott KW,Aoufouchi S,Johnson P,et al.XRCC1 polypeptide interacts with DNA polymerase beta and possibly poly(ADP-ribose) polymerase,and DNA ligase Ⅲ is a novel molecular ′nick-sensor′ in vitro[J].Nucleic Acids Res,1996,24(22):4387-4394.
5 李文骏,向华,马庆波.DNA修复基因XRCC1的194位点多态性与晚期非小细胞肺癌铂类化疗敏感性关系的Meta分析[J].中国全科医学,2011,14(7):2417.
6 Xing D,Qi J,Miao X,et al.Polymorphisms of DNA repair genes XRCC1 and XPD and their associations with risk of esophageal squamous cell carcinoma in a Chinese population[J].Int J Cancer,2002,100(5):600-605.
7 Hung RJ,Brennau P,Canzian F,et al.Large-scale investigation of base excision repair genetic polymorphisms and lung cancer risk in a multicenter study[J].J Nat Cancer Inst,2005,97(8):567-576.
8 Kiran M,Saxena R,Chawla YK,et al.Polymorphism of DNA repair gene XRCC1 and hepatitis-related hepatocellular carcinoma risk in Indian population[J].Mol Cell Biochem,2009,327(1/2):7-13.
