南方红壤区西南桦和马尾松人工林土壤微生物活性及细菌多样性比较
2014-02-08杨尚东吴俊谭宏伟刘永贤熊柳梅周柳强谢如林黄国勤赵其国
杨尚东,吴俊,谭宏伟,刘永贤,熊柳梅,周柳强,谢如林,黄国勤,赵其国
1. 广西大学农学院,广西 南宁 530004;2. 广西作物遗传改良生物技术重点开放实验室/广西农业科学院,广西 南宁 530007;3. 江西农业大学,江西 南昌 330045;4. 中国科学院南京土壤研究所,江苏 南京 210008
南方红壤区西南桦和马尾松人工林土壤微生物活性及细菌多样性比较
杨尚东1,2,吴俊1,谭宏伟2*,刘永贤2,熊柳梅2,周柳强2,谢如林2,黄国勤3,赵其国4
1. 广西大学农学院,广西 南宁 530004;2. 广西作物遗传改良生物技术重点开放实验室/广西农业科学院,广西 南宁 530007;3. 江西农业大学,江西 南昌 330045;4. 中国科学院南京土壤研究所,江苏 南京 210008
目前,西南桦(Betula alnoides)和马尾松(Pinus massoniana)均是广西红壤区大规模种植的人工林树种。为了分析和评价这两个树种对土壤肥力和生态质量的影响,本文采用了稀释平板法和氯仿熏蒸提取法等传统方法分析了两种人工林土壤可培养微生物数量、微生物量碳、微生物量氮、涉及土壤碳、氮、磷循环相关酶活性等表征微生物活性的指标。同时,采用聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)技术分析了两种人工林土壤细菌多样性。结果表明,西南桦人工林土壤中可培养真菌数量与马尾松人工林虽无明显差异,但可培养细菌和放线菌数量均明显高于相应的马尾松人工林。土壤中β-葡萄糖苷酶、磷酸酶和蛋白酶活性在两种人工林之间虽无明显差异,但西南桦人工林各土层土壤的微生物生物量碳、氮指标均优于对应的马尾松林,表现出比马尾松更优的生态效果。此外,西南桦人工林土壤中各土层细菌多样性指数(Shannon-Wiener index)均高于相应的马尾松人工林土层。综上,比马尾松相比,西南桦是更有利于提高红壤区土壤肥力和维持林地土壤生态质量的造林树种。
红壤;西南桦;马尾松;土壤肥力;生态质量
红壤(包括红壤、赤红壤和砖红壤,下同)是广西主要的土壤类型,面积达1.07×107hm2,占广西土地总面积的65.55%(广西土壤肥料工作站,1994)。广西水热资源丰富,夏季的高温多雨不仅加快了土壤中有机质的分解速度,而且容易造成大面积的水土流失。根据我国近年来水利和土壤普查数据发现(分区考察组,2009),目前,南方红壤区是我国水土流失最严重的区域之一。一方面,严重的水土流失不仅导致了土壤质量恶化,影响区域粮食安全,而且造成区域河流、水库的泥沙淤积,加剧了“水质性缺水”以及人居环境恶化等社会问题。另一方面,南方红壤区的水土流失是一个渐变的过程,其危害性不易被人们发觉或意识,可一旦达到突变状态,其危害性将十分严重。因此,红壤区的水土流失治理任务迫在眉睫。
西南桦(Betula alnoides)是一种可做为更新刀耕火种、采伐迹地等荒地的先锋树种,其生长快、寿命长,树干通直,尖削度小,是适宜培育大径材的阔叶树种。马尾松(Pinus massoniana)是我国南方主要的用材针叶树种,占全国造林面积的20%,具有适应性强、用途广、速生丰产等优点,在我国林业生产中占有重要地位(刘文飞等,2008)。目前,这两个树种在南方红壤区均被大规模栽植,然而,长期栽植单一树种将对土壤生态环境造成不良影响,而其具体影响尚未明确。
本文通过对广西田林县八渡乡福达镇西南桦和马尾松人工林土壤理化性质、土壤微生物活性及细菌多样性进行分析,试图从土壤微生物学角度评价不同造林树种对土壤肥力和生态环境质量的影响,以期为红壤区生态修复造林树种的选择提供理论依据和参考。
1 材料与方法
1.1 研究区概况
调查地位于广西田林县八渡乡福达镇林场(北纬24°36′,东经105°92′),该林场属南亚热带季风气候区,年平均气温20.0 ℃,平均降雨量1657.2 mm。林地均为丘陵山地,土壤由砂页岩发育而来。研究区造林树种以西南桦(8年树龄)和马尾松(树龄8年)人工林为主。
1.2 样品采集
土壤样品于2012年4月17日采集,分别取自林龄均为8 a的西南桦林(阔叶林)和马尾松林(针叶林)人工林地,采集地点海拔均在560~590 m之间。具体采样方法:两类型林地随机选取5个点,去除地表的凋落物层,然后挖取剖面。分表层(0~5 cm)、中层(5~35 cm)、下层(35 cm以下)采集。先取下层,再取中层,最后取表层。每个土壤样品采集混匀后收集于无菌袋中,运回实验室过2 mm筛后置于4 ℃冰箱中保存,用于土壤生物学性状及细菌群落结构的分析。两林地土壤的理化性质分析如下:西南桦人工林pH值5.02~5.91,有机质质量分数7.7~40.6 g·kg-1,全氮质量分数0.57~1.88 g·kg-1,全磷质量分数0.81~1.20 g·kg-1,全钾质量分数32.48~33.48 g·kg-1,碱解氮质量分数31.94~156.02 mg·kg-1,速效磷质量分数3.78~9.34 mg·kg-1,速效钾质量分数40.0~252.0 mg·kg-1;马尾松人工林pH值5.24~5.35,有机质质量分数7.7~28.1 g·kg-1,全氮质量分数0.43~1.62 g·kg-1,全磷质量分数0.84~1.26 g·kg-1,全钾质量分数20.62~23.60 g·kg-1,碱解氮质量分数41.77~126.13 mg·kg-1,速效磷质量分数5.20~11.34 mg·kg-1,速效钾质量分数52.5~140.5 mg·kg-1。
1.3 分析测定方法
土壤微生物活性的测定:微生物土壤数量采用稀释平板法(李振高等,2008);微生物生物量碳、氮测定采用氯仿熏蒸提取法测定(Vance等,1987;Joergense和Brookes,1990);β-葡萄糖苷酶(β-Glucosidase)活性采用Hayano法测定(Hayano,1973);蛋白酶(protease)活性采用Ladd 法测定(Ladd,1971);磷酸酶(phosphatase)活性采用Tabatabai and Bremner的方法测定(Tabatabai和Bremner,1969)。
土壤细菌群落结构:土壤基因组总DNA的提取参照Krsek M和Welington的方法(Kresk和Wellington,1999)稍加修改进行。具体操作如下:称取5 g土壤,采用提取液和回收试剂盒(Biospin gel extraction kit,Bioflux,产品号:bsc02m1)进行基因组总DNA的提取和纯化,粗提和纯化结果采用1.0%(w/V)琼脂糖凝胶电泳检测;纯化后样品置于-20 ℃冰箱保存备用。土壤细菌16SrDNAV3可变区的PCR扩增,采用对大多数细菌的16SrRNA基因V3区具有特异性的引物对F338GC和R518进行扩增(Van等,1999;Li等,2008;刘玮等,2010),它们的碱基序列分别为:上游引物F338GC(5'-CGCCCGCCGCGCGCGGCGGGCGGGGCGGG GGCACGGGGGGACTCCTACGGGAGGCAGCAG -3');下游引物R518(5'-AT-TACCGCGGCTGCTGG-3')。PCR产物用1.5%(w/V)琼脂糖凝胶电泳检测;变性梯度凝胶电泳(DGGE)分析采用Bio-Rad公司DCodeTM基因突变检测系统对PCR反应产物进行分离。样品在浓度为30%到60%的变性剂(100%的变性胶为7 mol·L-1的尿素和40%的去离子甲酰胺的混合物)的8%聚丙烯酰胺凝胶中,在100 V的恒定电压下,置于60 ℃电泳槽中电泳6 h。电泳完毕后,样品经凝胶银染20~30 min后用GelDoc凝胶成像分析系统(北京赛百奥科技有限公司)观察并拍照。
1.4 数据分析方法
采用Quantity one分析软件(Bio-Rad)对各土壤样品的电泳条带数量及密度进行定量分析。多样性指数(H)、丰度(S)和均匀度(EH)的计算方法参照罗海峰等(2004)的方法进行。数据处理采用Excel2003。
2 结果
2.1 西南桦和马尾松人工林土壤可培养微生物数量特征
由表1可知,无论是西南桦还是马尾松人工林土壤可培养微生物数量大小的顺序均呈:细菌>放线菌>真菌,并且可培养微生物数量都随着土层深度的增加而显著减少。这一分布趋势与冯建和张健(2005)对桉树人工林土壤微生物的研究结果相似。土壤微生物数量受土壤温度、湿度、有机质含量、耕作制度及作物种类等因素共同影响(刘久俊等,2008)。西南桦人工林各土层中可培养细菌和放线菌数量均极显著高于马尾松人工林相应土层的细菌和放线菌,但两种人工林土壤中可培养真菌数量差异不显著。这一现象可能与两种人工林土壤中有机质、全氮、全磷和全钾等养分含量的差异性有关。而有关两种人工林土壤中可培养真菌数量近似的原因,除了与土壤养分含量差异有关外,其具体原因还有待进一步的探究。
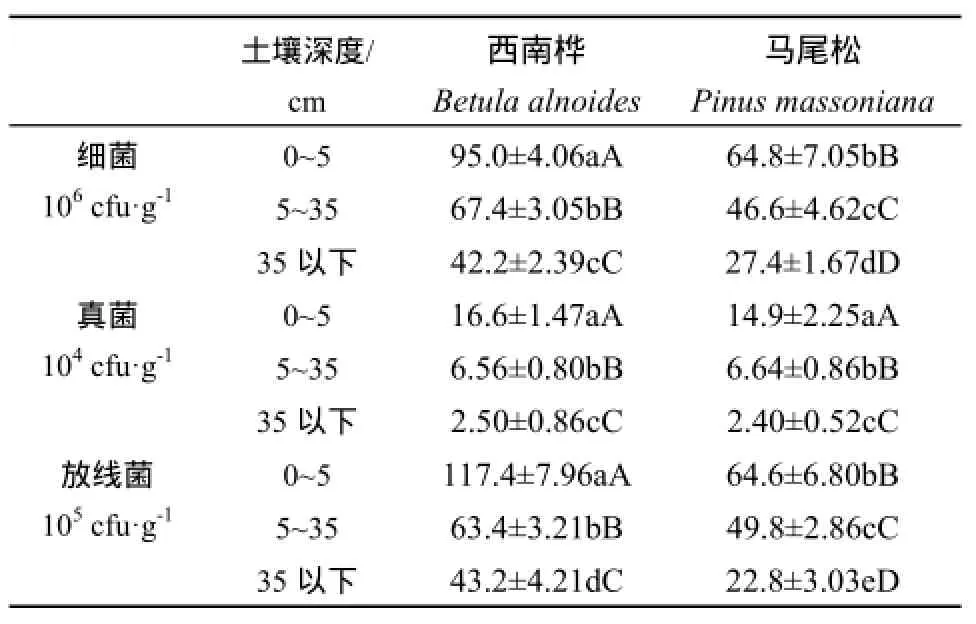
表1 西南桦和马尾松人工林土壤微生物数量Table 1 Number of Soil Microorganisms in Betula alnoides and Pinus massoniana Plantations
2.2 西南桦和马尾松人工林土壤酶活性特征
β-葡萄糖苷酶是表征土壤碳素循环速度的重要指标之一。由图1(a)可知,西南桦和马尾松人工林土壤中β-葡萄糖苷酶活性均随着土层深度的增加而减弱;在西南桦人工林表层土壤的β-葡萄糖苷酶活性高于马尾松林的,而其它土层中该酶活性在不同林分间无显著差异。此结果表明,不同造林树种对土壤(尤其是表层土壤)的碳素循环速度具有显著影响。其原因之一可能是西南桦是落叶树种,而马尾松是常绿树种,落叶腐烂提高了西南桦人工林表层土壤中的有机质含量。同时,西南桦人工林土壤中微生物数量显著高于马尾松人工林这一事实可能也是导致其表层土壤β-葡糖苷酶活性显著高于马尾松林的原因之一。
土壤磷酸酶是一类催化土壤有机磷化合物矿化的酶,其活性高低直接影响着土壤的有机磷分解转化及其生物有效性。土壤磷酸酶包括酸性磷酸酶、中性磷酸酶和碱性磷酸酶(和文祥等,2003)。本试验供试土壤pH均在6以下,所以仅测定其中的酸性磷酸酶。由图1(b)可知,西南桦和马尾松人工林土壤中的酸性磷酸酶活性均随着土层深度的增加而减弱;马尾松人工林表层土壤(0~5 cm)和中层土壤(5~35 cm)的磷酸酶活性显著高于西南桦的,而下层土壤(>35 cm)两者刚好相反。
蛋白酶参与土壤中蛋白质以及其它含氮有机化合物的转化,其水解产物是高等植物吸收的氮源之一(关松荫,1986),其活性受植物根系分泌物、微生物种类和群落结构以及土壤特性等因素的影响(杨万勤和王开运,2002)。由图1(c)可知,西南桦和马尾松人工林土壤中的蛋白酶活性均随着土层深度的增加而减弱,并且除中层土壤两者蛋白酶活性差异较明显之外,其余各土层中两者该酶活性差异不明显。此结果表明,这两种造林树种对土壤中涉及氮素循环的生物活动影响效果相近。
2.3 西南桦和马尾松人工林土壤微生物生物量特征
土壤微生物生物量作为植物矿质养分的源和汇,是稳定态养分转变为有效态养分的催化剂(Carter和Rennie,1984)。微生物量越大,土壤保肥作用越强,土壤养分越趋于积累。由图2可知,西南桦和马尾松人工林土壤微生物生物量碳和氮均随着土层深度的增加而递减。但微生物量碳或氮在两种人工林的表层土壤(0~5 cm)中均无明显差异,而在中层土壤(5~35 cm)中,西南桦人工林土壤微生物生物量碳和氮均明显高于马尾松人工林土壤,至下层(35 cm以下)时,两种林地土壤的微生物生物量碳、氮呈现出与表层土壤相一致的变化趋势。
何友军等(2006)对杉木人工林土壤微生物生物量碳氮特征的研究表明,土壤微生物生物量碳与土壤全氮、全钾和速效钾呈极显著的正相关关系;土壤微生物生物量氮也与土壤养分具有极显著的正相关关系。本试验的结果同样显示,两种人工林地土壤中,土壤微生物生物量碳和氮的空间变化趋势与土壤养分的空间分布特征基本一致。其中,各土层土壤的有机质、全氮、全磷、全钾、碱解氮、速效磷和速效钾含量等土壤养分虽然都随着土层深度的增加呈现递减的趋势,但在中层和下层中的分布极不规律。总体而言,作为表征土壤肥力的微生物生物量碳、氮指标在两种林型的表层土壤之间并无明显的差异,但对表层以下土壤的肥力的保持能力而言,西南桦树种优于相应的马尾松树种。

图1 西南桦和马尾松人工林土壤酶活性变化Fig.1 Spatial variations in Soil Enzyme Activities at Betula alnoides and Pinus massoniana Plantations
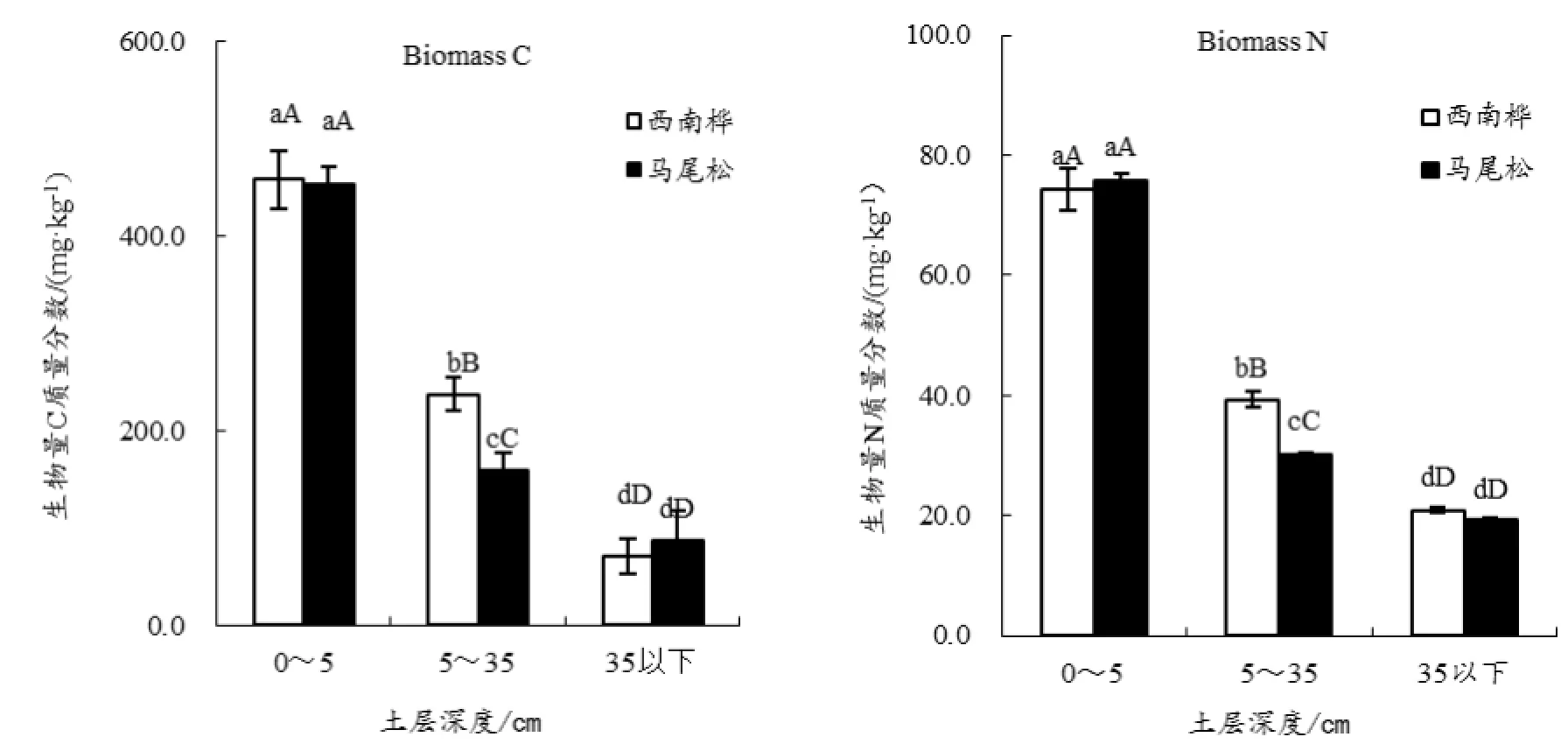
图2 西南桦和马尾松人工林土壤微生物量特征Fig.2 Spatial Variations in Soil Biomass at Betula alnoides and Pinus massoniana Plantations
2.4 西南桦和马尾松人工林土壤细菌群落结构特征
2.4.1 基因组DNA提取和PCR扩增
分别于西南桦和马尾松人工林土样中提取微生物总DNA,取4 μL DNA样用1%琼脂糖凝胶电泳检测。从图3可知,试验提取的总DNA亮度较好,无明显拖带现象,大小均约为23 kb左右。另外,在核酸蛋白测定仪上测定OD260和OD280值,OD260/OD280值介于1.8和2.0之间,说明所得到的总DNA质量符合实验要求(徐晓宇等,2005)。
以提取的土壤微生物总DNA为模板,F338-GC和R518为扩增引物,对16SrDNAV3可变区进行PCR扩增。如图4所示,16SrDNA扩增后的DNA片段长度是250 bp左右,特异性好、无杂带,与理论值相符。说明该PCR程序适用于16SrDNA的扩增,并且能够得到较好的产物。
2.4.2 土壤细菌群落DGGE图谱分析
图3 西南桦与马尾松人工林土壤总DNA的琼脂糖电泳图谱Fig.3 Agarose Gel Electrophoresis of Total DNA Extracted from Betula alnoides and Pinus massonian Plantation Soils
应用DGGE技术分离16SrDNAV3片段PCR产物,可分离到数目不等、位置各异的电泳条带(图5)。利用DGGE能分离长度相同而序列不同DNA的原理来反映土壤中的微生物种类和数量(kresk和Wellington,1999)。每一个条带大致与群落中的一个优势菌群或操作分类单元(Operational taxonomic unit,OUT)相对应,条带数越多,说明生物多样性越丰富;条带染色后的荧光强度越亮,表示该种属的数目越多。采用凝胶成像分析系统对DGGE图谱进行分析,结果表明:两种人工林各土层土壤细菌DGGE图谱的条带数量均表现为西南桦人工林多于马尾松人工林。西南桦人工林由上而下各土层细菌DGGE图谱的条带数量分别为16、11、11,马尾松的则为10、8、10。这一结果表明西南桦对林地土壤细菌丰度的影响优于马尾松,原因可能与西南桦属落叶深根树种有关。深根和落叶腐烂均能增加西南桦人工林土壤中有机质、全氮、全钾、碱解氮和速效钾等土壤养分含量,并使表层土壤微生物数量增加(表1)、酶活性及微生物生物量碳、氮提高(图1、2),从而提高了西南桦人工林土壤的细菌丰度。
图4 西南桦与马尾松人工林土壤细菌16SrDNA基因V3区扩增片段图谱Fig.4 PCR Amplified Fragment 16SrDNA (V3) Gene of Betula alnoides and Pinus massonian Plantation Soils
2.4.3 土壤细菌多样性分析
本文根据细菌16SrDNA的PCR-DGGE图谱中条带的位置和亮度的数值化结果计算了细菌群落结构指标Shannon-Wiener指数,Shannon指数值越大,表明细菌群落多样性越高(薛冬等,2007)。
两种人工林地土壤细菌Shannon指数和均匀度指数如表2所示。结果表明:西南桦人工林各土层层土壤细菌多样性指数均大于马尾松人工林(2.264)。西南桦人工林由上而下各土层土壤细菌多样性指数分别为2.727、2.358、2.373,马尾松的则为2.264、2.025、2.259。此结果说明西南桦树种比马尾松更有利于提高南方红壤区林地土壤细菌的多样性。
均匀度是表征物种在环境中的分布状况的指标,各物种个体数目越接近,均匀度数值越高(吴展才等,2005)。由表2可知,西南桦和马尾松人工林土壤中细菌均匀度指数无明显差异,表明两树种虽然导致土壤细菌多样性形成较大差异,但对细菌均匀度指数并无明显影响。
2.4.4 土壤细菌群落结构相似性分析
如表3所示为西南桦和马尾松人工林土壤细菌多样性的相似性分析。结果表明,西南桦与马尾松人工林表层土壤细菌多样性的相似性系数仅为41.8%,中层土和下层土则分别为63.3%和54.5%。一般认为,相似性系数高于60%的两个群体具有较好的相似性(陈法霖等,2011)。本研究结果说明虽然西南桦和马尾松人工林所处位置相邻,位于同一红壤区内,温度、降雨等外界环境条件相似,但造林树种的差异仍可导致土壤细菌多样性发生明显变化。

图5 西南桦与马尾松人工林土壤细菌的DGGE图谱(a)和DGGE条带强度示意图(b)Fig.5 DGGE Profile of Betula alnoides and Pinus massonian Plantation Soils and Sketch Map of Bands Distribution and Its Relative Luminance (b)
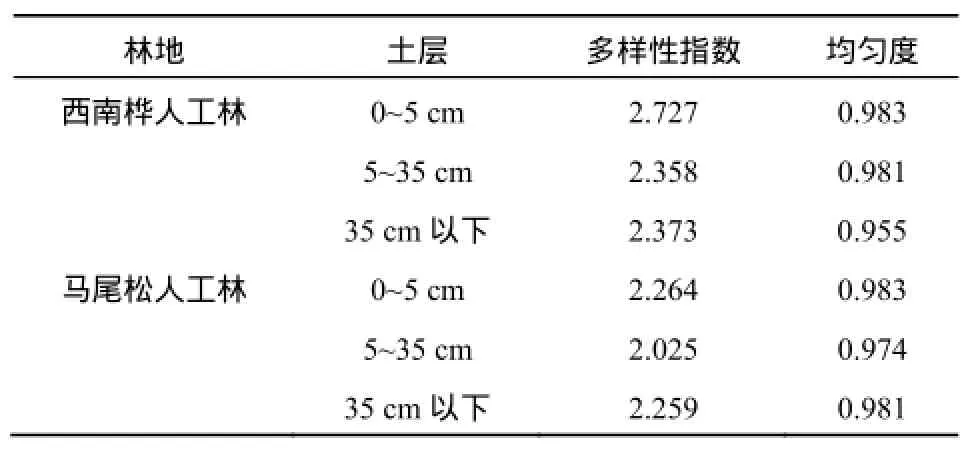
表2 西南桦和马尾松人工林土壤细菌种群多样性和均匀度指数Table 2 Shannon-Wiener(H) and Evenness( EH) of Each Soil Samples Estimated by the DGGE Bands Patterns of Betula alnoides and Pinus massonian Plantation Soils

表3 西南桦和马尾松人工林土壤细菌相似性系数Table 3 Similarity Coefficient of Soil Bacterial Communities in Betula alnoides and Pinus massonian Plantation Soils
3 讨论
3.1 不同造林树种的林分土壤理化性质
广西人工林面积约占全国的1/9,是我国人工林面积最大的省区。“十二五”期间,广西已成为我国最大的商品材生产基地,年森林采伐限额超过全国的1/3,居全国之首,为满足国家木材需求做出了巨大的贡献。其中,马尾松是我国特有的乡土树种,也是目前我国南方的主要造林树种。然而,由于长期大面积经营针叶纯林,南方已出现了林地生产力降低、生物多样性下降、病虫害增多等生态问题(何友均等,2013)。导致该现象发生的原因可能是由于不同类型人工林的枯枝落叶中化学成分各异,从而使其林下土壤化学性质各异,导致不同树种人工林土壤肥力形成差异。国内外学者针对不同森林类型土壤养分状况展开了调查研究,发现阔叶林和针阔混交林林地土壤的生产力大于针叶林(Fahlvik等,2005;Kelty,2006)。本研究针对西南桦阔叶人工林和马尾松针叶人工林的土壤理化性质分析发现,除全磷和速效磷外,两种林地表层土壤的理化性质指标均表现为西南桦人工林高于马尾松人工林。
3.2 不同造林树种的林分土壤微生物
土壤微生物数量的分布受林型、植被、林分组成和土壤有机质含量等生态因素影响,尤其受林型的影响最为严重(胡承彪等,1990)。本文的分析结果表明,马尾松人工林各土层土壤中可培养细菌数量均显著低于相应的西南桦人工林土壤。导致该现象的原因一方面可能是针叶中含有大量诸如单宁、树脂、纤维素和木质素等细菌难以分解利用的成分,细菌得不到充足的养分,无法进行大量繁殖;而阔叶林的落叶残体中含有较高的氮素和水分,容易被细菌分解利用,充足的养分条件使得细菌大量繁殖;另一方面,作为土壤有机质分解的主要参与者之一,真菌拥有较复杂的酶系统,能分解纤维素、半纤维素和木质素等很多难分解物质,但真菌数量少,分解缓慢;放线菌同样参与土壤中难分解物质的分解过程,也在土壤物质转化过程中扮演着重要角色。本研究针对两种林地土壤可培养真菌和放线菌数量的分析结果表明,可培养真菌数量在西南桦和马尾松人工林地土壤之间虽无明显差异,但其数量级分别比放线菌和细菌数量少了1个和2个;而可培养放线菌数量则表现为西南桦人工林土壤明显高于马尾松人工林。由此说明,西南桦人工林土壤物质转化的能力优于马尾松人工林。
土壤酶主要来源于土壤微生物。土壤中有机质的分解转化,依赖于微生物所产生的酶具备的催化活性来推动。由图1可知,西南桦人工林表层土壤中β-葡萄糖苷酶活性显著高于马尾松人工林土壤,说明西南桦人工林土壤中涉及碳素循环的生物活动作用强度高于马尾松人工林。蛋白酶活性虽然也表现为西南桦人工林表层土壤高于对应的马尾松人工林,但两者间未形成明显差异,说明两种人工林型土壤之间涉及氮素循环的生物活动作用强度相近。然而,磷酸酶活性却呈现与β-葡糖苷酶和蛋白酶活性相反的状态,该结果表明酶活性指标不适宜作为评价造林树种对林地土壤肥力或生态质量的影响指标。
土壤微生物生物量是衡量土壤质量、维持土壤肥力和作物生产力的一个重要指标(Powlson等,1987)。虽然土壤微生物生物量碳、氮指标在西南桦和马尾松人工林的表层土壤和下层土壤中均无明显差异,但中层(5~35 cm)土壤中两个指标均表现为西南桦人工林高于相应的马尾松人工林。究其原因,可能是西南桦为深根性树种,且属落叶乔木,长期落叶腐烂后直接增加了表层土壤的有机质和部分矿质元素的含量,从而间接地提高了土壤微生物的数量、酶活性以及微生物生物量等表征土壤肥力的生物学指标。部分针对西南桦的研究报道亦表明,西南桦人工林具有维持生物多样性、涵养水源、保持地力以及固定碳素等优良生态特性(孟梦和陈宏伟,2002;蒋云东和周凤林,1999;李江等,2003)。
此外,土壤微生物指标已被公认为是土壤生态系统变化的预警及敏感指标(任天志和Grego,2000)。土壤细菌占土壤微生物总数的70%~90%,是土壤中最活跃的生物(曹志平,2007)。研究不同造林树种对林地土壤细菌多样性的影响,不仅能评价造林树种对林地土壤肥力的影响,同时也能评价不同树种对人工林土壤生态系统的影响。本文研究结果表明,西南桦人工林土壤细菌丰度和多样性指数(Shannon-Wiener index)均高于相应的马尾松人工林。
综上所述,西南桦不仅在提升林地土壤肥力和生物学性状方面优于马尾松,而且对维持林地土壤细菌多样性方面亦优于马尾松。
4 结论
目前,虽然西南桦和马尾松林都是我国南方用于防止水土流失,改良生态环境的造林先锋树种,但西南桦在改良林地土壤养分,尤其是提高表层土壤肥力方面优于马尾松。
(1)西南桦和马尾松人工林土壤中可培养微生物数量均表现为:细菌>放线菌>真菌。除真菌外,西南桦人工林土壤中可培养细菌和放线菌数量均明显高于相应的马尾松人工林,而可培养真菌数量在这两种人工林土壤中无明显差异。
(2)西南桦和马尾松人工林土壤中β-葡萄糖苷酶、磷酸酶和蛋白酶活性变化均随着土层深度的增加而减弱,但不同的造林树种对β-葡萄糖苷酶、磷酸酶和蛋白酶活性的影响无明显规律,此结果说明酶活性指标不适宜作为评价不同造林树种对土壤肥力和生态质量影响的指标。
(3)西南桦和马尾松人工林土壤微生物生物量碳、氮指标虽然都随着土层深度的增加而递减,但西南桦对提高整个土层的微生物生物量碳、氮指标优于马尾松。
(4)西南桦人工林土壤细菌丰度和多样性指数(Shannon-Wiener index)亦高于相应的马尾松人工林土层,此结果表明西南桦是一种比马尾松更有利于提升红壤区土壤肥力和维持林地土壤生态质量的造林树种。
CARTER M R, RENNIE D A. 1984. Dynamics of soil microbial biomass N under zero and shallow tillage for spring wheat using 15N urea[J]. Plant Soil, 76(1-30): 157-164.
FAHLVIK N, AGESTAM E, NILSSON U, et al. 2005. Simulating the influence of initial stand structure on the development of young mixtures of Norway spruce and birch[J]. Forest Ecology and Management, 213: 297-311.
HAYANO K. 1973. A method for the determination of β-glucosidase activity in soil[J]. Soil Science & Plant Nutrition, 19(2):103-108.
JOERGENSEN R G, BROOKES P C. 1990. Nihydrinreactive nitrogen measurements of microbial biomass in 0.5M K2SO4soil extracts [J] Soil Biology & Biochemistry, 22: 1023-1027.
KELTY M J. 2006. The role of species mixtures in plantation forestry[J]. Forest Ecology and Management, 233: 195-204.
KRESK M, WELLINGTON E M H. 1999. Comparison of different methods for the isolation and purification of total community DNA from soil[J]. Journal of Microbiological Methods, 39: 1-16.
LADD J N. 1971. Properties of proteolytic enzymes extracted from soil[J]. Soil Biology & Biochemistry, 4: 227-237.
LI A, YANG S, LI X, et al. 2008. Microbial population dynamics during aerobic sludge granulation at different organic loading rates[J]. Water Research, 42(13): 3552-3560.
POWLSON D S, PROOKES P C, CHRISTENSEN B T. 1987. Measurement of soil microbial biomass provides an early indication of changes in total soil organic matter due to straw incorporation[J]. Soil Biology and Biochemistry, 19: 159-164.
TABATABAI M A, BREMNER J M. 1969. Use of p-nitrophenyl phosphate for assay of soil phosphatase activity[J]. Soil Biology & Biochemistry, 1: 301-307.
VAN HANNEN E J, ZWART G, VAN AGTERVELD M P, et al. 1999. Changes in bacterial and Eukaryotic community structure after mass lysis of filamentous cyanobacteria associated with virus[J]. Applied and Environmental Microbiology, 65: 795-801.
VANCE E D, BROOKS P C, JENKINSON D S. 1987. An extraction method for measuring soil microbial biomass C[J]. Soil Biology & Biochemistry, 19: 703-707.
曹志平. 2007. 土壤生态学[M]. 北京: 化学工业出版社: 211-222.
陈法霖, 张凯, 郑华, 等. 2011. PCR-DGGE技术解析针叶和阔叶凋落物混合分解对土壤微生物群落结构的影响[J]. 应用与环境生物学报, 17(2): 145-150.
分区考察组. 2009. 分区考察成果及防治对策(分区五):南方红壤区[J].中国水利, 7: 35-39.
冯健, 张健. 2005. 巨桉人工林地土壤微生物类群的生态分布规律[J].应用生态学报, 16(8): 1422-1426.
关松荫. 1986. 土壤酶及其研究法[M]. 北京:农业出版社:71-79.
广西土壤肥料工作站编著. 1994. 广西土壤[M],南宁: 广西科学技术出版社: 94-117.
何友军, 王清奎, 汪思龙, 等. 2006. 杉木人工林土壤微生物生物量碳氮特征及其与土壤养分的关系[J]. 应用生态学报, 17(12): 2292-2296.
何友均, 梁星云, 覃林, 等. 2013. 南亚热带马尾松红椎人工林群落结构、物种多样性及基于自然的森林经营[J]. 森林科学, 49(4): 24-33.
和文祥, 蒋新, 余贵芬, 等. 2003. 生态条件对土壤磷酸酶的影响[J]. 西北农林科技大学学报(自然科学版), 31(2): 81-83, 88.
胡承彪, 韦立秀, 韦原连, 等. 1990. 不同林型人工林土壤微生物区系及生化活性研究[J]. 微生物学杂志, 10(1): 14-20.
蒋云东, 周凤林. 1999. 西南桦人工林土壤养分含量变化规律研究[J].云南林业科技,87(2): 27-31.
李江, 陈宏伟, 冯弦. 2003. 云南热区几种阔叶人工林C储量的研究[J].广西植物,23(4): 294-298.
李振高, 骆永明, 滕应. 2008. 土壤与环境微生物研究法[M]. 北京: 科学出版社: 90-93.
刘久俊, 方升佐, 谢宝东, 等. 2008. 生物覆盖对杨树人工林根际土壤微生物、酶活性及林木生长的影响[J]. 应用生态学报, 19(6): 1204-1210.
刘玮, 张嘉超, 邓光华. 2010. 不同栽培时间三叶赤楠根际微生物多样性及其PCR-DGGE分析[J]. 植物研究, 30(5): 582-587.
刘文飞, 樊后保, 谢友森, 等. 2008. 闽西北马尾松人工林营养元素的积累与分配格局[J]. 生态环境, 17(2): 708-712.
罗海峰, 齐鸿雁, 张洪勋. 2004. 乙草胺对农田细菌多样性的影响[J]. 微生物学报, 44(4): 519-522.
孟梦, 陈宏伟. 2002. 西双版纳西南桦、山桂花人工林水源涵养效能研究[J]. 云南林业科技, 100(3): 46-49.
任天志, GREGO S. 2000. 持续农业中的土壤生物指标研究[J]. 中国农业科学, 33(1): 68-75.
吴展才, 余旭胜, 徐源泰. 2005. 采用分子生物学技术分析不同施肥土壤中细菌多样性[J]. 中国农业科学, 38(12): 2474-2480.
徐晓宇, 闵航, 刘和, 等. 2005. 土壤微生物总DNA提取方法的比较[J].农业生物技术学报, 13(3): 377-381.
薛冬, 姚槐应, 黄昌勇. 2007. 茶园土壤微生物群落基因多样性[J]. 应用生态学报, 18(4): 843-847.
杨万勤, 王开运. 2002. 土壤酶研究动态与展望[J]. 应用与环境生物学报, 8(5): 564-570.
Comparison on soil microbial activities and bacterial diversity between Betula alnoides and Pinus massoniana plantations in red soil region, China
YANG Shangdong1,2, WU Jun1, XIONG Liumei2, LIU Yongxian2, ZHOU Liuqiang2, XIE Rulin2, TAN Hongwei2, HUANG Guoqin3, ZHAN Qiguo4
1. Agricultural College/State Key Laboratory for Consevation and Utilization Subtropical Agro-bioresource, Guangxi University, Nanning 530004, China;
2. Guangxi Crop Genetic Improvement and Biotechnology Lab/Guangxi Key Laboratory of Sugarcane Genetic Improvement/ Guangxi Academy of Agricultural Sciences, Nanning 530007, China;
3. Jiangxi Agricultural University, Nanchang 330045, China;
4. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
In recent years, Betula alnoides and Pinus massoniana has been planted on large scale in red soil region of Guangxi Province. To clarify their influences on soil fertility and ecological quality in plantations, a comparative study was conducted to analyze the spatial variability of soil fertility and biological properties using the methods of dilution-plates and chloroform fumigation extraction. Meanwhile, the soil bacterial diversity in plantations was also analyzed by the method of polymerase chain reaction-denaturing gradient gel electrophoresis (PCR-DGGE). The results showed that the numbers of culturable bacteria and antinomycetes in the Betula alnoides plantation were significantly higher than those in the Pinus massoniana plantation, excepting the fungi number without any significant difference. However, there are no significant difference of β–Glucosidase, phosphatase and protease activities in soils between Betula alnoides and Pinus massoniana. It indicated that the activities of these three enzymes were not suitable as bio-indictors for evaluating the soil fertility and ecological qualities in this case. In contrast, biomass C and N-was significantly increased in whole soil layers of Betula alnoides plantation than those of Pinus massoniana plantation. In addition, the bacterial diversity index(Shannon-Wiener index)in Betula alnoides plantation soils layers were all higher than those in Pinus massoniana plantation. Therefore, it has been concluded that the tree species of Betula alnoides is better than Pinus massoniana in improving the soil fertility and maintaining soil ecological quality of forestland in degraded red soil region.
red soil; Betula alnoides; Pinus massoniana; soil fertility; ecological quality
S718.5
A
1674-5906(2014)03-0415-08
杨尚东,吴俊,谭宏伟,刘永贤,熊柳梅,周柳强,谢如林,黄国勤,赵其国. 南方红壤区西南桦和马尾松人工林土壤微生物活性及细菌多样性比较[J]. 生态环境学报, 2014, 23(3): 415-422.
YANG Shangdong, WU Jun, TAN Hongwei, LIU Yongxian, XIONG Liumei, ZHOU Liuqiang, XIE Rulin, HUANG Guoqin, ZHAO Qiguo. Comparison on soil microbial activities and bacterial diversity between Betula alnoides and Pinus massoniana plantations in red soil region, China [J]. Ecology and Environmental Sciences, 2014, 23(3): 415-422.
国家自然科学基金重点项目(U1033004);自治区重大项目(桂科大1347001);IPNI项目;广西农业科学院科技发展基金重点项目(2007001Z);(桂财〔2011〕314号),国家农业部专项(201003014)
杨尚东(1970年生),男,副教授,博士,主要从事土壤生态学和园艺植物营养与调控方向的研究。
*通讯作者:谭宏伟。E-mail: hongwei_tan@163.com
2013-10-25
