紫甘薯花色素与胰蛋白酶相互作用特性
2014-02-08朱少华李小定
刘 硕,王 萌,朱少华,姜 红,李小定
(华中农业大学食品科学技术学院,环境食品学教育部重点实验室,湖北 武汉 430070)
紫甘薯花色素与胰蛋白酶相互作用特性
刘 硕,王 萌,朱少华,姜 红,李小定*
(华中农业大学食品科学技术学院,环境食品学教育部重点实验室,湖北 武汉 430070)
测定紫甘薯花色素与胰蛋白酶反应前后酶的催化活性、催化反应动力学并采用紫外光谱法、荧光光谱法和红外光谱法研究紫甘薯花色素与胰蛋白酶相互作用 特性。结果表明:紫甘薯花色素对胰蛋白酶催化活性有明显的抑制作用,抑制类型为可逆的竞争性抑制,抑制常数Ki=6.16×10-4mmol/L,当紫甘薯花色素与胰蛋白酶的物质的量比为140∶1,在 37 ℃反应 15 min,抑制率达到38.61%,而反应时间对催化活性的影响不明显;紫甘薯花色素可使胰蛋白酶的内源荧光猝灭,猝灭类型为静态猝灭,室温下猝灭常数Kq为1.73×1012L/(mol·s),结合常数KA为3.88×104L/mol,结合位点数n为0.86;热力学参数确定两者之间的作用力主要为氢键和范德华力;根据Förster能量转移理论得出它们的结合距离为3.56 nm;红外光谱经过去卷积、二阶导数处理得知与紫甘薯花色素作用后胰蛋白酶的α-螺旋含量降低,β-折叠含量升高。
紫甘薯花色素;胰蛋白酶;酶学性质;紫外光谱;荧光光谱;红外光谱
胰蛋白酶是一种人和动物肠道内的蛋白水解酶,在消化和新陈代谢过程中发挥着十分重要的作用。它易溶于水,不溶于氯仿、乙醇、乙醚等有机溶剂。胰蛋白酶相对分子质量为23 300,其单一肽链含有233 个氨基酸残基和六对二硫键,其结构以β-折叠为主,属于丝氨酸蛋白酶家族。近年来关于小分子与胰蛋白酶的研究表明,2-氨基苯丙噻唑、芦丁、槲皮素、山奈酚、芹菜素都对胰蛋白酶有抑制作用,而油酸钠对其活性影响不明显;2-氨基苯丙噻唑和油酸钠通过氢键及范德华力与胰蛋白酶相互作用,诺氟沙星和盐酸环丙沙星通过氢键及疏水相互作用与胰蛋白酶相互作用;2-氨基苯丙噻唑、诺氟沙星和盐酸环丙沙星、芦丁、槲皮素、山奈酚、芹菜素都能引起胰蛋白酶静态猝灭,而油酸钠使胰蛋白酶发生动态猝灭;此外,研究还发现芦丁、槲皮素、山奈酚、芹菜素与胰蛋白酶形成复合物能提高胰蛋白酶的热稳定性和pH值稳定性;而胰蛋白酶对上述类黄酮的抗氧化作用起到抑制效果[1-6]。以上对于小分子与胰蛋白酶相互作用的研究多通过荧光光谱法和紫外光谱法,用红外光谱研究其相互作用并不多见,另外,由以上研究看出小分子多使胰蛋白酶发生静态猝灭,与胰蛋白酶的结合主要作用力为疏水作用力、氢键和范德华力。
大量流行病学研究证明食物中的花色苷和植物多酚对人类许多疾病有预防和治疗作用。目前,对花色素生理功能的研究集中在抗突变、抗氧化、抗肿瘤、保肝护肝等[7-9],而作为胰蛋白酶抑制剂的研究未见报道。近年来胰蛋白酶抑制剂已引起了医学界的普遍关注,它对急慢性胰腺炎、肺气肿、出血性休克、脑水肿、肿瘤[10]等疾病有一定的疗效;在心脏外科手术方面,能够防止凝血异常,杜绝手术过程中的意外情况。目前,对上述疾病的处理通常是疾病发生后用蛋白酶抑制剂类药品治疗,而不是日常生活中通过饮食预防。因此根据紫甘薯花色素对胰蛋白酶的抑制作用,通过食用紫甘薯食品对患有消化系统疾病的患者进行日常调节与控制,这对消化系统处于亚健康的人有重要意义。
本研究利用紫外吸收光谱、荧光光谱和红外光谱对紫甘薯花色素与胰蛋白酶的相互作用进行探究,分析花色素对胰蛋白酶的抑制能力,探讨它们相互作用的规律,以期为紫甘薯花色素在食品、医药保健行业中更合理有效的利用提供依据。
1 材料与方法
1.1 材料与试剂
紫甘薯花色素 湖北紫鑫生物科技有限公司。
胰蛋白酶、酪蛋白 合肥Biosharp公司;其他试剂均为国产分析纯,所有溶液都用二次去离子水配制并用Tris-HCl缓冲液保持生理pH值。
1.2 仪器与设备
UV1700紫外-可见分光光度计、BL-620S电子天平 日本岛津公司;F-4500型荧光分光光度计 日本日立公司;NEXU S型红外光谱仪 美国Nicdet公司;Beta2-8LD真空冷冻干燥机 德国Christ公司。
1.3 方法
1.3.1 花色素对胰蛋白酶活性的影响及抑制类型判断
取一定量的花色素和胰蛋白酶溶液,在不同反应条件下,测定反应前后胰蛋白酶的催化活性,探讨在37 ℃、pH 7.4条件下不同反应时间、花色素浓度比例对胰蛋白酶催化活性的影响。
胰蛋白酶活性的测定方法:1 mL胰蛋白酶液和2 mL 2 g/100 mL酪蛋白溶液在37 ℃水浴中保温10 min后,把酪蛋白加到胰蛋白酶液中,在37 ℃条件下酶解反应一段时间后,加入三氯乙酸终止反应。酶解溶液在3 000 r/min离心10 min,取上清液0.8 mL于具塞试管中,加入2 mL福林-酚溶液和3 mL pH 5.0乙酸缓冲液,在37 ℃水浴中显色10 min,在660 nm波长处测定吸光度。
1.3.1.1 花色素浓度对胰蛋白酶活 性的影响
根据上述胰蛋白酶活性测定方法在反应体系胰蛋白酶液中加入2 mL不同浓度梯度的花色素溶液,设置酶解反应为15 min,测定660 nm波长处吸光度。抑制率按如下公式(1)计算。
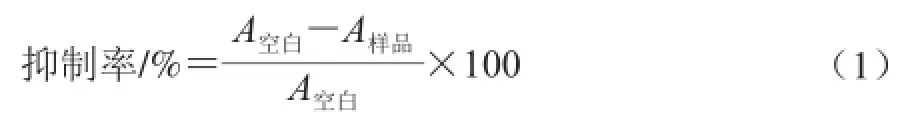
式中:A空白为空白组吸光度;A样品为加入胰蛋白酶后吸光度。
1.3.1.2 反应时间对胰蛋白酶活性的影响
根据上述胰蛋白酶活性测定方法在反应体系胰蛋白酶液中加入2 mL质量浓度为0.014 3 g/mL的花色素溶液,设置不同酶解反应时间为5、15、30、60 min,测定660 nm波长处吸光度,并按1.3.1.1节式(1)计算抑制率。
1.3.1.3 抑制类型判断
抑制类型判断:根据上述胰蛋白酶活性测定方法在含有2 g/100 mL酪蛋白底物的反应体系中,不加花色素溶液,设置酶解反应时间15 min,分别加入3 种浓度的胰蛋白酶液,测定660 nm波长处的吸光度,以v对胰蛋白酶液浓度([En])作图,得到一条直线。按此方法,加入确定浓度的花色素溶液再作图,最终得到两条直线,以此判断抑制类型是否可逆。
可逆抑制类型判断:根据上述胰蛋白酶活性测定方法在反应体系胰蛋白酶液中加入2 mL某一确定浓度的花色素溶液,设置酶解反应为15 min,分别加入质量浓度为4、2、1、0.5 g/100 mL的酪蛋白底物,测定660 nm波长处吸光度。根据Lineweaver-Burk双倒数作图法,固定酶和样品浓度改变底物浓度测反应速率,以1/v和1/[S]作图,得到两条直线,来判断可逆类型。
1.3.2 紫外吸收差谱
于2.0 mL 5×10-6mol/L的胰蛋白酶溶液中加入不同微量体积的1.0×10-3mol/L花色素溶液,使花色素与胰蛋白酶的终物质的量比分别为0、0.2∶1、0.4∶1、0.6∶1、0.8∶1、1∶1、2∶1、4∶1、6∶1、8∶1、10∶1、12∶1,混合均匀后室温作用30 min,以相同浓度的胰蛋白酶溶液作空白,记录胰蛋白酶溶液的紫外吸收差谱。
1.3.3 荧光光谱
于2.0 mL 5×10-6mol/L的胰蛋白酶溶液中加入不同体积的1.0×10-3mol/L花色素溶液,混和均匀后作用5 min,以λex=280 nm波长激发,在荧光光谱仪上记录胰蛋白酶溶液的荧光发射光谱变化。
1.3.4 红外光谱
将胰蛋白酶溶液和胰蛋白酶与花色素的样品混合溶液(胰蛋白酶浓度为5×10-6mol/L,花色素浓度为1.5×10-3mol/L)冷冻干燥,冻干后的粉末放在干燥器中待测。通过KBr压片法,得到胰蛋白酶及混合体系的红外光谱。
2 结果与分析
2.1 酶学性质
2.1.1 花色素浓度对胰蛋白酶活性的影响

图1 花色素加入量对胰蛋白酶活性的抑制作用Fig.1 Effect of anthocyanins concentration on trypsin activity
类黄酮类化合物与酶蛋白结合能抑制胰蛋白酶的催化活性,抑制作用与化合物的分子结构和浓度、酶蛋白的氨基酸组成及构型等密切相关[11]。如图1所示,花色素对胰蛋白酶的催化活性具有明显的抑制作用。随着花色素浓度比例的增加,其对胰蛋白酶活力的抑制率也明显增加。当花色素浓度继续增加到0.03 mmol/L(花色素与胰蛋白酶物质的量比约为14∶1),其对酶活性的抑制效果的增幅变缓。花色素添加量为0.3 mmol/L(花色素与胰蛋白酶物质的量比约为140∶1)时,对胰蛋白酶的催化活性抑制率达到38.61%。
2.1.2 反应时间对胰蛋白酶活性的影响

图2 反应时间对胰蛋白酶活性的影响Fig.2 Effect of reaction time on trypsin activity
如图2所示,随着反应时间的增加,花色素对胰蛋白酶催化活性的抑制作用并没有发生明显的变化,说明花色素和胰蛋白酶能很快完成反应。
2.1.3 花色素对胰蛋白酶抑制类型的判断
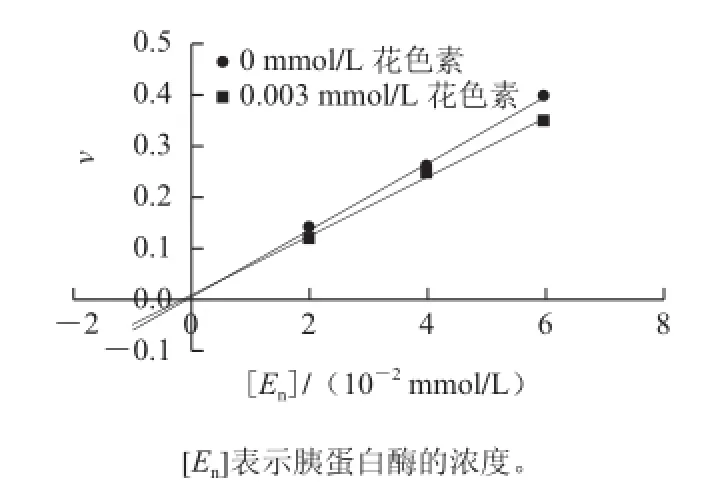
图3 花色素对胰蛋白酶的抑制作用机理判断Fig.3 Determination of the inhibitory mechanism of anthocyanins on trypsin

图4 花色素对胰蛋白酶抑制作用的Lineweaver-Burk双倒数曲线Fig.4 Lineweaver-Burk plots of anthocyanins for the inhibition of trypsin
根据抑制剂与酶的作用方式,以及抑制剂对酶的作用是否可逆,可将抑制剂作用分为不可逆的抑制作用和可逆的抑制作用两大类;根据可逆抑制剂与底物的关系,可逆的抑制作用可分为竞争性抑制、非竞争性抑制、反竞争性抑制。黄酮类化合物与酶蛋白结合,结合到酶的活性部位表现为竞争性抑制,结合到非活性部位表现为非竞争性抑制[11-12]。观察图3,加入花色素后直线斜率改变,而不是向右平移,推断花色素对胰蛋白酶的抑制作用是可逆的[13]。由图4可知,米氏常数随抑制剂质量浓度的增大而增大,最大反应速率保持不变。根据竞争性抑制动力学方程分别可求得花色素在不同加入量下表现的抑制常数Ki=6.16×10-4mmol/L,花色素对胰蛋白酶的抑制类型是可逆竞争性抑制。
2.2 花色素作用胰蛋白酶后的紫外吸收光谱
由图5可知,随花色素浓度的升高,胰蛋白酶在220 mn附近处的吸收峰增强并发生红移。近紫外区(200~400 nm)的紫外吸收是共扼体系中:π(成键轨道)→π*(反键轨道)电子跃迁或非共轭体系中的n(孤对电子)→π*(反键轨道)引起的。蛋白质肽键有部分双键性质,使发生几率较小的n(氮上的孤对电子)→π*跃迁更加难发生,因此胰蛋白酶220 nm附近的紫外吸收峰推测是由于肽键C=O基团的π→π*跃迁所引起[14],与蛋白质的α-螺旋有关。花色素引起胰蛋白酶紫外吸收峰强度增加和红移的实质是:胰蛋白酶α-螺旋含量降低且π(成键轨道)→π*(反键轨道)电子跃迁能量差变小,电子跃迁几率增加。

图5 不同浓度花色素作用胰蛋白酶后的紫外吸收光谱Fig.5 UV absorption spectra of trypsin after treatment with anthocyanins at various concentrations
2.3 花色素作用胰蛋白酶后的荧光光谱
2.3.1 花色素对胰蛋白酶荧光的猝灭效应
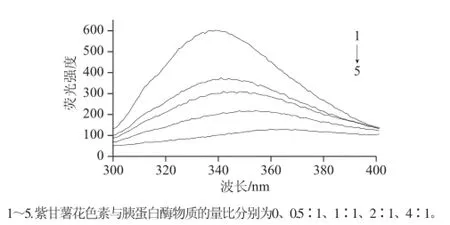
图6 不同浓度的花色素对胰蛋白酶的荧光猝灭效应Fig.6 Fluorescence quenching of trypsin by anthocyanins at various concentrations
蛋白分子中的色氨酸、酪氨酸和苯丙氨酸均有荧光产生,色氨酸的荧光最强,酪氨酸次之,苯丙氨酸最弱(荧光强度比为100∶9∶0.5)[15],因此本研究主要探讨色氨酸的荧光变化。由图6可知,随着花色素浓度增大,胰蛋白酶荧光光谱发生了荧光峰位移和荧光猝灭。荧光猝灭说明色氨酸的空间位置发生了改变[16],而荧光峰从339 nm红移到366 nm,说明色氨酸周围微环境发生改变,由疏水变得更加亲水[17]。
2.3.2 花色素与胰蛋白酶相互作用的荧光猝灭机理与结合常数
荧光猝灭是由于荧光物质分子与溶剂分子或其他溶质分子的相互作用引起的荧光强度降低的现象。荧光猝灭的机制主要有两种:静态猝灭和动态猝灭,猝灭机制都可用Stern-Volmer方程描述[18]:
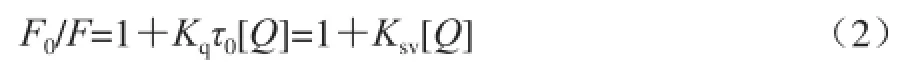
式中:F0和F分别是加入猝灭剂前后荧光强度;[Q]是猝灭剂浓度;τ0为生物分子的荧光寿命,约10 ns[19];Kq为双分子碰撞猝灭常数(又称表观猝灭常数);Ksv为Stern-Volmer猝灭常数,且Ksv=Kqτ0,作花色素对胰蛋白酶猝灭的F0/F~[Q]曲线,见图7。

图7 花色素对胰蛋白酶荧光猝灭Stern-Volmer曲线Fig.7 Stem-Volmer plots of fluorescence quenching of trypsin by anthocyanins
求得花色素对胰蛋白酶的表观猝灭常数Kq为1.73×1012L/(mol·s)(304 K)、1.91×1012L/(mol·s)(300 K)远大于各种猝灭剂对生物大分子的最大扩散碰撞常数2.0×1010L/(mol·s)[19],此外,Ksv分别为1.73×104L/mol(304 K)、1.91×104L/mol(300 K),猝灭常数Ksv随着温度的升高而降低,因此推断花色素对胰蛋白酶的荧光猝灭并不是由于分子扩散进而发生动态碰撞引起的动态猝灭,而是花色素与胰蛋白酶形成缔合物而引起的静态猝灭。
在静态猝灭中,荧光体的荧光强度与其游离浓度成正比,则有[19]:

以lg[(F0-F)/F]对lg[Q]作线性拟合(图8),即可求出花色素与胰蛋白酶的结合常数KA和结合点数n。

图8 lg[(F0-F )/ ]与lg[Q]的关系图Fig.8 Plot of lg[(F0-F)/F] vs lg[Q]
由图8求出KA为3.88×104L/mol(304 K),n为 0.86(304 K),结果表明花色素与胰蛋白酶只有一个结合位点。
2.3.3 花色素与胰蛋白酶相互作用的热力学参数和作用力
热力学参数和小分子与蛋白质之间作用力的关系如下[18]:

为确定花色素与胰蛋白酶之间相互作用力类型,同时研究了300 K条件下花色素对胰蛋白酶的荧光猝灭作用,并求出K=5.92×104L/mol。由式(4)可得ΔH =-80.14 kJ/mol,由式(5)和式(6)可得ΔG=-26.71 kJ/mol,ΔS =-175.75 J/mol。根据Ross等[20]总结出判断生物大分子与小分子结合力性质和生物大分子自身结合力性质的热力学规律,以小分子与生物大分子反应的热力学参数的变化判断小分子与蛋白质之间的主要作用力类型的规律。即当ΔS>0,ΔH>0为典型的疏水作用力;ΔS<0,ΔH<0为氢键和范德华力;当ΔS>0,ΔH<0时,主要存在静电相互作用。因此,花色素与胰蛋白酶的结合是熵减少、自由能降低的自发过程(ΔG<0),又因为ΔS<0,ΔH<0所以花色素与胰蛋白酶分子间作用力主要表现为氢键和范德华力。
2.3.4 花色素与胰蛋白酶结合的距离
蛋白质的内源荧光主要是色氨酸残基产生的,因此根据Förster能量转移理论[21]可计算出小分子在蛋白质上的结合位置与色氨酸残基之间的距离r,即两种化合物满足:1)供能体发荧光;2)供能体的荧光发射光谱与受能体的吸收光谱有足够的重叠;3)供能体与受能体的最大距离不超过7 nm。
在实验中,根据胰蛋白酶的荧光发射光谱和花色素的紫外吸收光谱的重叠图谱(图9),应用下列公式[22]计算胰蛋白酶与花色素之间的结合距离r:

式中:F0和F分别是胰蛋白酶和花色素-胰蛋白酶(物质的量比1∶1)的荧光;R0是E = 50%时的临界距离;K2为偶极空间取向因子;N为介质的折射指数;Φ为供体胰蛋白酶的荧光量子产率;J为供体胰蛋白酶荧光光谱与受体花色素吸收光谱的重叠积分;Fλ为荧光供体在波长λ处的荧光强度;ελ为受体在波长λ处的摩尔吸光系数。
根据公式求得花色素与胰蛋白酶的重叠积分J= 8.71×10-14cm3/mol,R0=3.52 nm,E=0.48。花色素和胰蛋白酶之间的结合距离r=3.56 nm。由于r<7 nm,且0.5 R0<r<1.5 R0,因此推断花色素和胰蛋白酶发生了Förster偶极-偶极非辐射能量转移,并引起了荧光猝灭,表明花色素与胰蛋白酶发生缔合。

图9 花色素的吸收光谱(a)和胰蛋白酶的荧光光谱(b)Fig.9 UV-visible absorption spectrum of anthocyanin (a) and fluorescence emission spectrum of trypsin (b)
2.4 花色素作用胰蛋白酶后的红外光谱

图10 花色素-胰蛋白酶的红外光谱Fig.10 FT-IR spectra of trypsin alone and in the presence of anthocyanins
通过红外光谱可以定量地确定蛋白质的结构含量变化。由图10可知,花色素与胰蛋白酶相互作用后1 640 cm-1峰和1 543 cm-1峰位置均发生位移,说明花色素与胰蛋白酶发生了相互作用,使胰蛋白酶的二级结构发生了变化,这可能是由于花色素与胰蛋白酶分子中的C=O和C—N或N—H基团发生了相互作用[23],也可能是花色素与蛋白质分子的多肽链之间形成了氢键。
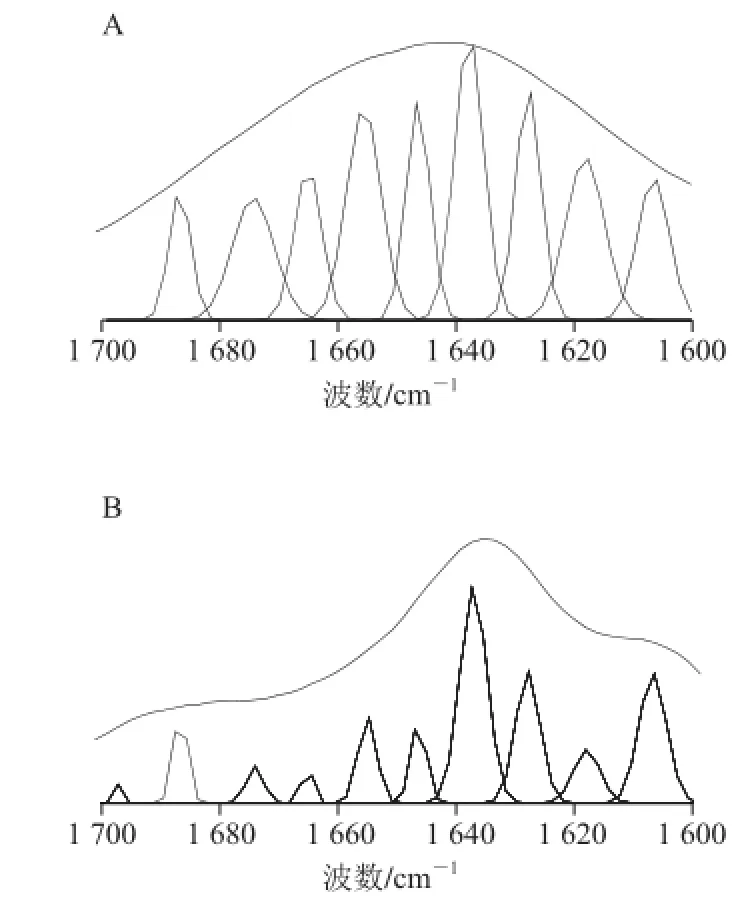
图12 胰蛋白酶(A)及花色素-胰蛋白酶(B)去卷积谱的曲线拟合结果Fig.12 Fitting curves of amide I (1 700-1 600 cm-1) of free trypsin (A) and anthocyanins-trypsin complex (B)
根据蛋白质酰胺Ⅰ带(1 600~1 700 cm-1)谱峰归属[24]:1 610~1 640 cm-1为β-折叠;1 640~1 650 cm-1为无规则卷曲;1 650~1 658 cm-1为α-螺旋;1 658~1 695 cm-1为β-转角。将得到的红外光谱二阶导数、去卷积处理,把酰胺Ⅰ带中未能分辨的峰进一步分解为多个子峰,并指认各子峰位置,再通过曲线拟合的方法,定量地分析胰蛋白酶二级结构的各个组分。图11和图12表示了花色素-胰蛋白酶体系的二阶导数谱、去卷积谱和曲线拟合结果。通过图12中各谱峰峰面积的比值可得花色素对胰蛋白酶二级结构的影响变化值(表1)。加入花色素后,胰蛋白酶构象中α-螺旋、β-转角和无规则卷曲含量分别减少6.6%、11.1%和5.0%,β-折叠含量增加了21.7%,说明花色素与胰蛋白酶发生了相互作用,使胰蛋白酶主要构象β-折叠含量升高。

表1 胰蛋白酶及花色素-胰蛋白酶的二级结构含量Table1 Secondary structure contents of free trypsin and anthocyaninstrypsin complex
3 结 论
紫甘薯花色素对胰蛋白酶活性存在可逆的竞争性抑制作用;二者之间发生了相互作用,且主要作用力为氢键和范德华力;花色素通过静态猝灭和能量转移的方式使胰蛋白酶内源荧光减弱;二者相互作用后胰蛋白酶二级结构发生了变化,主要构象β-折叠含量增加。在本研究基础上,还可通过圆二色谱和分子模拟进一步探讨花色素对胰蛋白酶二级结构影响以及二者的结合位置。
[1] 房晓燕. 从BSA、胰蛋白酶和红细胞角度评价油酸钠的生物毒性和机理[D]. 济南: 山东大学, 2010.
[2] 李娜娜. 光谱法和原子力显微镜研究小分子药物与人血清白蛋白相互作用[D]. 汕头: 汕头大学, 2011.
[3] 孙雅倩. 2-氨基苯并噻唑与hs-DNA, HSA及胰蛋白酶作用的研究[D].济南: 山东大学, 201 2.
[4] 王公轲. 蛋白质和核酸与活性药物小分子相互作用的研究[D]. 新乡: 河南师范大学, 2012.
[5] 许明. 苦荞黄酮类化合物的稳定性及其与胰蛋白酶相互作用的研究[D]. 太原: 山西大学, 2013.
[6] 赵红辉. 类黄酮与胰蛋白酶相互作用特性的研究[D]. 广州: 华南理工大学, 2012.
[7] BOBE G, WAGN Bing, SEERA M N P, et al. Dietary anthocyaninrich tart cherry extract inhibits intestinal tumorig enesis in APCMinmice fed suboptimal levels of sulindac[J]. Journal of Agricultural a nd Food Chemistry, 2006, 54: 9322-9328.
[8] JING Pu, BORNSER J A, SCHWARTZ S J, et al. St ructure-function relationships of anthocyanins from various anthocyanin-rich extracts on the inhibition of colon cancer cell growth[J]. Journal of Agricultural and Food Chemistry, 2008, 56(20): 9391-9398.
[9] HE Rui, LI Zhimin. The stability and antioxidant activity of anthocyanins from blueberry[J]. Food Technolog y and Biotechnology, 2010, 48(1): 42-49.
[10] PANDYA M J, SMITH D A, YARWOOD A, et al. Complete amino acid sequences of two inhibitors from buckwheat seed[J]. Phytochemistry, 1997, 43(2): 327-331.
[11] KIM D H, JUNG E A, SOHNG I S, et al. Intestinal bact erial metabolism of flavonoids and its relation to some biological activities[J]. Archives of Pharmacal Research, 1998, 21(1): 17-23.
[12] 曹艳妮, 刘通讯. 多种普 洱茶水浸提物体外抗氧化性质研究[J]. 现代食品科技, 2010, 26(9): 944-947.
[13] 王镜岩, 朱圣庚, 徐长法. 生物化学教程[M]. 北京: 高等教育出版社, 2008: 164.
[14] 邢其毅. 基础有机化学[M]. 北京: 高等教育出版社, 1993: 256-259.
[1 5] SULKOWAKA A. Interaction of durgs with bovine and human serum albumin[J]. Journal of Molecular Structure, 2002, 614(1): 227-232.
[16] TIAN Jianniao, ZHAO Yanchun, LIU Xiuhong, et al. A ste adystate and time-resolved fluorescence, circular dichroism study on the binding of myricetin to bovine serum albumin[J]. Luminescence, 2009, 24: 386-393.
[17] TYRNDA-LEMIESZ L, KA RACZYN A, KEPPLER B K, et al. Studies on the interaction betwee n hum na seurm albumin and imidazolium[J]. Journal of Inorganic Biochemistry, 1999, 73:123-128.
[18] 陈晓岚, 于斐, 屈凌波, 等. 荧光及ESI质谱法研究溶菌酶与磷酰 化黄酮的相互作用[J]. 化学学报, 2004, 62(2): 188-192.
[19] 杨炜春, 刘维屏, 方肇华, 等. 荧光光谱法研究莠去津与过氧化氢酶的相互作用[J]. 浙江大学学报: 理学版, 2002, 29(5): 542-547.
[20] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions: forces con tributing to stability[J]. Biochemistry, 1981, 20(11): 3096-3102.
[21] GHOSH K S, SAHOO B K, DASGUPTA S. Spectrophotometric studies on the interaction between (-)-epigallocatechin ga llate and lysozyme[J]. Chemical Physics Letters, 2008, 452(1/3): 193-197.
[22] ZHANG Guowen, CHEN Xiuxia, GUO Jinbao, et al. Spectroscopic investigation of the interaction between chrysin and bovine serum albumin[J]. Journal of Molecular Str ucture, 2009, 921: 346-351.
[23] PURCELL M, NEAULT J F, MALONGA H, et al. Interaction of atrazine and 2,4-D with human serum albumin studied by gel and capi llary electrophoresis, and FTIR spectroscopy[J]. Biochimica et Biophysica Acta, 2001, 1548(1): 129-138.
[24] 秦身钧, 王建滨, 姚宏伟, 等. 计算机辅助解析FTIR定量研究蛋白质构象的应用进展[J]. 河北师范大学学报, 2006, 30(3): 331-335.
Interaction between Purple Sweet Potato Anthocyanins and Trypsin
LIU Shuo, WANG Meng, ZHU Shao-hua, JIANG Hong, LI Xiao-ding*
(Key Laboratory of Environment Correlative Dietology, Ministry of Education, College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
The interaction between purple sweet potato anthocyanins and trypsin was studied by measuring the catalytic activity and reaction kinetics through ultraviolet (UV) absorption, fluorescence and infrared (IR) spectroscopy. The results showed that purple sweet potato anthocyanins had an obvious inhibitory effect on trypsin catalytic activity, and the inhibition was reversible competitive inhibition with an inhibitory constant (Ki) of 6.16 × 10-4mmol/L. When the r eaction between purple sweet potato anthocyanins and trypsin with a mole ratio of 140:1 was carried out at 37 ℃ for 15 min, the inhibitory rate was 38.61%; however, the catalytic activity was not obviously affected by reaction time. Purple sweet potato anthocyanins treatment led to the quenching of intrinsic fluorescence of trypsin. The quenching of trypsin by purple sweet potato anthocyanins was probably a static quenching process with a quenching constant (Kq) of 1.73×1012L/(mol s), and a binding constant (KA) of 3.88×104L/mol. The number of binding sites was 0.86. According to the thermodynamic parameters, hydrogen bonding and van der Waals force played a dominant role in the interaction between the anthocyanins and trypsin. The distance between donor and acceptor in anthocyanin-trypsin was calculated as 3.56 nm, based on the equations from Förster non-radiation energy transfer theory. The IR spectra revealed the conformational change of trypsin caused by binding, thus leading to a decrease of α-helix and an increase of β-fold.
purple sweet potato anthocyanins; trypsin; enzym atic properties; ultraviolet (UV) absorption spectroscopy; fluorescence spectroscopy; infrared (IR) spectroscopy
TS201.2
A
1002-6630(2014)23-0232-06
10.7506/spkx1002-6630-201423045
2014-01-07
刘硕(1990—),女,硕士研究生,研究方向为天然产物化学。E-mail:liushuo@webmail.hzau.edu.cn
*通信作者:李小定(1968—),男,副教授,博士,研究方向为粮食油脂与植物蛋白工程、天然产物化学。E-mail:lixd@mail.hzau.edu.cn
