离子强度对猪肉肌原纤维蛋白乳化特性和理化特性的影响
2014-02-08吴菊清邵俊花魏朝贵徐幸莲周光宏
吴菊清,邵俊花,魏朝贵,徐幸莲,周光宏,*
(1.南京农业大学 肉品加工与质量控制教育部重点实验室,江苏 南京 210095;2.渤海大学食品科学研究院,辽宁 锦州 121013)
离子强度对猪肉肌原纤维蛋白乳化特性和理化特性的影响
吴菊清1,邵俊花2,魏朝贵1,徐幸莲1,周光宏1,*
(1.南京农业大学 肉品加工与质量控制教育部重点实验室,江苏 南京 210095;2.渤海大学食品科学研究院,辽宁 锦州 121013)
以猪肉肌原纤维蛋白为研究对象,测定不同离子强度下肌原纤维蛋白的乳化特性,包括乳化能力(emulsifying capacity,EC)、乳化稳定性(emulsifying stability,ES),同时测定不同离子强度下肌原纤维蛋白的溶解性、分子间氢键、表面疏水性、活性巯基和总巯基等理化特性,并对理化特性、乳化特性指标进行了相关性分析。结果表明:随着介质离子强度的提高,肌原纤维蛋白的EC和ES增强,溶解度增大,分子间氢键、活性巯基呈上升趋势,表面疏水性则呈下降趋势,而总巯基则无明显变化;溶解度与EC显著正相关(P<0.05),与ES呈极显著正相关(P<0.01),活性巯基和氢键都与EC呈极显著正相关(P<0.01),而表面疏水性与EC呈极显著负相关(P<0.01),与ES显著负相关(P<0.05)。结论:改变肌原纤维蛋白介质的离子强度,导致肌原纤维蛋白的乳化特性、理化特性产生变化,肌原纤维蛋白的理化特性和乳化特性之间有显著或极显著的相关性。
肌原纤维蛋白;乳化;离子强度;溶解度
肉的加工特性主要包括溶解性、凝胶性、乳化性、保水性等,其中乳化性是最重要的加工特性之一,而肌原纤维蛋白是参与乳化的主要物质,在小颗粒脂肪和小油滴界面蛋白膜的形成过程中扮演着重要角色,对乳化肉制品的质构、黏着性、保油保水性和出品率有直接的影响,对终产品的品质起决定性作用[1]。肌原纤维蛋白属于盐溶性蛋白质,当pH值升高远离等电点时,提高介质的离子强度,则可以提高其溶解度,而蛋白质的溶解度与其保水性、乳化性及凝胶性等加工特性有密切关系[2]。食盐是肉类加工必不可少的辅料,能有效提高离子强度,从而提高肌原纤维蛋白溶解度,利于肌原纤维蛋白的提取[3]。此外有报道称[4]:NaCl可降低肌原纤维蛋白的等电点,使其在通常的pH值范围内带有更多的净电荷,增强肌原纤维蛋白的溶解性,从而改善其加工特性。Zorba等[5]研究了2.5%、3.0%的食盐添加量对猪肉乳化能力的影响,发现添加3.0%盐比添加2.5%盐使猪肉具有更高的乳化能力;Yapar等[6]研究了不同的食盐添加量对鲤鱼肉乳化能力的影响,发现乳化能力随着食盐添加量的增加(分别为0.0%、1.0%、2.0%)而增加,但并不显著。综上,食盐会直接影响肌原纤维蛋白的理化特性和加工特性,但过高的用量会导致高食盐的摄入,影响人类健康[7-8],过低的用量又会减弱肉蛋白的加工特性,导致肉制品品质的劣变。蛋白质分子间的相互作用力对乳化性也有明显的影响[2,9]。目前NaCl对肌肉蛋白质加工特性影响的研究较多,但对其机制研究较少。
由于人们日益意识到动物脂肪对健康的不利影响,而植物油含有高比例的多不饱和脂肪酸且不含胆固醇,因此植物油替代动物脂肪已成趋势[10]。本实验用大豆油替代猪背膘、用NaCl浓度改变介质的离子强度,研究离子强度对猪肉肌原纤维蛋白乳化特性包括乳化能力(emulsifying capacity,EC)、乳化稳定性(emulsifying stability,ES)的影响,同时测定不同离子强度下肌原纤维蛋白的理化特性,包括蛋白质的溶解度、分子间氢键、表面疏水性、活性巯基和总巯基等,并对理化特性、乳化特性指标进行相关性分析,研究离子强度造成乳化性质差异的原因,以期为乳化型肉制品的生产优化配方、在保证肉制品质构、感官特性的同时,减少NaCl用量,为低盐乳化型肉制品的生产提供理论依据。
1 材料与方法
1.1 材料
宰后24 h(pH 5.6~5.8)的猪肉背最长肌,购于南京苜蓿园大街菜市场。剔除多余脂肪和结缔组织,切碎,真空包装,贮存于-20 ℃备用。使用前样品在0~4 ℃解冻。金龙鱼大豆油购于超市。
1.2 仪器与设备
T25数显型高速匀浆机 德国IKA公司;SensoDirect Con 200型电导率仪 德国Tintometer GmbH公司;DV-I Prime型黏度计、Avanti J-E型多用途高效离心机 美国Beckman Coulter公司;YZ 2515 x型蠕动泵 河北保定兰格恒流泵有限公司。
1.3 方法
1.3.1 肌原纤维蛋白提取及不同NaCl浓度的蛋白溶液制备
参考韩敏义等[3]的方法提取猪肉肌原纤维蛋白。100 g切碎瘦肉解冻12 h,加入4 倍体积的僵直提取缓冲液(100 mmol/L Tris,10 mmol/L乙二胺四乙酸(ethylenediaminetetraa cetic acid,EDTA),pH 8.3),匀浆,1 000×g离心20 min,把沉淀分散在4 倍体积的标准盐溶液(standard salt solution,SSS,100 mmol/L KCl、20 mmol/L K2HPO4/KH2PO4、2 mmol/L MgCl2、1 mmol/L乙二醇-双-(2-氨基乙醚)四乙酸、1 mmol/L NaN3,pH 7.0),1 000×g离心10 min收集沉淀,重复3 次。沉淀重新分散在4 倍体积的含1%TritonX-100的SSS中,再1 500×g离心10 min收集沉淀,重复两次。在沉淀中加入4 倍体积0.1 mol/L KCl,重复两次后,在沉淀中加入4 倍体积0.1 mol/L NaCl溶液经1 500×g离心10 min收集沉淀,得到纯化的肌原纤维蛋白。蛋白质浓度用双缩脲法测定[11],用牛血清白蛋白作用为标准蛋白,提取的肌原纤维蛋白在48 h内用完。
称取一定质量的粗蛋白,分别溶于NaCl浓度为0.1、0.2、0.3、0.4、0.5、0.6 mol/L的磷酸盐缓冲液中(50 mmol/L Na2HPO4/NaH2PO4,pH 6.5),根据需要配制成不同浓度的肌原纤维蛋白溶液,于冷库(4 ℃左右)中保存,待用。
1.3.2 溶解度测定
根据双缩脲法[11],取7 mL 5 mg/mL不同NaCl浓度的肌原纤维蛋白溶液,1 500×g离心10 min后,取上清液以及不同NaCl浓度的肌原纤维蛋白原液各2 mL,分别加入8 mL双缩脲试剂混匀,同时取不同NaCl浓度的磷酸盐缓冲液(50 mmol/L Na2HPO4/NaH2PO4,pH 6.5)2 mL与8 mL双缩脲试剂混匀后作空白对照,置于20~25 ℃水浴锅内保温30 min,于可见分光光度计540 nm波长处测定吸光度,每个处理测定3 个重复,按公式(1)计算溶解度。

1.3.3 氢键含量测定
氢键含量的测定参照Visessanguan等[12]方法,并略加改进。具体操作步骤:取3 mL 5 mg/mL不同NaCl浓度的肌原纤维蛋白样液,分别加入0.5 mL的S1溶液(20 mmol Tris,1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS),pH 8.0)和S2溶液(0.5 mol/L NaOH),室温振荡均匀放置1 h,12 100×g离心30 min,取0.6 mL上清液加入50%三氯乙酸(trichloroacetic acid,TCA)溶液,使上清液的最终TCA浓度达到10%,样品在4 ℃冷库中放置15 min后2 500×g离心20 min,沉淀用S2溶液溶解,蛋白质含量采用双缩脲法测定,氢键含量以S1溶解的蛋白含量占S2溶解的蛋白质含量的百分比表示,用相应的磷酸缓冲液做空白对照。
1.3.4 表面疏水性的测定
表面疏水性的测定采用Chelh等[13]方法,并略加修改。取1 mL 5 mg/mL不同NaCl浓度的蛋白样液,加入60 μL 1 mg/mL的溴酚蓝溶液,涡旋振荡混匀10 min,用相应的磷酸缓冲液做空白对照,离心15 min后在595 nm波长处测定光密度值。表面疏水基含量按公式(2)计算。

式中:OD1为空白样品的光密度值;OD2为样品的光密度值。
1.3.5 总巯基和活性巯基含量测定
参照Ellman[14]的方法,并略加改进。总巯基含量测定:取1.5 mL 5 mg/mL不同NaCl浓度的蛋白样液悬浮于10.0 mL的Tris-甘氨酸缓冲液(0.086 mol/L Tris,0.09 mol/L甘氨酸,4 mmol/L EDTA,8 mol/L尿素,pH 8.0);活性巯基含量测定:取1.5 mL 5 mg/mL不同NaCl浓度的蛋白样液悬浮于10.0 mL的Tris-甘氨酸缓冲液(0.086 mol/L Tris,0.09 mol/L甘氨酸,4 mmol/L EDTA,pH 8.0);将以上处理样品分别加50 μL Ellman试剂(4 mg 5,5’-二硫基双-2- 硝基苯甲酸(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)溶解于1 mL的Tris-甘氨酸缓冲液中),剧烈振荡后在(25±1)℃条件下水浴1 h,12 000×g离心10 min,同时以不加DTNB的为对照,取上清液在412 nm波长处测定吸光度,按公式(3)计算总巯基、活性巯基含量。

式中:73.53=106/1.36×104,1.36×104为摩尔消光系数/(L·cm/mol),ρ为样品的蛋白质量浓度/(mg/mL)。
1.3.6 乳化能力测定
按照Linder等[15]电导率法测定EC。取30 mL 5 mg/mL的不同肌原纤维蛋白溶液,加入10 mL的大豆油8 000×g匀浆1 min,用蠕动泵以12 mL/min的速率加入大豆油,同时匀浆,用电导率仪跟踪乳化体系电导率的变化,直至电导率出现第二突变点时停止加油,以此时的油量计算EC。
1.3.7 乳化稳定性的测定
乳化稳定性参考Cameron等[16]的浊度法,稍加改动。取5 mg/mL蛋白样液28 mL,加入7 mL大豆油,8 000×g匀浆制成乳状液。迅速从新制的乳状液底部移取30 μL,用0.1%的SDS溶液稀释500 倍,以0.1%的SDS溶液为空白,立即测定其在500 nm波长处的吸光度A0,将乳状液静置5 min后,用相同的方法测定吸光度A5。乳化稳定性按公式(4)计算。

式中:ES为乳化稳定性; A= A0-A5,表示乳状液初始的吸光度与静置5 min后的吸光度差。
1.4 统计学分析
对采集的实验数据采用SAS 9.2统计软件进行相关性分析和方差分析。方差分析结果为±s,如果方差分析差异显著(P<0.05),则使用Duncan’s Multiple Range Test进行多重比较。
2 结果与分析
2.1 离子强度对猪肉肌原纤维蛋白乳化特性的影响
2.1.1 乳化能力

图1 离子强度对肌原纤维蛋白乳化能力的影响Fig.1 Effect of ionic strength on EC of MP
由图1可知,随着NaCl浓度的增加,乳化能力呈逐渐上升的趋势。0.1、0.2 mol/L NaCl实验组,其肌原纤维蛋白的EC值在660 mL/g左右,两者之间差异不显著(P>0.05),说明离子强度虽有上升,但仍然很低,此时盐离子浓度的增加并不能够改善肌原纤维蛋白的乳化能力;0.3 mol/L NaCl实验组EC值为882 mL/g,显著高于0.1、0.2 mol/L NaCl实验组(P<0.05),而0.4、0.5、0.6 mol/LNaCl实验组的肌原纤维蛋白的EC值都在950 mL/g以上,且三者之间无显著差异(P>0.05),但显著高于0.1、0.2、0.3 mol/L NaCl实验组,0.6 mol/L NaCl实验组EC达到最大值,说明在此NaCl浓度下肌原纤维蛋白能乳化的油量最多。
2.1.2 乳化稳定性

图2 离子强度对肌原纤维蛋白乳化稳定性的影响Fig.2 Effect of ionic strength on ES of MP
由图2可知,随着NaCl浓度的增加,肌原纤维蛋白的乳化稳定性逐渐增大。浓度为0.1、0.2 mol/L N a C l实验组的E S值最差,两者之间无显著差异(P>0.05);0.3 mol/L NaCl实验组显著高于0.1、0.2 mol/L NaCl实验组;0.4、0.5 mol/LNaCl实验组之间差异不显著(P>0.05),但显著高于0.1、0.2、0.3 mol/L NaCl实验组(P<0.05);当NaCl浓度到达0.6 mol/L时,肌原纤维蛋白乳化稳定性显著高于其他任何实验组,达到最大。
2.2 离子强度对猪肉肌原纤维蛋白理化特性的影响
2.2.1 离子强度对猪肉肌原纤维蛋白溶解度的影响
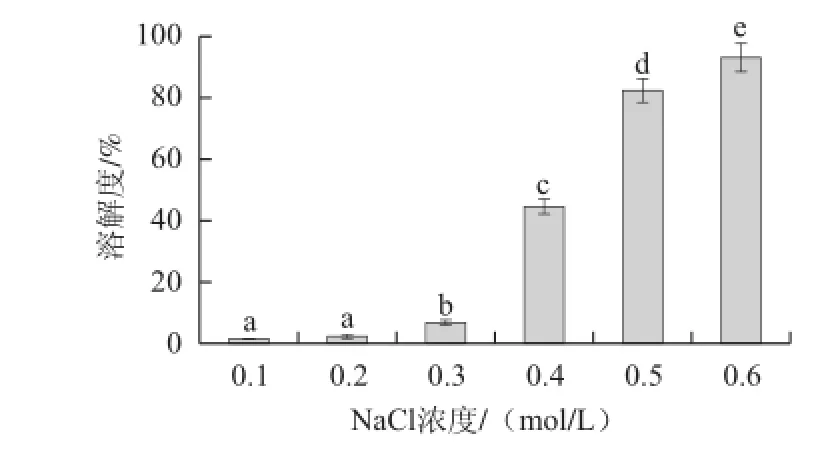
图3 离子强度对肌原纤维蛋白溶解度的影响Fig.3 Effect of ionic strength on solubility of MP
由图3可知,肌原纤维蛋白溶解度随着NaCl浓度的上升而呈增大趋势。NaCl浓度为0.1、0.2 mol/L时,肌原纤维蛋白溶解度最差,两者之间虽有差异但不显著(P>0.05),均显著低于0.3、0.4、0.5、0.6 mol/L实验组(P<0.05),以0.6 mol/L实验组的肌原纤维蛋白溶解度为最大。
2.2.2 离子强度对猪肉肌原纤维蛋白相互作用力的影响
2.2.2.1 氢键
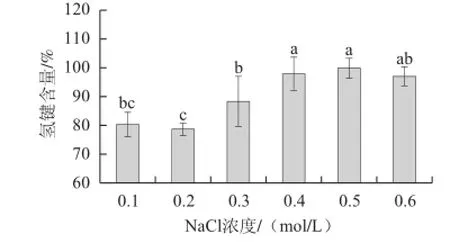
图4 离子强度对肌原纤维蛋白氢键含量的影响Fig.4 Effect of ionic strength on hydrogen bonds of MP
由图4可知,不同NaCl浓度条件下,肌原纤维蛋白的氢键含量大体呈先减少后缓慢增加的趋势。0.1、0.2 mol/L实验组间以及0.4、0.5、0.6 mol/L实验组间肌原纤维蛋白分子间的氢键含量虽有差异,但不显著(P>0.05),而0.2~0.4 mol/L实验组间氢键含量呈上升态势,且有显著差异(P<0.05)。
2.2.2.2 表面疏水性

图5 离子强度对肌原纤维蛋白表面疏水性的影响Fig.5 Effect of ionic strength on surface hydrophobicity of MP
由图5可知,随着NaCl浓度的增大,肌原纤维蛋白的表面疏水基含量逐渐减小,0.1、0.2 mol/L实验组间以及0.4~0.6 mol/L实验组间肌原纤维蛋白之间的表面疏水基含量虽有差异,但不显著(P>0.05),0.2~0.4 mol/L实验组间则呈下降态势,且有显著差异(P<0.05)。
2.2.2.3 活性巯基和总巯基

图6 离子强度对肌原纤维蛋白活性巯基和总巯基含量的影响Fig.6 Effect of ionic strength on active thiol content of MP
由图6可知,蛋白质分子的活性巯基含量随着NaCl浓度的增大呈逐渐上升趋势,但当NaCl浓度增大到一定程度,活性巯基含量的变化不是特别明显,0.5、0.6 mol/L实验组之间差异不显著(P>0.05),而总巯基含量随离子强度的增加没有明显变化,说明离子强度的改变对总巯基没有产生影响。
2.3 乳化特性指标与理化特性指标之间的相关性分析
由表1可知,NaCl浓度与测定的各指标间即EC、ES值、氢键均呈显著正相关(P<0.05),与溶解度、活性巯基含量呈极显著正相关(P<0.01),与表面疏水性呈极显著负相关(P<0.01)。溶解度与EC值显著正相关(P<0.05),与ES值呈极显著正相关(P<0.01),说明随着肌原纤维蛋白溶解度的增大,肌原纤维蛋白的EC、ES值提高;活性巯基和氢键含量都与EC值呈极显著正相关(P<0.01),而表面疏水性与EC值呈极显著负相关(P<0.01),与ES值显著负相关(P<0.05),说明肌原纤维蛋白的活性巯基和氢键越多,表面疏水性越小,肌原纤维蛋白的EC值以及ES值越大。由此可见,改变肌原纤维蛋白介质的离子强度,导致蛋白质的溶解度及蛋白质分子间的作用力产生变化,对肌原纤维蛋白的乳化特性有显著或极显著的影响。
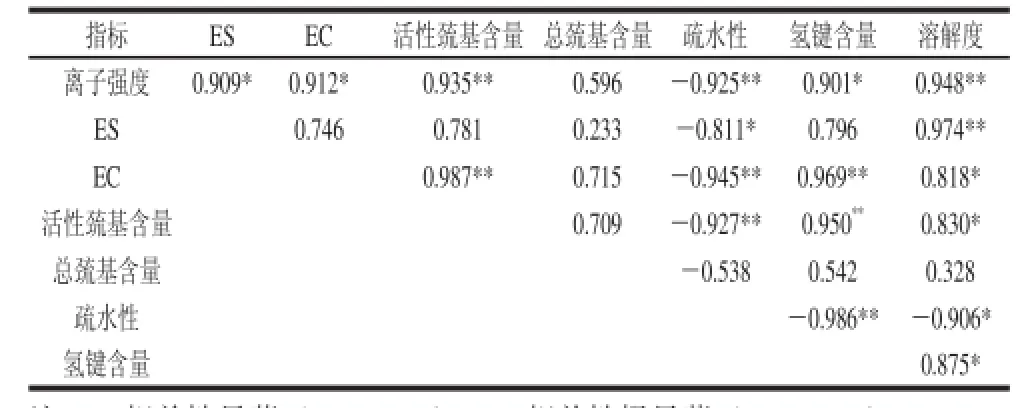
表1 不同NaCl浓度下肌原纤维蛋白乳化特性与理化指标之间的相关性分析Table1 Correlation analyses between emulsifying and physico-chemical properties of MP
3 讨 论
蛋白质的乳化主要表现为在油滴周围形成界面蛋白膜,其形成过程包括3 个步骤:第一步,蛋白向脂肪球表面靠拢,影响这一步的因素主要是蛋白分子的溶解情况、分子大小、温度条件以及连续相的黏度情况。第二步,蛋白吸附在脂肪球上,一般蛋白需要克服界面张力等障碍,和已经吸附在脂肪球上的物质竞争并使自己吸附上去,这个过程受表面氨基酸性质、pH值、离子强度和温度的影响。第三步,蛋白分子必须经过构象的变化[2]。
乳化能力和乳化稳定性是评价蛋白质乳化特性的常用指标。乳化能力表示单位质量的肌原纤维蛋白能够乳化的油的体积,EC值越大,说明对应NaCl浓度的肌原纤维蛋白在单位质量内乳化的油量就越多[17];而乳化稳定性是指蛋白质维持乳浊液油水两相混合不分离时对外界条件的抗应变能力[18],是评价蛋白质维持乳化体系油水界面能力的重要指标;蛋白质的溶解度是蛋白质之间、蛋白质与溶剂之间的相互作用平衡的一种热力学表现形式[2]。当介质的离子强度达到一定程度时,肌原纤维蛋白才会溶解[19],而可溶性蛋白质对脂肪乳化具有重要作用[20]。本实验发现随着介质离子强度的提高,肌原纤维蛋白的EC和ES值增强,这是因为随着离子强度的增大,盐和蛋白质的相互作用增强,蛋白质的水化作用增大,溶解度大大上升,使得蛋白更容易向脂肪球表面靠拢,相关性分析结果也证实了这点。相关性分析表明,溶解度与离子强度极显著正相关(r=0.948,P<0.01),与EC值显著正相关(r=0.818,P<0.05),与ES值呈极显著正相关(r=0.974,P<0.01)。说明肌原纤维蛋白溶解度的增大,使得蛋白质能迅速移到油水界面形成界面膜参与乳化,进而提高EC值[21];反之当NaCl浓度较低时,肌原纤维蛋白的溶解度低,形成蛋白质聚合体,造成疏水链的封闭,导致EC值的下降[22];对ES值而言,低离子强度时,可移动离子的屏蔽作用降低蛋白质之间的静电排斥[23],高盐时增强了带静负电荷的肌球蛋白分子间的静电排斥作用[24],使得乳滴之间不易聚集和合并,因而ES随着离子强度的提高而呈增强趋势。
离子强度对肌原纤维蛋白的空间结构也有显著的影响。肌肉蛋白质中参与乳化的蛋白质主要为肌球蛋白[25],其分子尾部的α-螺旋结构是依靠多肽链中—CO与—NH之间的氢键稳定的[26],氢键的稳定性一旦发生变化,就会导致α-螺旋结构的丢失和破坏。本实验结果表明随着NaCl浓度的提升,肌原纤维蛋白氢键有上升趋势,说明随着离子强度的上升,肌球蛋白/肌原纤维蛋白的稳定性越好,该结果与文献[27]结果一致。相关性分析表明,氢键与离子强度显著正相关(r=0.901,P<0.05),与肌原纤维蛋白的EC值极显著正相关(r=0.969,P<0.01);蛋白质疏水基团间的相互作用是一种非共价键的相互作用,是维持蛋白质三级结构最重要的作用力[28],构成蛋白质的大多数非极性氨基酸的侧链分布在蛋白质分子内部,形成疏水内核,通过对一些已知结构的蛋白质表面性质的分析表明,一些疏水基团也会出现在蛋白质分子的表面,使其表面也具有一定的疏水作用[29],而表面疏水作用会影响蛋白质分子间的相互作用,并且因蛋白质的大分子结构,对蛋白质功能的影响比整体疏水性更大[27]。本实验结果表明随着离子强度的上升,表面疏水性呈下降趋势。这是因为在高NaCl浓度时,蛋白质周围的亲水基团结合大量的水分子,使蛋白质的疏水基团部分包埋在蛋白质分子内部,蛋白质在天然状态下也是尽量把疏水残基包埋在分子内部[30],该结果与文献[27,31]报道相一致。相关性分析表明:表面疏水性与离子强度、溶解度呈极显著负相关(分别是r=-0.925,r=-0.906,P<0.01),与肌原纤维蛋白的EC值也极显著负相关(r =-0.945,P<0.01),与ES值呈显著负相关(r=-0.811,P<0.05),Nakai等[32]认为用疏水性和溶解度两指标来评价蛋白质的功能特性比单独用溶解度评价能得到更好的相关性,溶解性和表面疏水性都是影响蛋白乳化能力的重要因素,溶解能力相近的蛋白,才能表现出表面疏水性越高,其乳化能力越强;在肌原纤维蛋白中,巯基是最具反应活性的功能基团[33],是维持蛋白质三级结构的主要功能键,其含量的变化与蛋白质变性密切相关,若蛋白质发生变性(加热、超高压处理)时,巯基被氧化生成二硫键,致使巯基含量下降[34-35],因此可作为衡量蛋白质氧化和变性程度的指标,对肌原纤维蛋白的稳定及其功能性质具有重要的意义。本实验结果表明,随着NaCl浓度的提升,肌原纤维蛋白活性巯基含量有着上升趋势,而总巯基含量则无明显变化。这是因为当NaCl浓度升高时能破坏蛋白分子间的作用力,导致蛋白分子部分展开,使埋藏于天然蛋白分子内部的巯基暴露于分子表面,避免了因低浓度的NaCl导致的蛋白质聚集而引起蛋白质巯基含量的下降[36]。有研究表明活性巯基的增加可能与肌球蛋白分子头部结构改变有关[37-38],表现为展开的蛋白分子更易于在脂肪球周围形成界面膜,但是增加离子强度不能破坏或形成分子间或分子内二硫键,故总巯基含量无明显变化。相关性分析表明,活性巯基含量与离子强度呈极显著正相关(r=0.935,P<0.01),与肌原纤维蛋白的EC值也呈极显著正相关(r=0.987,P<0.01),而总巯基含量与离子强度、ES、EC值之间无显著相关性(P>0.05)。
本研究表明改变肌原纤维蛋白介质的离子强度,使得乳化特性和蛋白质的溶解度及蛋白质分子间的作用力等理化特性产生变化,表现为:低离子强度时,肌原纤维蛋白的EC和ES下降,溶解度降低,分子间氢键、活性巯基含量呈下降趋势,表面疏水性呈上升趋势,而总巯基含量则无明显变化,肌原纤维蛋白理化特性和乳化特性之间有显著或极显著的相关性。因此在生产低盐乳化型肉制品时,由于肌原纤维蛋白的乳化性能较差,必须采取相应措施(如钠盐替代、多糖替代等),以防止低盐导致的肉制品出水出油等质量缺陷的产生。
[1] ZORBA O, SUKRU K. Optimization of emulsion characteristies of beef, chicken and turkey meat mixtures in model system using mixture design[J]. Meat Science, 2006, 73(4): 611-618.
[2] 周光宏. 畜产品加工学[M]. 2版. 北京: 中国农业出版社, 2011: 47-50.
[3] 韩敏义. 肌原纤维蛋白结构与热诱导凝胶功能特性关系研究[D]. 南京: 南京农业大学, 2009.
[4] DAMODARAN S, PARKIN K L, FENNEMA O R. Fennema’s food chemistry[M]. 4th. Boca Raton, USA: CRC Press, 2007: 962-964.
[5] ZORBA O, GOKALP H, YETIM H, et al. Salt, phosphate and oil temperature effects on emulsion capacity of fresh or frozen meat and sheep tail fat[J]. Journal of Food Science, 1993, 58(3): 492-496.
[6] YAPAR A, ATAY S, KAYACIER A, et al. Effects of different levels of salt and phosphate on some emulsion attributes of the common carp (Cyprinus carpio L., 1758)[J]. Food Hydrocolloids, 2006, 20(6): 825-830.
[7] DICKINSON B D, HAVAS S. Reducing the population burden of cardiovascular disease by reducing sodium intake: a report of the Council on Science and Public Health[J]. Archives of Internal Medcine, 2007, 167(14): 1460-1468.
[8] FERNÁNDEZ-GINÉS J M, FERNÁNDEZ-LÓPEZ J, SAYASBARBERÁ E, et al. Meat products as functional foods: a review[J]. Journal of Food Science, 2005, 70(2): 37-43.
[9] 徐宝才, 孙建清, 周辉, 等. 原料肉组成对低温乳化香肠质构特性的影响及其配方优化[J]. 南京农业大学学报, 2011, 34(4): 111-116.
[10] MARTIN D, RUIZ J, LIVIKARI R, et al. Partial replacement of pork fat by conjugated linoleic acid and/or olive oil in liver pates: effect on physicochemical characteristics and oxidative stability[J]. Meat Science, 2008, 80(2): 496-504.
[11] GORNALL A G, BARDAWILL C J, DAVID M M. Determination of serum proteins by means of the biuret reaction[J]. Journal of Biological Chemistry, 1949, 177(2): 751-766.
[12] VISESSANGUAN W, BENJAKUL S, RIEBROY S, et al. Changes in composition and functional properties of proteins and their contributions to Nham characteristics[J]. Meat Science, 2004, 66(3): 579-588.
[13] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683.
[14] ELLMAN G L. Tissue sulphydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77.
[15] LINDER M, FANNI J, PARMENTIER M. Functional properties of veal bone hydrolysates[J]. Journal of Food Science, 1996, 61(4): 712-714.
[16] CAMERON D R, WEBER M E, IDZIAK E S, et al. Determination of interfacial areas in emulsions using turbidimetric and droplet size data: correction of the formula for emulsifying activity index[J]. Journal of Agricultural and Food Chemistry, 1991, 39(4): 655-659.
[17] SWIF C E, FRYAR A J, LOCKETT C. Comminuted meat emulsions: the capacity of meats for emulsifying fat[J]. Food Technology, 1961, 15(11): 468-473.
[18] 张根生, 岳晓霞, 李继光, 等. 大豆分离蛋白乳化性影响因素的研究[J]. 食品科学, 2006, 27(7): 48-51.
[19] XIONG Y L, BREKKE C J. Changes in protein solubility and gelation of chicken myofibrils during storage[J]. Journal of Food Science, 1989, 54(5): 1141-1146.
[20] WU Mangang, XIONG Youling, CHEN Jie, et al. Rheology and microstructure of myofibrillar protein-plant lipid composite gels: effect of emulsion droplet size and membrane type[J]. Journal of Food Engineering, 2011, 106(4): 318-324.
[21] OLAYIDE S L. Functionality of African locust bean (Parkia bigobossa) protein isolate: effects of pH, ionic strength and various protein concentrations[J]. Food Chemistry, 2003, 86(3): 345-355.
[22] PARKINGTON J K, XIONG Y L, BLANCHARD S P, et al. Chemical and functional properties of oxidatively modified beef heart surimi stored at 2℃[J]. Journal of Food Science, 2000, 65(3): 428-433.
[23] ZIEGLER G R, FOEGEDING E A, JOHN E K. The gelation of proteins[M]//Advances in Food and Nutrition Research, New York: Academic Press, 1990: 203-298.
[24] 齐晓辉. 肉蛋白在碎肉制品中的机能特性: 盐溶性蛋白的机能决定肉制品的最终特性[J]. 肉类研究, 1989, 3(2): 1-3.
[25] BARBUT S. Importance of fat emulsification and protein matrix characteristics in meat batter stability[J]. Journal of Muscle Foods, 1995, 6(2): 161-177.
[26] SANO T, OHNO T, OTSUKA-FUCHINO H, et al. Carp natural actomyosin: thermal denaturation mechanism[J]. Journal of Food Seience, 1994, 59(5): 1002-1008.
[27] 许艳顺. 发酵鲢鱼鱼糜凝胶形成与其机理研究[D]. 无锡: 江南大学, 2010.
[28] ANFINSEN C B, SCHERAGA H A. Experimental and theoretical aspects of protein folding[M]. New York: Academic Press, 1975, 29: 205-299.
[29] DAMODARAN S. Refolding of thermally unfoldedsoy proteins during the cooling regime of the gelation process: effect ongelatio[J]. Journal of Agricultural and Food Chemistry, 1988, 36(2): 262-269.
[30] 付湘晋, 许时婴, 王璋, 等. 酸碱处理对鲢鱼肌原纤维蛋白热变性、聚集、胶凝性质的影响[J]. 食品科学, 2008, 29(6): 100-103.
[31] 李艳青. 蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D]. 哈尔滨: 东北农业大学, 2013.
[32] NAKAI S. Structure-function relationships of food proteins with an emphasis on the importance of protein hydrophobicity[J]. Journal of Agricultural and Food Chemistry, 1983, 31(4): 676-683.
[33] 胡耀辉, 郑微微, 李琢伟, 等. 海藻糖对防止鲤鱼鱼糜蛋白质冷冻变性的研究[J]. 食品科学, 2011, 32(9): 126-129.
[34] 孙翠玲, 杨文鸽. 缢蛏在-40℃冻藏过程中的质量变化[J]. 水产科学, 2011, 30(3): 171-172.
[35] OMANA D A, PLASTOW G, BETTI M. The use of beta-glucan as a partial salt replacer in high pressure processed chicken breast meat[J]. Food Chemistry, 2011, 129(3): 768-776.
[36] 黄晓春, 候温甫, 杨文鸽, 等. 冻藏过程中美国红鱼生化特性的变化[J]. 食品科学, 2007, 28(1): 337-340.
[37] MOHAN M, RAMACHANDRAN D, SANKAR T V, et al. Influence of pH on the solubility and conformational characteristics of muscle proteins from mullet (Mugil cephalus)[J]. Process Biochemistry, 2007, 42(7): 1056-1062.
[38] KO W C, YU C C, HSU K C. Changes in conformation and sulfhydryl groups of tilapia actomyosin by thermal treatment[J]. Food Science and Technology, 2007, 40(8): 1316-1320.
Effect of Ionic Strength on Emulsifying and Physico-chemical Properties of Pork Myofibrillar Protein
WU Ju-qing1, SHAO Jun-hua2, WEI Chao-gui1, XU Xing-lian1, ZHOU Guang-hong1,*
(1. Key Laboratory of Meat Processing and Quality Control, Ministry of Education, Nanjing Agricultural University, Nanjing 210095, China; 2. Food Science Research Institute, Bohai University, Jinzhou 121013, China)
The objective of this study was to evaluate the effect of ionic strength on the emulsifying and physico-chemical properties of pork myofibrillar proteins (MP). MP was extracted and its emulsifying and physico-chemical properties including emulsifying capacity (EC), emulsion stability (ES), solubility and intermolecular hydrogen bonds, surface hydrophobicity, and active and total sulfydryl groups under different ionic strengths were measured correlated with each other. The results showed that EC, ES and solubility increased with increasing ionic strength. Meanwhile, the contents of active sulfhydryl group and intermolecular hydrogen bonds tended to increase, whereas the surface hydrophobicity decreased. Total sulfhydryl groups did not exhibit any change. The solubility was positively correlated with either EC (P < 0.05) or ES (P < 0.01), and active sulfydryl groups were positively correlated with EC (P < 0.01). On the other hand, the surface hydrophobicity was negatively correlated with either EC (P < 0.01) or ES (P < 0.05). Therefore, ionic strength can affect the emulsifying and physico-chemical properties of MP, with a significant or extremely significant correlation observed between these two properties.
myofibrillar protein; emulsification; ionic strength; solubility
TS251.1
A
1002-6630(2014)23-0014-06
10.7506/spkx1002-6630-201423003
2014-07-22
国家自然科学基金面上项目(31371795);“十二五”国家科技支撑计划项目(2012BAD28B01-04;2012BAD28B03-1)
吴菊清(1965—),女,副教授,博士研究生,研究方向为肉品加工与质量安全控制。E-mail:wujuqing@njau.edu.cn
*通信作者:周光宏(1960—),男,教授,博士,研究方向为畜产品加工与质量控制。E-mail:ghzhou@njau.edu.cn
