甜杏仁和苦杏仁野黑樱苷水解酶基因的克隆
2014-02-08白羽嘉陶永霞冯作山
白羽嘉,王 敏,陶永霞,徐 乐,冯作山,*
(1.新疆农业大学林学与园艺学院,新疆 乌鲁木齐 830052;2.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;3.新疆农业科学院轮台果树资源圃,新疆 轮台 841600)
甜杏仁和苦杏仁野黑樱苷水解酶基因的克隆
白羽嘉1,2,王 敏2,陶永霞2,徐 乐3,冯作山1,2,*
(1.新疆农业大学林学与园艺学院,新疆 乌鲁木齐 830052;2.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;3.新疆农业科学院轮台果树资源圃,新疆 轮台 841600)
以轮台小白杏(甜杏仁品种)和甲麦黄杏(苦杏仁品种)为实验材料,采用同源基因克隆方法克隆野黑樱苷水解酶(prunasin hydrolase,PH)基因。轮台小白杏PH基因命名为PaLTPh(GenBank登录号:KF888615),序列长度3 686 bp;甲麦黄杏PH基因命名为PaMJPh(KF888616),序列长度3 690 bp。PaLTPh和PaMJPh与扁桃Ph691基因相似性为94%。根据PaLTPh和PaMJPh保守区序列设计引物,克隆编码区(coding sequence,CDS)序列。PaLTPh CDS(KF888617)和PaMJPh CDS(KF888618)序列长度均为1 635 bp,与扁桃Ph691全CDS区相似性为97%。PaLTPh CDS和PaMJPh CDS序列均为全长的开放阅读框,编码蛋白质长度为544 个氨基酸。PaLTPH蛋白和PaMJPH蛋白均包含长度为26 个氨基酸的信号肽和糖基水解酶家族Ⅰ结构域,可催化野黑樱苷水解为扁桃腈和葡萄糖。杏PH基因与扁桃Ph691具有高度的同源性。
轮台小白杏;甲麦黄杏;野黑樱苷;野黑樱苷水解酶;基因克隆
杏仁营养丰富,富含蛋白质、不饱和脂肪酸、维生素和矿物质[1],通常被加工成杏仁油、杏仁露、盐焗杏仁等食品[2-3]。杏仁根据苦杏仁苷含量的多少分为甜杏仁和苦杏仁,甜杏仁中苦杏仁苷<0.1%,而苦杏仁中苦杏仁苷含有在2%~4%[4-5]。研究发现苦杏仁苷具有一定的药理保健活性,具有镇咳、平喘、抗炎、镇痛、驱虫杀菌等功效[6]。但过量摄入苦杏仁或苦杏仁苷,则会引起食物中毒,因此苦杏仁的安全性问题受到广泛的关注[7-9]。
苦杏仁苷存在于蔷薇科植物杏、山杏、桃、山桃及李的种子中[10]。苦杏仁苷(amygdalin)是一种生氰二糖苷,结构式为苯羟基乙氰-β-D-葡萄糖-6-β-D-葡萄糖苷。相关研究发现(图1),苦杏仁腈(mandelonitrile)在二磷酸尿苷葡萄糖苷转移酶GT1(UDP-glucuronide transferases,GT)作用下合成野黑樱苷,野黑樱苷在GT2的催化下合成苦杏仁苷[11];野黑樱苷作为苦杏仁苷的合成前体,能够被野黑樱苷水解酶(prunasin hydrolases,PH)水解生成扁桃腈和葡萄糖[12-13]。植物在生长发育过程中野黑樱苷水解酶(EC 3.2.1.21)参与了苦杏仁苷及野黑樱苷的降解代谢,野黑樱苷水解酶调控野黑樱苷的浓度,进而影响苦杏仁苷的生物合成[14-15]。相关研究鉴定出2 个在甜扁桃和苦扁桃中差异的PH基因(Ph691和Ph692),对果实发育过程中外皮、珠心、胚乳和胚中PHs进行组织和细胞化学定位,发现PH蛋白在种仁不同发育时期的质外体和共质体之间产生移动[16]。

图1 苦杏仁腈、野黑樱苷和苦杏仁苷的代谢途径Fig.1 Metabolic pathways of mandelonitrile, prunasin andamygdalin
新疆杏果树资源丰富,南疆环塔里木盆地周围有大面积的栽培,是新疆最具特色的果树品种之一[17]。杏果实除鲜食外,杏仁还是重要的木本粮油资源,杏仁粕含有大量的蛋白质可以被开发利用[18]。新疆杏品种丰富多样,但存在大量的苦杏仁品种,不利于食品加工和资源的综合利用。目前苦杏仁苷的研究主要集中在提取纯化[19]、分析检测[20-21]、安全控制及生物活性等方面[22-23],对苦杏仁苷形成相关基因的报道并不多见。本研究以轮台小白杏(甜杏仁品种)和甲麦黄杏(苦杏仁品种)为实验材料,克隆野黑樱苷水解酶基因,对编码蛋白质进行预测分析,有助于了解杏仁中苦杏仁苷的合成与降解途径,为食品原料的生物检测、遗传育种和栽培种植提供研究基础。
1 材料与方法
1.1 材料与试剂
轮台小白杏果实(Prunus armeniaca L. cultivar LunTai Xiaobaixing,简称LT)、甲麦黄杏果实(Prunus armeniaca L. cultivar Jiamaihuangxing,简称MJ),于2013年6月1日采集自新疆农业科学院轮台果树资源圃(国家果树种质资源轮台果树资源圃)。
植物DNA提取试剂盒(SK1203)、柱式植物总RNA抽提纯化试剂盒、M-MuLV First Strand cDNA Synthesis Kit M-MuLV第一链cDNA合成试剂盒(BS249)、AMV First Strand cDNA Synthesis Kit第一链cDNA合成试剂盒、LA TaqDNA聚合酶、UNIQ-10柱式DNA胶回收试剂盒(SK1131)、T-载体pcr产物克隆试剂盒(SK2211)、感受态细胞DH5α、一步法制备感受态细胞溶液(SK2301)、DNA Marker、6×DNA Loading Dye、溴化乙锭 生工生物工程(上海)股份有限公司;ABI SybrGreen PCR Master Mix(2×) 美国ABI公司;琼脂糖 西班牙Biowest公司、三羟甲基氨基甲烷、冰乙酸、盐酸、EDTA-Na2均为分析纯 国药集团药业股份有限公司。
1.2 仪器与设备
LDZX-50KBS高温灭菌锅 上海申安医疗器械公司;JH-SCA净化工作台 上海鸿都电子科技有限公司;Biofuge Primo R高速冷冻离心机 美国赛默飞世尔科技公司;T-100梯度PCR仪、PowerPac Universal电泳仪、Sub Cell GT水平电泳槽 美国伯乐公司;Gene Genius Bio Image凝胶成像系统 英国SynGene公司;U-3010紫外-可见分光光度计 日本Hitachi公司;ABI Stepone plus型荧光定量PCR仪 美国ABI公司。
1.3 方法
1.3.1 野黑樱苷水解酶基因扩增引物设计
参考甜仁扁桃野黑樱苷水解酶基因序列(JQ268617.1、JQ268619.1、JQ268621.1、JQ268623.1)和苦仁扁桃野黑樱苷水解酶基因序列(JQ268618.1、JQ268620.1、JQ268622.1、JQ268624.1),设计野黑樱苷水解酶基因扩增引物(表1)。引物设计扩增片段之间存在大于200 bp碱基的重叠,以保证DNA拼接的准确性。

表1 野黑樱苷水解酶基因PCR扩增引物Table1 Primer sequences for PCR amplification of PH gene
1.3.2 野黑樱苷水解酶基因的克隆
取新鲜杏种仁液氮研磨,按植物D N A提取试剂盒说明书提取基因组DNA。聚合酶链式反应(polymerase chain reaction,PCR)反应体系总体积25 μL,包括:基因组DNA模板1 μL,上下游引物(10 μmol/L)各0.5 μL,dNTP (10 mmol/L) 0.2 μL,2×GC BufferⅠ 12.5 μL,ddH2O 10.1 μL,LA TaqDNA聚合酶(5 U/μL)0.2 μL。PCR反应条件为:95 ℃ 3 min;94℃ 30 s,Tm30 s,72 ℃ 90 s,33 个循环;72 ℃7 min。PCR产物经1.5%琼脂糖凝胶电泳检测。
PCR产物电泳后采用试剂盒回收纯化DNA。连接到pMD18-T载体,连接反应体系10.0 μL(包括SolutionⅠ 4 μL,PCR产物5 μL,pMD18-T 0.2 μL,H2O 0.8 μL),16 ℃连接过夜。转化感受态细胞,倒置培养过夜。挑取阳性菌落,委托生工生物工程(上海)股份有限公司进行测序。
1.3.3 杏野黑樱苷水解酶cDNA序列的克隆
取新鲜杏种仁液氮研磨,按柱式植物总RNA抽提纯化试剂盒方法提取总RNA。cDNA第一链合成按试剂盒说明书进行。PCR扩增体系及克隆测序同1.3.1节。
1.3.4 生物信息分析
序列拼接:克隆测序采用双向测序获得DNA片段序列,采用DNAMAN软件对序列进行拼接。
核酸生物信息分析:引物设计使用软件Primer Premier 5.0,序列拼接及比对分析使用DNAMAN v7.0软件,序列检索通过在线NCBI进行,进化树构建使用MEAG 5.05软件。
蛋白生物信息分析:ORF分析使用ORF Finder在线分析,蛋白质结构预测使用SMART(simple modular architecture research tool)在线分析[24],蛋白质结构域使用Pfam 27.0(March 2013,14831 families)进行在线分析[25],信号肽的预测分析使用SignalP 4.1 Server在线进行。
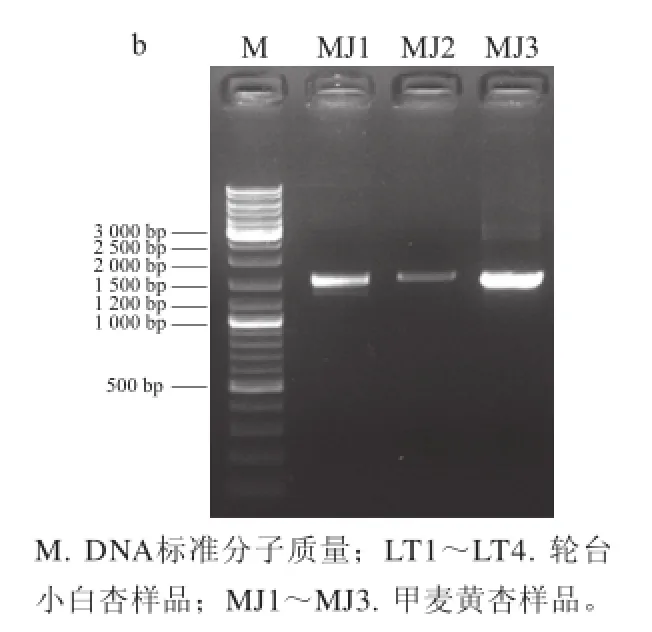
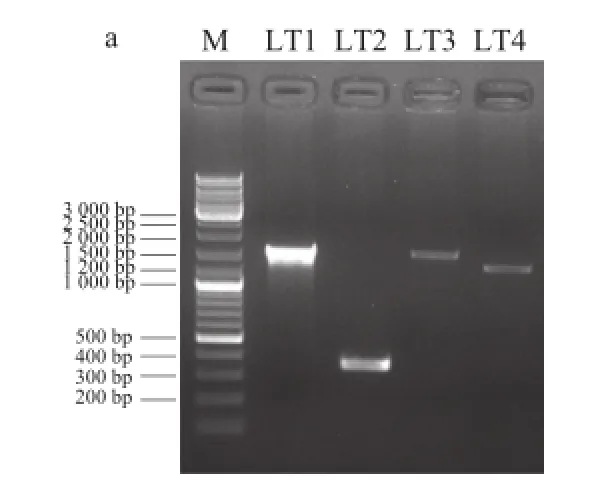
图2 2 PaLTPhaLTPh和PaMJPhaMJPh PCR扩增结果Fig.2 PCR results for PaLTPh and PaMJPh

表2 PaLTPh和PaMJPh在NCBI中的检索结果Table2 Retrieval results for PaLTPh and PaMJPh in NCBI database
2 结果与分析
2.1 野黑樱苷水解酶基因的克隆
轮台小白杏基因组4 对引物(LT1~LT4)分别扩增出1 200、1 500、350、1 500 bp的DNA片段,克隆测序后拼接获得长度为3 686 bp的DNA序列;甲麦黄杏基因组3 对引物均扩增出1 500 bp大小的DNA片段,克隆测序后拼接获得长度为3 690 bp的DNA序列(图2)。
BLASTn鉴定核酸序列为野黑樱苷水解酶基因(表2)。轮台小白杏野黑樱苷水解酶基因PaLTPh(Pruns armeniana LT prunasin hydrolase,PaLTPh)与扁桃Ph691基因(JQ268617.1、JQ268618.1)相似性为94%,与扁桃Ph692基因(JQ268619.1、JQ268620.1)相似性为83%;甲麦黄杏野黑樱苷水解酶基因PaMJPh(Pruns armeniana MJ prunasin hydrolase,PaMJPh)与扁桃Ph691基因(JQ268617.1、JQ268618.1)相似性为94%,与扁桃Ph692基因(JQ268619.1、JQ268620.1)相似性为分别为87%和83%。
2.2 轮台小白杏与甲麦黄杏野黑樱苷水解酶CDS序列的克隆
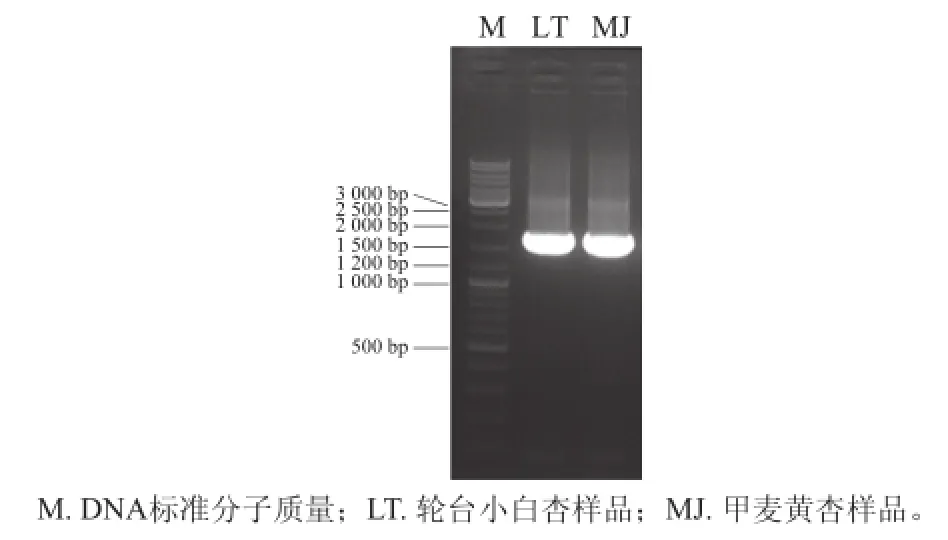
图3 野黑樱苷水解酶cDNA PCR扩增结果Fig.3 PCR amplification results for PH cDNA
根据野黑樱苷水解酶基因序列的保守型设计引物PaPH CDS,以杏种仁cDNA为模板,克隆全CDS区序列。轮台小白杏和甲麦黄杏cDNA均扩增出1 600 bp左右的DNA片段,克隆测序后获得轮台小白杏PaLTPh CDS序列和甲麦黄杏PaMJPh CDS序列(图3)。PaLTPh CDS和PaMJPh CDS序列长度均为1 635 bp,BLASTn检索鉴定与扁桃Ph691完整CDS序列(JQ268622.1、JQ268621.1)相似性为97%。
根据PaLTPh CDS和PaMJPh CDS序列BLASTn搜索同源性较高的核酸序列,包括:扁桃(Prunus dulcis)、美国黑樱(Prunus serotina)、甜樱桃(Prunus avium)、苹果(Malus×domestica)、草莓(Fragaria)等物种的Phs。采用邻接(Neghbor-Joining)方法构建上述物种的核苷酸序系统进化树(图4),不同物种的野黑樱苷水解酶基因可分为4 类,扁桃Ph691和杏聚为一类,美国黑樱和甜樱桃聚为一类,苹果和草莓单独各聚为一类。但扁桃Ph692较为特殊,进化分析中扁桃Ph692并没有与扁桃Ph691和杏聚为一类,而是进化为美国黑樱中的一个独立分支。

图4 野黑樱苷水解酶CDS区核苷酸序列的系统进化树Fig.4 Phylogenetic tree based on CDS nucleotide sequences of PH genes from different species
PaLTPh CDS和PaMJPh CDS存在碱基差异(图5),主要表现为转换(A-G/C-G)和颠换(A-C/G-T),未出现碱基缺失和插入。参考扁桃Ph691和Ph692序列进一步比对,发现杏Ph基因CDS与扁桃Ph691 CDS(JQ268621.1、JQ268622.1)核苷酸的差异表现为转换和颠换,与扁桃Ph692 CDS(JQ268623.1、JQ268624.1)核苷酸的差异则出现了碱基的插入(序列位置:1 084~1 086、1 103~1 108、1 638~1 643)和缺失(序列位置:80~82、1 302~1 307)。碱基的插入和缺失会导致该基因所翻译的蛋白质产生较大的差异。

图5 杏野黑樱苷水解酶CDS与扁桃黑樱苷水解酶CDS序列比对Fig.5 Sequence alignment of different Phs from PaLTPh CDS and PaMJPh CDS with Prunns dulics Phs
2.3 杏野黑樱苷水解酶预测蛋白及分析

图6 PaLTPh CDS的ORF分析Fig.6 Analysis of open reading frame (ORF) of PaLTPh CDS
使用NCBI中ORF Finder 软件对序列分析(图6、7),PaLTPh CDS序列和PaMJPh CDS序列包含起始密码子和终止密码子,为全长的开放阅读框(open reading frame,ORF),编码蛋白质长度为544 个氨基酸,两者相似性为97.06%。

图7 PaMJPh CDS的ORF分析Fig.7 Analysis of open reading frame (ORF) of PaMJPh CDS

图8 野黑樱苷水解酶蛋白结构分析Fig.8 Analysis of prunasin hydrolase protein structure
使用Pfam 27.0对编码蛋白序列进行分析(图8),PaLTPH和PaMJPH均包含一个长度为26 个氨基酸(氨基酸残基1~26)的信号肽及糖基水解酶家族Ⅰ(Pfam:Glyco_hydro_1)结构域。
在线SignalP 4.1 Server对蛋白序列信号肽进行预测分析(图9、10),PaLTPH和PaMJPH在1~26aa序列S值较高,预测该氨基酸序列为信号肽。PaLTPH信号肽序列为MALQFRSLLLCVVLLLLGFSLANTNA,PaMJPH信号肽序列为MALQFRSLLLCVVLFLLGFALANTNA,比较发现第13个氨基酸残基(由Ile变成Phe)和第19个氨基酸残基(由Ser变成Ala)存在差异。参考比对扁桃PH691蛋白(AFH35014.1、AFH35015.1)信号肽发现,4 个蛋白的信号肽在11、13和19氨基酸残基存在差异。对比CDS序列分析,发现这种差异是由于核苷酸碱基33、42、44、57、59发生改变引起的。
信号肽在蛋白质的合成和转运过程中有重要的作用。编码分泌蛋白的mRNA在翻译时首先合成的是N末端带有疏水氨基酸残基的信号肽,它被内质网膜上的受体识别并与之相结合;信号肽经由膜中蛋白质形成的孔道到达内质网内腔,随即被位于腔表面的信号肽酶水解,由于它的 引导,新生的多肽就能够通过内质网膜进入腔内,最终被分泌到胞外;翻译结束后,核糖体亚基解聚、孔道消失,内质网膜又恢复原先的脂双层结构[26-28]。杏种仁和扁桃种仁中野黑樱苷水解酶含有信号肽,相似性为96.15%,野黑樱苷水解酶最终分泌到胞外,参与野黑樱苷的代谢。野黑樱苷水解酶属O-糖基水解酶,O-糖基水解酶是一个广泛的水解酶家族,能水解2 个(或2 个以上)糖形成的糖苷键,或水解糖与非糖基团所形成的化学键,生成单糖及非糖组分[29]。对PaLTPH和PaMJPH的Glyco_hydro_1结构域进行分析(表3),PaLTPH、PaMJPH 与AFH35014.1、AFH35015.1同属于Glycosyl hydrolase family 1蛋白家族,HMM的长度为455 个氨基酸,预测活性位点为210和426。杏与扁桃野黑樱苷水解酶蛋白具有高度相似的结构域及活性位点,推测杏种仁与扁桃种仁中野黑樱苷水解在苦杏仁苷的合成与代谢调控中起到相似的作用。

图9 PaLTPH信号肽预测分析Fig.9 Predictive analysis of PaLTPH signal peptide
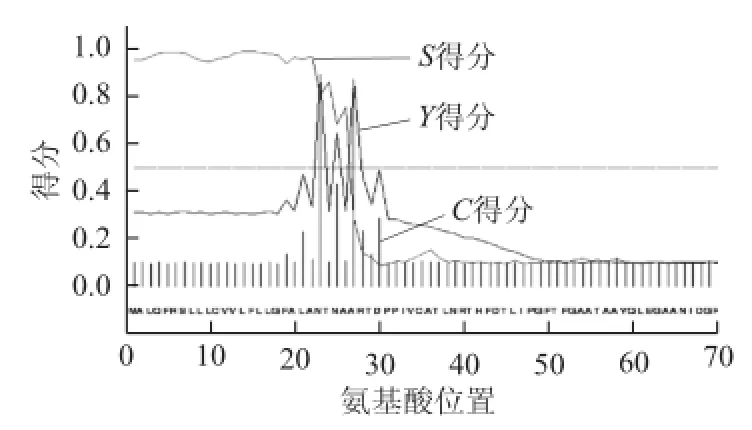
图 10 PaMJPH信号肽预测分析Fig.10 Predictive analysis of PaMJPH signal peptide

表3 野黑樱苷水解酶Glyco_hydro_1结构域分析Table3 Analysis of prunasin hydrolase Glyco_hydro_1 domain
3 结论与讨论
采用同源基因克隆的方法从轮台小白杏中克隆获得PaLTPh,序列长度3 686 bp;从甲麦黄杏中克隆获得PaMJPh,序列长度3 690 bp。PaLTPh和PaMJPh与扁桃Ph691基因相似性为94%,具有高度的同源性。
利用PaLTPh和PaMJPh序列的设计引物,以杏种仁cDNA为模板,克隆CDS区序列。PaLTPh CDS和PaMJPh CDS序列长度均为1 635 bp,与扁桃Ph691全CDS区(JQ268622.1、JQ268621.1)相似性为97%。
PaLTPh CDS和PaMJPh CDS序列均包含起始密码子和终止密码子,为全长的开放阅读框ORF,编码蛋白质长度为544 个氨基酸。PaLTPH蛋白和PaMJPH蛋白均包含长度为26 个氨基酸的信号肽和糖基水解酶家族Ⅰ(Pfam:Glyco_hydro_1)结构域,可催化野黑樱苷水解为扁桃腈和葡萄糖。
扁桃和杏同属蔷薇科核果类果树,其苦仁中所含的苦味物质都是苦杏仁苷。研究利用扁桃野黑樱苷水解酶基因,进行同源克隆,获得杏仁中野黑樱苷水解酶基因(PaLTPh、PaMJPh),其基因序列与扁桃Ph691基因(JQ268617.1、JQ268618.1)相似性更高,蛋白预测分析显示其相似性为98.67%,同属于Glyco_hydro_1家族。野黑樱苷水解酶作为苦杏仁苷合成关键基因,已从美洲黑樱(Prunus serotina)[30-32],甜樱桃(Prunus avium)[33-34]及扁桃(Prunus dulcis)中克隆到相关的基因,随着桃(Prunus persica)基因组测序与组装的完成,也预测出野黑樱苷水解酶相关基因[35-37]。从杏种仁中克隆野黑樱苷水解酶基因,丰富了其基因的多样性,对杏仁种在发育过程中Ph基因的表达情况、细胞化学定位还有待深入研究。
[1] 王淑英, 温哲屹, 李慧颖. 我国甜杏仁营养成分含量分析[J]. 北京农业, 2008(9): 13-16.
[2] 杨海燕, 于蒙, 刘姗姗, 等. 冷冻干燥法制备甜杏仁油微胶囊[J]. 食品科学, 2012, 33(18): 36-40.
[3] 宋曰钦, 王建中, 赵云霞, 等. 苦杏仁蛋白开发利用的前景[J]. 中国农学通报, 2006, 22(1): 68-70.
[4] 马雪松, 陈缤. 苦杏仁及其炮制品中苦杏仁苷含量测定[J]. 辽宁中医杂志, 2006, 33(3): 355.
[5] 张玲, 翟明普, 景淼. 甜杏仁中苦杏仁苷质量分数的HPLC定量分析[J].果树学报, 2009, 26(1): 199-204.
[6] 杨晓宇, 陈锦屏. 杏仁的营养保健功能及其在食品工业中的应用[J].食品科学, 2005, 26(9): 629-631.
[7] CODEX STAN 176—1989 Codex Standard for Edible Cassava Flour[S]. 1995.
[8] BURNS A E, BRADBURY J H, CAVAGNARO T R, et al. Total cyanide content of cassava food products in Australia[J]. Journal of Food Composition and Analysis, 2012, 25: 79-82.
[9] MOERTEL C G, AMES M M, KOVACH J S, et al. A pharmacologic and toxicological study of amygdalin[J]. Journal of the American Medical Association, 1981, 245(6): 591-594.
[10] VETTER J. Plant cyanogenic glycosides[J]. Toxicon, 2000, 38(1): 11-36.
[11] SUELVES M, PUIGDOMENECH P. Molecular cloning of the cDNA coding for the (R)-(+)-mandelonitrile lyase of Prunus amygdalus: temporal and spatial expression patterns in flowers and mature seeds[J]. Planta, 1998, 206(3): 388-393.
[12] SANCHEZ-PEREZ R, JØRGENSEN K, OLSEN C E, et al. Bitterness in almonds[J]. Plant Physiology, 2008, 146(3): 1040-1052.
[13] ZHENG L, POULTON J E. Temporal and spatial expression of amygdalin hydrolase and (R)-(+)-mandelonitrile lyase in black cherry seeds[J]. Plant Physiology, 1995, 109(1): 31-39.
[14] SWAIN E, LI C P, POULTON J E. Tissue and subcellular localization of enzymes catabolizing (R)-amygdalin in mature Prunus serotina seeds[J]. Plant Physiology, 1992, 100(1): 291-300.
[15] SWAIN E, POULTON J E. Immunocytochemical localization of prunasin hydrolase and mandelonitrile lyase in stems and leaves of Prunus serotina[J]. Plant Physiology, 1994, 106(4): 1285-1291.
[16] SÁNCHEZ-PÉREZ R, BELMONTE F S, BORCH J, et al. Prunasin hydrolases during fruit development in sweet and bitter almonds[J]. Plant Physiology, 2012, 158(4): 1916-1932.
[17] 樊丁宇, 廖康, 杨波. 新疆杏品种果实鲜食品质主要评价指标的选择[J]. 中国农学通报, 2009, 25(22): 207-211.
[18] 程卫东, 吕国华, 李琳, 等. 新疆小白杏资源的综合利用及其产业化[J].农业工程学报, 2006, 22(9): 241-244.
[19] 张红城, 尹策, 董捷, 等. 杏花花粉中苦杏仁苷的提取工艺的研究[J].食品科学, 2007, 28(7): 236-241.
[20] 李海龙, 王静, 张英春, 等. HPLC-ELSD法测定苦杏仁中苦杏仁苷的含量[J]. 食品与发酵工业, 2007, 33(1): 109-112.
[21] CHO A Y, YI K S, RHIM J H, et al. Detection of abnormally high amygdalin content in food by an enzyme immunoassay[J]. Molecules and Cells, 2006, 21(2): 308-313.
[22] KANG S H, JUNG H, KIM N. Micellar electrokinetic chromatography for the analysis of D-amygdalin and its epimer in apricot kernel[J]. Journal of Chromatography, 2000, 866(2): 253-259.
[23] 寇凯, 许宁侠, 申烨华. 反相高效液相色谱法测定长柄扁桃仁产品中苦杏仁苷含量[J]. 分析科学学报, 2013, 29(3): 367-370.
[24] SCHULTZ J, MILPETZ F, BORK P, et al. SMART, a simple modular architecture research tool: identif cation of signaling domains[J]. Proceedings of the National Academy of Sciences, 1998, 95(11): 5857-5864.
[25] PUNTA M, COGGILL P C, EBERHARDT R Y, et al. The Pfam protein families database[J]. Nucleic Acids Research, 2012, 40: D290-D301.
[26] 彭佳师, 龚继明. 信号肽与蛋白质的分选转运[J]. 植物生理学报, 2011, 47(1): 9-17.
[27] 周鸣, 李小玲, 李桂源. 蛋白质入核转运的机制和研究进展[J]. 中国生物化学与分子生物学报, 2006, 22(10): 780-786.
[28] RAPOPORT T A. Protein translocation across the eukaryotic endoplasmic reticulum and bacterial plasma membranes[J]. Nature, 2007, 450: 663-669.
[29] HENRISSAT B, CALLEBAUT I, FABREGA S, et al. Conserved catalytic machinery and the prediction of a common fold for several families of glycosyl hydrolases[J]. Proceedings of the National Academy of Sciences, 1995, 92(15): 7090-7094.
[30] SWAIN E, POULTON J E. Immunocytochemical localization of prunasin hydrolase and mandelonitrile lyase in stems and leaves of Prunus serotina[J]. Plant Physiology, 1994, 106(4): 1285-1291.
[31] SWAIN E, POULTON J E. Utilization of amygdalin during seedling development of Prunus serotina[J]. Plant Physiology, 1994, 106(2): 437-445.
[32] LI Chunping, SWAIN E, POULTON J E. Prunus serotina amygdalin hydrolase and prunasin hydrolase: purif cation, N-terminal sequencing, and antibody production[J]. Plant Physiology, 1992, 100(1): 282-290.
[33] ZHOU Jiming, HARTMANN S, SHEPHERD B K, et al. Investigation of the microheterogeneity and aglycone specificity-conferring residues of black cherry prunasin hydrolases[J]. Plant Physiology, 2002, 129(3): 1252-1264.
[34] GERARDI C, BLANDO F, SANTINO A. Purification and chemical characterisation of a cell wall-associated β-galactosidase from mature sweet cherry (Prunus avium L.) fruit[J]. Plant Physiology and Biochemistry, 2012, 61: 123-300.
[35] VERDE I, ABBOTT A G, ROKHSAR D S, et al. The high-quality draft genome of peach (Prunus persica) identifies unique patterns of genetic diversity, domestication and genome evolution[J]. Nature Genetics, 2013, 45(5): 487-494.
[36] WANG Lu, ZHAO Shuang, GU Chao, et al. Deep RNA-Seq uncovers the peach transcriptome landscape[J]. Plant Molecular Biology, 2013, 83(4/5): 365-377.
[37] LAZZARI B, CAPRERA A, VECCHIETTI A, et al. VersionⅥ of the ESTree DB: an improved tool for peach transcriptome analysis[J]. BMC Bioinformatics, 2008, 9(Suppl 2): 1-6.
Cloning of Prunasin Hydrolase Gene from Sweet and Bitter Apricot Kernels
BAI Yu-jia1,2, WANG Min2, TAO Yong-xia2, XU Le3, FENG Zuo-shan1,2,*
(1. College of Forestry and Horticulture, Xinjiang Agricultural University, Ürümqi 830052, China; 2. College of Food Science and Pharmacy, Xinjiang Agricultural University, Ürümqi 830052, China; 3. Luntai Plant Germplasm Resources Garden, Xinjiang Academy of Agricultural Sciences, Luntai 841600, China)
Prunasin hydrolase (PH) gene was cloned from sweet and bitter apricot (Prunus armeniaca L.) kernels from the cultivars Luntai Xiaobaixing and Jiamaihuangxing, respectively. The PH gene from Luntai Xiaobaixing was named as PaLTPh (GenBank accession number: KF888615) with a sequence length of 3 686 bp, and that from Jiamaihuangxing was named as PaMJPh (GenBank accession number: KF888616) with a sequence length of 3 690 bp. Analysis of the nucleotide sequences indicated that the homology between the PH gene and the PH691 gene of Prunus dulcis reached up to 94%. Moreover, the coding sequence (CDS) region was cloned according to the conserved regions of PaLTPh and PaMJPh. The sequence length of both PaLTPh CDS (KF888617) and PaMJPh CDS (KF888618) was 1 635 bp. Both these CDS regions were full open reading frame (ORF) sequences, encoding a protein consisting of 544 amino acid (aa) residues. Both proteins contained an amino-terminal signal peptide with 26 AA residues and the domain of glycosyl hydrolase family Ⅰ for PaLTPH and PaMJPH, which can catalyze the hydrolysis of prunasin to mandelonitrile and glycosides. This study has demonstrated that the PH gene from apricot has high homology with the Ph691 of Prunus dulcis.
Prunus armeniaca L. cultivar Luntai Xiaobaixing; Prunus armeniaca L. cultivar Jiamaihuangxing; prunasin; prunasin hydrolase; gene cloning
S622.2
A
1002-6630(2014)23-0226-06
10.7506/spkx1002-6630-201423044
2013-11-30
白羽嘉(1984—),男,博士研究生,研究方向为果蔬采后生理及贮运。E-mail:saintbyj@126.com
*通信作者:冯作山(1963—),男,教授,博士,研究方向为果蔬采后生理及贮运。E-mail:fengzuoshan@126.com
