柑橘皮渣降解菌的筛选及特性
2014-02-08李世忠黄建国李治玲彭良志
李世忠,黄建国,李治玲,彭良志,李 勇,*
(1.西南大学资源环境学院,重庆 400715;2.中国农业科学院柑桔研究所,重庆 400715)
柑橘皮渣降解菌的筛选及特性
李世忠1,黄建国1,李治玲1,彭良志2,李 勇1,*
(1.西南大学资源环境学院,重庆 400715;2.中国农业科学院柑桔研究所,重庆 400715)
为有效处理柑橘皮渣,筛选高效降解柑橘皮渣的菌株。本实验从堆肥中分离得到5 株菌株,测定其香精油耐受性,选取两株耐受性较好的菌株测定纤维素酶和果胶酶活力,并进行柑橘皮渣降解实验。结果表明,菌株L207和L702在65 ℃条件下可正常生长,属于耐高温菌株;对柑橘香精油具有较好的耐受能力,其最大耐受体积分数为25.0%;2 株菌株的纤维素酶活力和果胶酶活力分别是对照菌株(Bacillus subtilis L520)的1.31、2.08 倍和12.68、7.30 倍。柑橘皮渣降解实验表明,菌株能快速高效分解纤维素和果胶。16S rDNA基因序列分析鉴定表明菌株L207和L702均属于地衣芽孢杆菌(Bacillus licheniformis)。
柑橘皮渣降解菌;柑橘精油;纤维素酶;果胶酶;16S rDNA
我国是柑橘的重要原产地之一,据统计2011年,我国柑橘种植面积3 300万亩,产量已达到2 900万 t,面积和产量均位居世界第一。柑橘除少量直接食用外,大部分用于果汁加工,目前我国柑橘产量的约100万t用于加工,每年约产生60万t皮渣,随着加工业的发展,皮渣量还要逐渐增加[1]。无(低)能耗处理柑橘皮渣是一个世界性的难题。大量的皮渣未能及时有效处理,污染水源,土壤和空气,严重影响人们的生产、生活及健康[2],已经成为柑橘加工业的可持续发展重要瓶颈问题之一,亟需解决。
国内外目前柑橘皮渣主要通过卫生填埋、烘干做动物饲料,提取活性成分等处理方法[3-4]。国内目前多数采用填埋处理,但是由于柑橘皮渣含水量可达80%左右,卫生填埋产生大量渗透液,破坏填埋厂,污染土壤、水体和空气;柑橘皮渣含有果胶和大量水分,烘干需要消耗大量能量,美国、巴西等柑橘加工大国由于能源价格低,规模大,多采用烘干做动物饲料处理,可实现一定的效益[5],国内由于能源价格高,规模小,虽然能够运行,但难于实际应用;提取皮渣中的香精油,色素,果胶等活性成分[6-8],虽然可以增加皮渣的产值[9],但在一定程度上增加了废弃物的种类,污染问题并没有消除。综上所述,目前并未找到一种既经济又环保又适合我国的柑橘皮渣处理方式。
柑橘皮渣含有约80%的水分,还含有约0.5%~2.0%柑橘香精油、20%果胶和15%纤维素[10]。研究[11]表明柑橘香精油对大多数革兰氏阳性菌和阴性菌均有广谱抑制作用,普通微生物很难以柑橘皮渣为基质生长,是柑橘皮渣发酵分解困难的重要原因之一。其次柑橘皮渣含有果胶和纤维素等大分子物质,外围包裹木质素[12],进一步增加了普通微生物降解皮渣的难度。普通的堆肥是一种有效的柑橘皮渣资源化处理和利用有效方式,但是处理过程必须添加大量的辅料,添加比例达到50%~80%,以稀释香精油浓度和为微生物生长提供必要的碳源,增加了产业化处理的成本和难度。因此,研筛选和研究既具有抗香精油特性,又具有高效果胶、纤维素分解能力的优良的微生物菌株的研究工作具有重要的理论和实践意义。
本研究通过高温及拮抗实验,筛选出耐受高浓度柑橘香精油、在高温、低pH值条件下具有高效纤维素酶活性和果胶酶活性菌株,测定其相关活性,开展柑橘皮渣降解实验,寻找一种既经济又环保的柑橘皮渣资源化利用的处理方式,以期为柑橘皮渣产业化处理应用提供重要的菌株资源和理论技术支撑。
1 材料与方法
1.1 材料
1.1.1 菌株
对照菌株:枯草芽孢杆菌(Bacillus subtilis)L520,西南大学资源环境学院微生物实验室提供;菌株L106、L202、L207、L309、L702,从堆肥中分离获得。
供试柑橘皮渣由重庆三峡建设集团有限公司忠县果汁厂提供,皮渣共1 000 kg。
1.1.2 培养基
牛肉膏蛋胨培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g、琼脂15~20 g,蒸馏水1 000 mL,用于细菌的初步分离纯化和菌株保藏。
纤维素刚果红培养基[13]:羧甲基纤维素钠(sodium carboxymethylcellulose,CMC-Na)2 g、(NH4)2SO42 g、MgSO4·7H2O 0.5 g、K2HPO41 g、NaCl 0.5 g、刚果红4 g、琼脂15~20 g,蒸馏水1 000 mL,自然pH值,用于纤维素降解菌的筛选分离。
果胶刚果红培养基[14]:果胶5 g、(NH4)2SO42 g、MgSO4·7H2O 1 g、琼脂15~20 g、刚果红0.15 g,用于果胶降解菌的筛选分离。
液体发酵产纤维素酶培养基:CMC-Na 10 g、(NH4)2SO44 g、MgSO4·7H2O 0.1 g、蛋白胨1 g、酵母膏10 g,蒸馏水1 000 mL。
液体发酵产果胶酶培养基:果胶5 g、酵母膏5 g、(NH4)2SO42 g、K2HPO42 g、MgSO4·7H2O 0.5 g、NaCl 0.3 g,蒸馏水1 000 mL。
1.1.3 试剂
柑橘香精油(从柑橘皮渣中利用溶液浸提法提取,柠烯含量(主要成分)约80%为提取后香精油原始含量) 重庆市三峡建设集团有限公司;细菌基因组DNA提取试剂盒 美国Omega公司。
1.2 方法
1.2.1 菌株筛选
1.2.1.1 耐高温菌株分离与纯化
将采集的堆肥样品通过稀释涂布平板法接种到牛肉膏蛋白胨培养基上,放置在55、60、65、70、75 ℃温度条件下培养24 h,挑起单菌落到试管斜面中,再通过平板划线法纯化备用。分离得到在55 ℃正常生长的菌株5 株(L106、L202、L207、L309、L702)。
1.2.1.2 耐受柑橘香精油菌株筛选
采用抑菌圈测定法[15],分别挑起菌株(L106、L202、L207、L309、L702)和枯草芽孢杆菌L520(对照菌株)3 环于无菌水中混匀获得菌悬液,吸取0.2 mL菌悬液均匀涂布于牛肉膏固体培养基上,形成平板。配制不同体积分数柑橘香精油(50%、25%、12.5%、6.25%、5%),取直径0.6 cm已灭菌的圆形滤纸片若干,浸润后备用。将上述滤纸片,放置于平板,于37 ℃培养24 h,测量相关抑菌圈直径大小。
1.2.2 纤维素酶和果胶酶活力测定
1.2.2.1 纤维素酶活力测定
粗酶液的提取:接种量为4%,以CMC-Na为唯一碳源的摇瓶发酵培养基,在37 ℃、120 r/min恒温培养3 d,于10 000 r/min、4 ℃离心10 min,所得上清液即为粗酶液。
酶活力测定:采用羧甲基纤维素酶-3,5-二硝基水杨酸(carboxymethyl cellulose enzyme-3,5-dinitrosalicylic acid,CMCA-DNS)法[16-17],即反应体系中含有2 mL CMC-Na底物溶液,待测酶液0.5 mL(空白管不加酶液),于50 ℃恒温水浴,准确反应30 min,再加入3 mL DNS试剂(空白管加0.5 mL酶液),同时置于沸水浴中,加热10 min,冷却至室温,定容至25 mL,于540 nm波长处测量OD值,通过查标准曲线或用线性回归方程求出还原糖的含量。
酶活力单位定义:在上述测定条件下,每分钟水解纤维素产生1 μmol葡萄糖所需要的酶量为一个酶活力单位(U)。
1.2.2.2 果胶酶活力测定
粗酶液的提取:接种量为4%,以果胶为唯一碳源的摇瓶发酵培养基,在37 ℃、120 r/min恒温培养2 d,于10 000 r/min、4 ℃离心15 min,所得上清液即为粗酶液。
酶活力测定:采用DNS法[18],即反应体系中含有1.8 mL果胶底物溶液,待测酶液0.2 mL(空白管不加酶液),于50 ℃恒温水浴,准确反应30 min,在加入2 mL DNS试剂,空白管加入0.2 mL酶液同时置于沸水浴,加热10 min,冷却至室温,定容至15 mL,于540 nm波长处测定OD值,通过查标准曲线或用线性回归方程求出还原糖的含量。
酶活力单位定义:在上述测定条件下,每小时水解果胶产生1 μmol还原糖(半乳糖醛酸)所需酶量为一个酶活力单位(U)。
1.2.3 菌株L702和L207的16S rDNA序列鉴定
采用细菌基因组DNA提取试剂盒提取L702和L207,具体方法参照文献[19]。以16S rDNA通用引物27F:5’-AGAGTTTGATCCTGGCTCAG-3’,1492R:5’-TACCTTGTTACGACTT-3’。
聚合酶链式反应(polymerase chain reaction,PCR)扩增体系为25 μL:dNTP 2 μL,Mg2+1.5 μL,Buffer 2.5 μL,Primer各1 μL,ddH2O 15.8 μL,Taq酶 0.2 μL,模板1 μL。扩增条件:95 ℃预变性5 min,94 ℃ 1min、53 ℃ 1 min、72 ℃ 2 min,30 个循环,72 ℃延伸5 min,4 ℃终止。
用1%的琼脂糖凝胶电泳检测扩增产物,用琼脂糖凝胶DNA回收试剂盒回收PCR产物,送至华大基因公司测序。将测序获得的DNA序列,输入GenBank,用BLAST程序与数据库中的所有序列进行比较分析,利用DNAMAN中的MegAlign软件构件16S rDNA系统发育树。
1.2.4 菌株L207和L702的皮渣降解实验
将菌株L207和L702用牛肉膏蛋白胨培养液37 ℃揺瓶培养48 h,备用。按照m(新鲜皮渣)∶m(米糠)∶m(菌液)∶m(石灰)∶m(尿素)=100∶20∶2∶8∶5的比例混匀,其中皮渣共1 000 kg,堆置发酵,约3~5 d后温度上升,最高温度约68 ℃,堆置发酵期间,每10 d翻堆一次,约50 d左右发酵结束。每10 d取样一次,分别分析测定其水分、氮磷钾[20]、纤维素[21]和果胶[22]含量。由于在预备实验中,不接种微生物菌剂的柑橘皮渣均发生严重腐败,产生大量臭气,使得皮渣发酵不能正常进行,所以该实验没有设置不接种菌剂的处理。同时实验所使用底料比例是在多次预备实验中获得的。
1.3 数据分析
用Excel对实验数据进行基本计算和作图,DPS 7.0软件进行统计分析,最小显著性差异(least-significant difference,LSD)法检验差异显著性。
2 结果与分析
2.1 菌株对柑橘精油的耐受性
由表1可知,不同体积分数香精油对供试菌株的抑菌圈直径明显小于对照菌株,差异达到显著水平(P<0.05);不同菌株对香精油的耐受力不同,随着体积分数增加,香精油抑制作用均明显增加。在柑橘香精油体积分数为12.5%时,菌株L106、L202、L309的生长受到抑制作用,而L207和L702无抑制作用,说明菌株L106、L202和L309的耐受香精油体积分数约为12.5%;当香精油体积分数增加为25%时,菌株L207和L702出现一定抑菌圈,说明L207和L702菌株的耐受香精油最高体积分数约为25%,因此菌株L702和L207相对其他菌株对柑橘香精油有较强的耐受力。
表1 不同体积分数柑橘香精油对菌株的抑菌圈(±s,n=4)Table1 Diameter of inhibition cycle of essential oil on the strains±s, n=4)
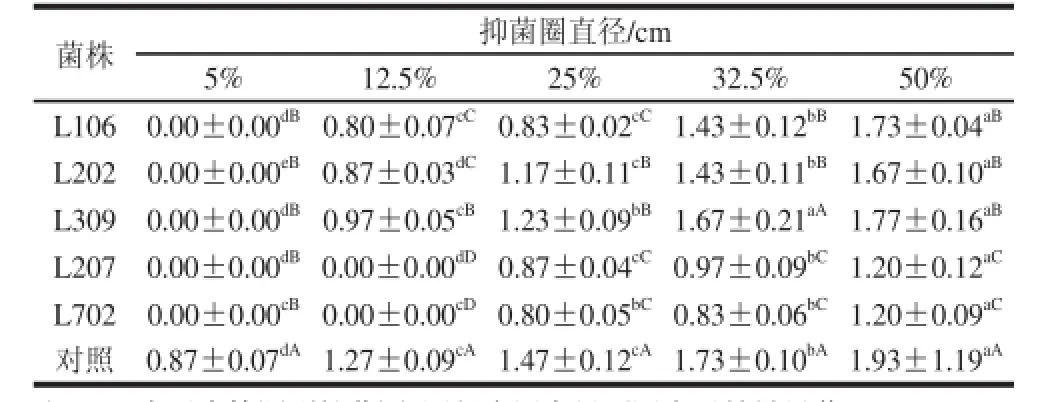
表1 不同体积分数柑橘香精油对菌株的抑菌圈(±s,n=4)Table1 Diameter of inhibition cycle of essential oil on the strains±s, n=4)
注:“0”表示未检测到抑菌圈;同行小写字母不同表示差异显著(P<0.05);同列大写字母不同表示差异显著(P<0.05)。
菌株抑菌圈直径/cm 5%12.5%25%32.5%50% L1060.00±0.00dB0.80±0.07cC0.83±0.02cC1.43±0.12bB1.73±0.04aBL2020.00±0.00eB0.87±0.03dC1.17±0.11cB1.43±0.11bB1.67±0.10aBL3090.00±0.00dB0.97±0.05cB1.23±0.09bB1.67±0.21aA1.77±0.16aBL2070.00±0.00dB0.00±0.00dD0.87±0.04cC0.97±0.09bC1.20±0.12aCL7020.00±0.00cB0.00±0.00cD0.80±0.05bC0.83±0.06bC1.20±0.09aC对照0.87±0.07dA1.27±0.09cA1.47±0.12cA1.73±0.10bA1.93±1.19aA
2.2 纤维素降解酶和果胶降解酶的活性
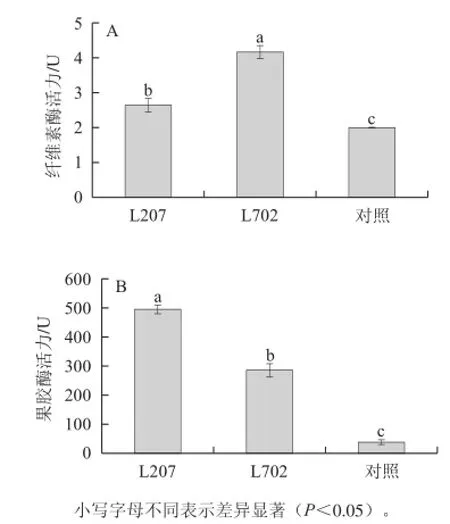
图1 菌株的纤维素酶(A)和果胶酶活性(B)Fig.1 The activities of cellulase (A) and pectinase (B) in L207 and L702
由图1A可知,菌株L207和L702的纤维素降解酶活性均显著大于对照菌株,分别是对照菌株的1.31 倍和2.08 倍,差异达到显著水平(P<0.05)。由图1B可知,菌株L207和菌株L702果胶降解酶活性均显著大于对照菌株,分别是对照菌株的12.68 倍和7.30 倍,差异达到显著水平(P<0.05)。
2.3 菌株L207和L702柑橘皮渣降解能力
表2 菌株L207和L702降解柑橘皮渣各成分含量随时间变化(±s,n=4)Table2 Temporal evolution of citrus pomace components during fermentation by either L207 or L70(±s,n=4)
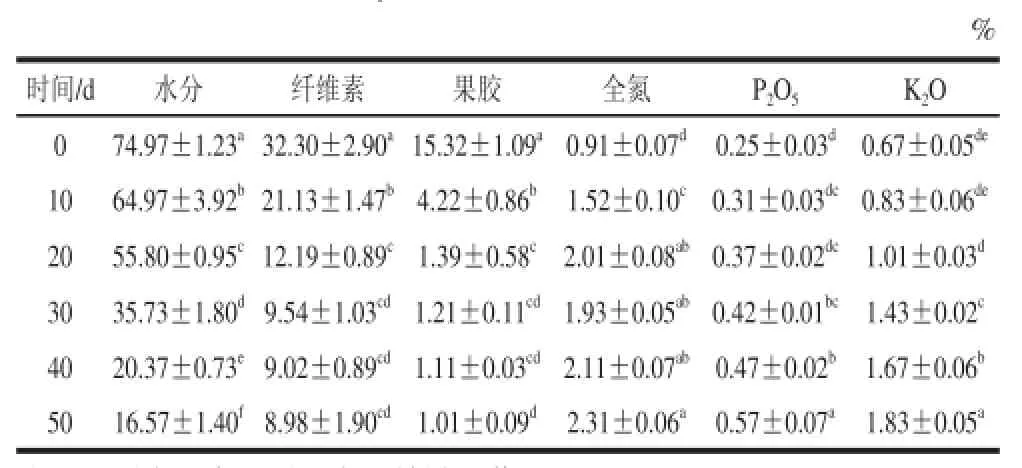
表2 菌株L207和L702降解柑橘皮渣各成分含量随时间变化(±s,n=4)Table2 Temporal evolution of citrus pomace components during fermentation by either L207 or L70(±s,n=4)
注:同列小写字母不同表示差异显著(P<0.05)。
%时间/d水分纤维素果胶全氮P2O5K2O 074.97±1.23a32.30±2.90a15.32±1.09a0.91±0.07d0.25±0.03d0.67±0.05de1064.97±3.92b21.13±1.47b4.22±0.86b1.52±0.10c0.31±0.03dc0.83±0.06de2055.80±0.95c12.19±0.89c1.39±0.58c2.01±0.08ab0.37±0.02dc1.01±0.03d3035.73±1.80d9.54±1.03cd1.21±0.11cd1.93±0.05ab0.42±0.01bc1.43±0.02c4020.37±0.73e9.02±0.89cd1.11±0.03cd2.11±0.07ab0.47±0.02b1.67±0.06b5016.57±1.40f8.98±1.90cd1.01±0.09d2.31±0.06a0.57±0.07a1.83±0.05a
由表2可知,堆置过程中,随时间延长,柑橘皮渣水、纤维素、果胶含量显著减少,而养分含量逐渐增加。其中,柑橘皮渣中的水分随时间呈直线降低。在柑橘皮渣堆置降解至第50天,水分含量由74.97%下降到为16.57%,降低了58.4%,差异达到显著水平(P<0.05)。纤维素含量也明显降低,30 d后逐步趋于恒定,到50 d,降解率达到84.45%,差异达到显著水平(P<0.05)。果胶含量在10 d显著降低,到30 d时逐步恒定;到50 d,果胶含量的最低,仅1.01%,降解率达到65.93%,差异达到显著水平(P<0.05)。氮磷钾含量明显变化。磷和钾含量持续增加,氮含量先升高后降低。当堆置发酵至第50天,全氮、P2O5和K2O含量分别为2.31%、0.57%和1.83%,总养分含量(N+P2O5+K2O)为4.71%,大于4.0%,达到行业标准NY 525—2002《有机肥料》。
2.4 菌株L207和L702的16S rDNA基因序列分析
采用PCR扩增技术,成功扩增出菌株L702和L207的16S rDNA基因,然后对其进行克隆和测序,测定菌株L702和L207的序列长度分别为1 161 bp和840 bp(部分片段)。
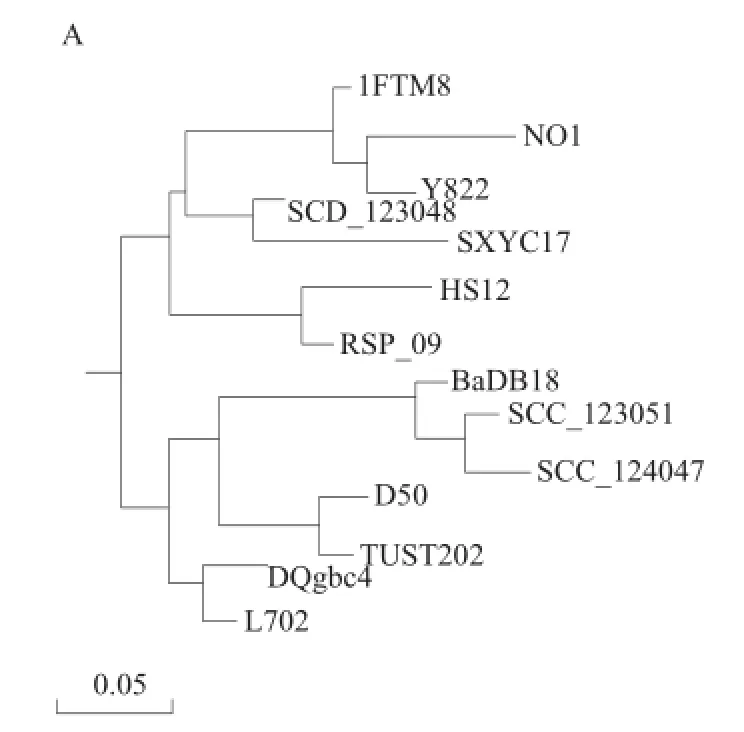
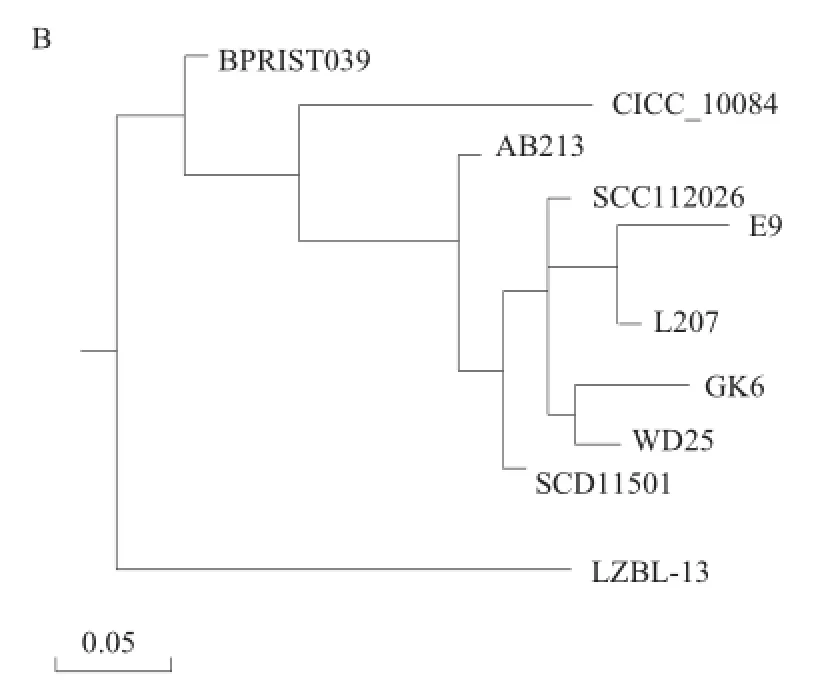
图2 菌株L702(A)和L207(B)的16S rDNA基因序列系统发育树Fig.2 Phylogenetic tree derived from 16S rDNA gene sequence of strains L702 (A) and L207 (B)
将该序列结果输入GenBank,用BLAST进行序列同源性分析比较。用DNAMAN中的MegAlign软件构件系统发育树(图2)可知,菌株L702与Bacillus licheniformis中的DQgbc4亲缘关系最近,相似性达到99.20%;菌株L207与Bacillus licheniformis中的E9亲缘关系最近,相似性达到99.30%。因此初步确定菌株L702和L207均属于芽孢杆菌属中的地衣芽孢杆菌(Bacillus licheniformis)。
3 讨 论
皮渣烘干做饲料,具有不产生大量废液,废气,对环境友好等优点,但是柑橘皮渣含水量高,最高可达70%~80%左右,同时含有果胶等增加了烘干的难度,烘干需要消耗大量能源。研究表明,烘干1 t鲜皮渣至少需要消耗0.7 t标煤[23],按照2012年标煤价格大约680 元/t计算,仅标煤成本需要476 元,烘干成本高。巴西、美国等柑橘加工大国,其能源价格低,烘干1 t鲜皮渣标煤成本不到300元,只是国内标煤成本的60%左右[24];此外国外柑橘加工生产规模大,如巴西的Sucocitrico Cutrale公司,年加工规模达到150万 t[5],具有规模化的优势,其处理成本和产出基本相当,已被规模化推广[25]。但是我国柑橘加工厂规模小,年加工5万 t,只是国外的1/30,因此,国内柑橘皮渣烘干成本高,产出低,虽然环保但是并不经济。
卫生填埋投资和运行费用一般而言相对较低,操作简单易行,目前大多柑橘加工厂采用此方法处理柑橘皮渣。但是柑橘皮渣具有体积大、含水量高,pH值低等特点,进行卫生填埋处理需要占用大量土地,据统计年加工2万 t的柑橘厂,将产生1万 t的柑橘皮渣,通过填埋处理,每年将占地4 000 m2;其次柑橘皮渣含水量高达70%~80%,填埋处理产生大量的渗漏液,1万 t皮渣将产生月7 000 t废水,渗漏液量大,酸度大,化学需氧量(chemical oxygen demand,COD)高,回收处理难度大,容易对土壤和水体环境等造成严重的二次污染;第三,卫生填埋是一个厌氧的不完全降解过程,皮渣的降解耗时长,同时产生大量有毒物质和气体等中间产物[26],污染环境和空气,影响周围人们的生活安全。
柑橘皮渣中含有丰富的香精油,约占果皮鲜质量的0.5%~2.0%,研究表明柑橘精油对大多数微生物具有广谱抑制作用。陈林林等[27]研究表明,柑橘精油对大肠杆菌、白色葡萄球菌和青霉有显著抑制作用,其最大抑菌浓度均小于3.0%。目前,对柑橘精油具有较强耐受能力的降解柑橘皮渣的微生物菌群还未见报道[28]。传统的堆肥处理是一种有效的皮渣资源化利用的方式,但是由于普通的分解微生物不具有耐柑橘香油和高效的纤维素和果胶分解能力,因此须添加大量的辅料,添加质量分数达到50%~70%,稀释了香精油体积分数,减缓香精油对分解微生物的抑制作用,同时为微生物快速生长的提供必要碳源物质。本实验分离获得的菌株L207和L702对柑橘香精油具有较好的耐受性,耐受香精油最高体积分数为25.0%,在柑橘皮渣分解实验中,其辅料添加量仅为20%,柑橘精油体积分数最大约为16%,因此普通微生物生长受到抑制,但是高效菌株生长未受影响,其快速生长有利于皮渣降解,温度升高,缩短发酵周期,是柑橘皮渣的降解的重要因素之一。
柑橘皮渣果胶含量高达20%,果胶与水结合形成束缚水,使得柑橘皮渣的脱水困难;同时柑橘皮含有纤维素等大分子物质,含量高达15%,外围包裹木质素层,使得柑橘皮渣难以降解。柑橘皮渣中果胶如不能快速分解,则导致大量水分以束缚水存在,含水量高,氧气含量低,微生物的分解主要是通过厌氧发酵进行。厌氧发酵分解效率低,产生的能量少,温度低,容易发生腐败,同时分解过程中产生大量有机酸,产生大量臭气[29]。值得注意的是,在皮渣降解实验中果胶含量在第10天显著降低,皮渣束缚水转化为自由水,说明分离获得的两株菌株具有高效的果胶降解能力,有利于水分的脱去;果胶分解后微生物的降解主要以好氧分解为主,其分解效率高,释放大量的热量,发酵温度高,提高微生物相关酶的活性[30],既有力于皮渣中果胶、纤维素等大分子物质的降解,同时又缩短发酵时间。整个皮渣发酵过程持续约50 d后,皮渣中的纤维素和果胶含量显著降低,水分含量低于20%,总养分含量大于4%,达到行业标准NY 525—2002。
综上所述,菌株L207和L702既具有香精油耐受能力,又有较高的纤维素酶和果胶酶活性,能高效分解皮渣,促进皮渣脱水,是皮渣降解的关键因素之一,因此可望在柑橘皮渣规模化处理中得到实际推广应用。
4 结 论
本实验分离得到2 株降解柑橘皮渣的菌株L207和L702,既具有香精油耐受能力,又有较高的纤维素酶和果胶酶活性。L207和L702的耐受柑橘香精油的最大体积分数为25%;两株菌株对柑橘皮渣中的果胶和纤维素有显著的降解能力,其果胶酶活性是430.27 U和212.32 U,是普通对照菌株的12.68 倍和7.30 倍;其纤维素酶活性是2.64 U和4.2 U,是普通对照菌株的1.31 倍和2.08 倍。在柑橘皮渣降解实验的第20天,纤维素含量由32.30%降到12.19%,降解率达到84.45%,而果胶含量在第10天由15.32%降到4.22%,降解率达到65.93%,皮渣中的纤维素和果胶等大分子物质大多数分解。L207和L702菌株经16S rDNA基因序列分析鉴定表明均属于芽孢杆菌属中的地衣芽孢杆菌(Bacillus licheniformis)。
[1] 单杨. 中国柑橘工业的现状、发展趋势与对策[J]. 中国食品学报, 2008, 8(1): 1-8.
[2] 陆胜民. 世界柑橘生产、贸易、加工的历史、现状与发展趋势[J].食品与发酵科技, 2010, 46(6): 63-71.
[3] ROTHSCHILD N, NOYOTNY Y C, VACLAV S. Ligninolytic enzymes of the fungus Irpex lacteus (Polyporus tulipiferae): isolation and characterization of lignin peroxidase[J]. Enzyme and Microbial Technology, 2002, 31: 627-633.
[4] 孙金辉, 陈海桂, 卢沿钢, 等. 柑橘皮渣生物转化利用研究进展[J].食品科学, 2011, 32(19): 312-315.
[5] CERISUELO A, CASTELLÓ L, MOSET V. The inclusion of ensiled citrus pulp in diets for growing pigs: effects on voluntary intake, growth performance, gut microbiology and meat quality[J]. Livestock Science, 2010, 134(1): 180-182.
[6] SUETSUGU T, TANAKA M, IWAI H, et al. Supercritical CO2extraction of essential oil from Kabosu(Citrus sphaerocarpa Tanaka) peel[J]. Flavor, 2013, 2(1): doi: 10.1186/2044-7248-2-18.
[7] MAMMA D, CHRISTAKOPOULOS P. Biotransformation of citrus by-products into value added products[J]. Waste Biomass Valorization, 2013, 7(18): 1-8.
[8] HOSHINO M, TANAKA M, TERADA A, et al. Characteristics of pectin extracted from citrus peel using subcritical water[J]. Journal of Bioscience and Bioengineering, 2009, 108: S144-S145.
[9] AGU P N, OLUREMI I A, TULEUN C D. Nutrional evaluation of sweet orange fruit peel as a feed resource in broiler production[J]. International Journal of Poultry Science, 2010, 9(7): 684-688.
[10] 关海宁, 刁小琴, 张润光. 柑橘功能性成分研究现状与发展前景[J].食品研究与开发, 2008, 29(9): 169-174.
[11] 赵建, 袁玲, 黄建国, 等. 柑橘皮渣高温堆肥生产有机肥[J]. 农业工程学报, 2011, 27(10): 270-276.
[12] 李悦, 侯滨滨, 赵婧. 柑橘类精油抗菌活性的研究[J]. 食品研究与开发, 2011, 32(6): 190-192.
[13] 刘洁丽, 王靖, 李明. 一株纤维素降解细菌的筛选、鉴定及特性研究[J]. 化学与生物工程, 2010(4): 54-56.
[14] 苏腾甲, 朱雄伟, 张佑红, 等. 一种果胶酶生产菌株的分离及其产酶条件优化[J]. 武汉工程大学学报, 2012(4): 15-18.
[15] 杨森艳, 姚雷. 柠檬草精油抗性研究[J]. 上海交通大学学报: 自然科学版, 2005, 12(4): 373-376.
[16] 樊程, 李双江, 李成磊, 等. 大熊猫肠道纤维素分解菌的分离鉴定及产酶性质[J]. 微生物学报, 2012(9): 1113-1121.
[17] QB 2583—2003 纤维素酶制剂[S].
[18] 蓝丽精, 周琴, 蔡琪敏, 等. 一株高产果胶酶青霉菌株的筛选鉴定[J].浙江师范大学学报: 自然科学版, 2011, 11(4): 452-456.
[19] 吴丹, 邓泽元, 范亚苇, 等. 一株纤维素分解菌的分离、鉴定及产酶条件优化[J]. 食品科学, 2008, 29(6): 218-221.
[20] 杨剑虹, 王成林, 代亨林. 土壤农化分析与环境监测[M]. 北京: 中国大地出版社, 2005: 242-267.
[21] van SOEST P J. Development of a comprehensive system of feed analyses and its application to for ages[J]. Journal of Dairy Science, 1967, 26(1): 119-128.
[22] 尚雪波, 帅鸣. 柑橘皮渣中果胶含量的测定[J]. 湖南农业科学, 2010(9): 88-90.
[23] 李赤翎, 李彦, 俞建, 等. 柑橘皮渣发酵饲料研究[J]. 食品工业科技, 2009, 30(5): 169-174.
[24] 钟良琴. 柑橘渣的饲用价值研究[J]. 资源开发与利用, 2009(7): 74-77.
[25] CHENG Gong, LI Fengcheng, XUE Xiangfan. Suggestions on the orange-processing technologes of Brazil and Spain[J]. Modern Food Science and Technology, 2010, 26(2): 195-197.
[26] 胡新军, 张敏, 余俊峰, 等. 中国餐厨垃圾处理的现状、问题和对策[J].生态学报, 2012, 32(14): 4575-4584.
[27] 陈林林, 米强, 辛嘉英. 柑橘皮精油成分分析及抑菌活性研究[J]. 食品科学, 2010, 31(17): 25-28.
[28] 赵红, 张衍林. 腐烂柑橘与猪粪混合厌氧发酵产沼气试验研究[J].中国沼气, 2011, 29(2): 19-24.
[29] 韩捷, 向欣, 程红胜, 等. 好氧预处理对干法沼气发酵产气量的影响及能量损失[J]. 农业工程学报, 2011, 27(12): 246-249.
[30] 王得武, 姚拓, 杨巧丽, 等. 高效木质纤维素分解菌群筛选及其酸碱调节能力研究[J]. 中国生态农业学报, 2013, 21(5): 621-627.
Screening of Two Bacterial Strains Capable of Degrading Citrus Pomace and Their Characteristics
LI Shi-zhong1, HUANG Jian-guo1, LI Zhi-ling1, PENG Liang-zhi2, LI Yong1,*
(1. College of Resources and Environment, Southwest University, Chongqing 400715, China; 2. Citrus Research Institute, Chinese Academy of Agricultural Sciences, Chongqing 400715, China)
This study was conducted to screen microorganisms degrading citrus pomace. Five strains of citrus pomacedegrading bacteria were screened from soil compost and tested for citrus essential oil toleranc. Two of these strains were found to have higher tolerance. Meanwhile, cellulase and pectinase activities of the two selected strains were also determined, and their ability to degrade citrus pomace was characterized. The experimental results showed that the selected strains L207 and L702 could grow normally at 65 ℃ as thermophilic stains. They could tolerate up to 25.0% aqueous ethanol and produce 1.31 and 2.08 times higher cellulase activity, and 12.68 and 7.30 times higher pectinase activity than the control Bacillus subtilis L520, respectively. Both strains were able to rapidly and efficiently degrade cellulose and pectin. 16S rDNA sequencing showed that they both belonged to Bacillus licheniformis.
citrus pomace degrading bacteria; citrus essential oil; cellulase; pectinase; 16S rDNA
Q939.96
A
1002-6630(2014)23-0188-05
10.7506/spkx1002-6630-201423037
2013-12-24
农业科技成果转化资金项目(2013GB2F100396);重庆市重大科技攻关计划项目 (cstc2012gg-yyjsB80007);西南大学博士基金项目(SWU113018)
李世忠(1990—),男,硕士研究生,研究方向为环境微生物学及有机污染物处理。E-mail:lsz_137400@126.com
*通信作者:李勇(1974—),男,副教授,博士,研究方向为农业微生物和环境微生物学。E-mail:liyongwf@swu.edu.cn
