有机酸对紫甘薯花色苷的辅色作用
2014-02-08李小定朱少华
王 萌,李小定,刘 硕,朱少华,姜 红
(华中农业大学食品科技学院,环境食品学教育部重点实验室,湖北 武汉 430070)
有机酸对紫甘薯花色苷的辅色作用
王 萌,李小定*,刘 硕,朱少华,姜 红
(华中农业大学食品科技学院,环境食品学教育部重点实验室,湖北 武汉 430070)
辅色作用是一种提高花青素稳定性的有效途径。研究柠檬酸、DL-苹果酸、酒石酸、咖啡酸和阿魏酸对紫甘薯花色苷的辅色作用。结果表明,5 种有机酸均能提高紫甘薯花色苷的吸光度,但均没有改变紫甘薯花色苷的组分。90 ℃条件下,柠檬酸、DL-苹果酸和酒石酸可使紫甘薯花色苷的半衰期由15.3 h分别提高到19.1、19.0 h和16.9 h;咖啡酸与阿魏酸显著地降低了紫甘薯花色苷热稳定半衰期,分别降至1.8 h和1.6 h,不利于紫甘薯花色苷的热稳定性。
紫甘薯花色苷;有机酸;辅色作用;热稳定性
紫甘薯(Ipomoea batatas L.)为旋花科一年生草本植物,块根肉质紫红色,是甘薯中特有的品种。花色苷是一种自然界广泛存在的植物色素,属于类黄酮类化合物,为2-苯基苯并毗喃阳离子的衍生物,具有典型的C6-C3-C6结构[1],紫甘薯花色苷主要由矢车菊素和芍药色素两种色素组成[2]。在不同pH值水溶液中,花色苷分别以2-苯基苯并吡喃阳离子、醌型碱、假碱、查耳酮形式存在,使溶液呈现不同的颜色[3]。相对于合成色素,天然色素有一个缺点是稳定性差,因此研究天然色素的稳定性成为近年来的研究热点。
花色苷颜色的稳定性受pH值、氧气、温度、花色苷浓度和结构、光、酶,以及其他辅助因素的影响,其中温度是一个重要的影响因素[4]。然而,所有的这些因素并没有影响植物界中颜色的丰富多彩,其原因是由于辅色剂与花色苷形成了络合物,即发生了辅色作用。辅色作用被认为是能改善花色苷结构稳定性的一个重要方法。许多研究采用了添加辅色剂的方式来提高或者改善天然色素的稳定性[5]。辅色作用是指花色苷通过与无色或浅色的辅色剂相互作用而提高其颜色强度和化学稳定性,是一种提高花色苷稳定性的有效途径[6]。有机酸广泛存在于各类天然食品和加工食品中,是一类有效的辅色剂。本实验研究食品中常见的一些有机酸对紫甘薯花色苷色泽及稳定性的影响,为改善食品加工工艺,提高紫甘薯色素的着色效果提供理论依据。
1 材料与方法
1.1 材料与试剂
紫甘薯花色苷样品(E1≥60%)由湖北紫鑫生物科技有限公司提供。
咖啡酸、阿魏酸为分析纯,购自上海源叶生物科技有限公司;乙腈、甲酸为色谱纯,其他试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
LC-20高效液相色谱仪、UV-1750紫外-可见分光光度计 日本岛津公司;SP-752紫外-可见分光光度计上海光谱仪器有限公司;HH-6电热水浴锅 国华电器有限公司;FE20 pH计 梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 紫甘薯花色苷的吸收光谱扫描
用pH 4.0的0.2 mol/L醋酸-醋酸钠缓冲溶液配制0.1 mg/mL的紫甘薯花色苷溶液,在200~700 nm波长范围内进行光谱扫描。
1.3.2 有机酸对紫甘薯花色苷的辅色作用
用pH 4.0的0.2 mol/L醋酸-醋酸钠缓冲溶液配制0.2 mol/L的柠檬酸、DL-苹果酸、酒石酸溶液和1 mg/mL的紫甘薯花色苷溶液。取1 mL的紫甘薯花色苷溶液,分别加入不同量的柠檬酸、DL-苹果酸、酒石酸溶液后用pH 4.0的0.2 mol/L醋酸-醋酸钠缓冲溶液定容至10 mL,振荡15 min后暗置2 h,于450~700 nm波长范围内进行光谱扫描,记录最大吸光度和最大吸收波长。
由于咖啡酸和阿魏酸难溶于水,易溶于乙醇溶液,用50%乙醇溶液代替蒸馏水配制pH 4.0缓冲溶液,配制0.1 mol/L的咖啡酸和阿魏酸溶液,其他操作同上。
有机酸对紫甘薯花色苷的辅色效果的评价参照朱洪梅等[7]的方法,以每摩尔有机酸引起的紫甘薯花色苷吸光度增加量,即辅色度(I)表示。并以公式(2)来计算辅色后紫甘薯花色苷的增色率(U)。

式中:A为加入有机酸后溶液的吸光度;A0为纯花色苷溶液的吸光度;C为有机酸浓度/(mol/L)。
1.3.3 有机酸对紫甘薯花色苷热降解动力学参数的影响
用pH 4.0的0.2 mol/L醋酸-醋酸钠缓冲溶液分别配制0.1 mol/L的柠檬酸、DL-苹果酸和酒石酸的0.1 mg/mL紫甘薯花色苷溶液,0.015 mol/L咖啡酸、阿魏酸的0.1 mg/mL紫甘薯花色苷溶液,振荡15 min后暗置2 h。柠檬酸、DL-苹果酸、酒石酸的紫甘薯花色苷溶液分别在80、90、100 ℃恒温水浴加热,每隔1 h在533 nm波长处测吸光度;咖啡酸、阿魏酸的紫甘薯花色苷溶液分别在70、80、90 ℃恒温水浴加热,每隔0.5 h在533 nm波长处测吸光度,以公式(3)计算加热后紫甘薯花色苷的保留率(W)。

式中:A为加入有机酸后溶液的吸光度;A0为纯花色苷溶液的吸光度。
在恒温加热的条件下,花色苷的降解遵循一级降解动力学模型[8-9]。一级降解动力学模型的参数速率常数(k)、半衰期(t1/2)、活化能(Ea)和温度系数(Q10)的计算如公式(4)~(7)所示。

式中:Ct是在时间t(min)时的花色素苷含量/(mg/L);C0是花色素苷最初的含量/(mg/L);R是摩尔气体常数(8.314 J/(mol·K));T是绝对温度/K。
1.3.4 有机酸对紫甘薯花色苷成分的影响
紫甘薯花色苷溶液处理方式同1.3.2节。紫甘薯花色苷组分用高效液相色谱仪(high performance liquid chromatography,HPLC)测定。高效液相色谱条件为:HPLC仪器型号:岛津LC-20,紫外检测器;色谱柱:Eclipse plus-C18(4.6 mm×250 mm,5 μm);柱温:30 ℃;流动相A:2%甲酸水溶液;流动相B:2%甲酸水-乙腈(1∶1,V/V)溶液;进样量:10 μL;流速:1 mL/min,梯度洗脱:0~30 min,20%~50% B;30~35 min,50% B;35~40 min,50%~20% B;40~50 min,20% B。
1.4 统计与分析
实验操作重复3 次,采用SPSS 16.0软件进行多重比较分析。
2 结果与分析
2.1 pH 4.0条件下紫甘薯花色苷的紫外-可见吸收光谱

图1 pH4.0条件下紫甘薯花色苷的紫外-可见吸收光谱Fig.1 Absorption spectrum of purple sweet potato anthocyanins at pH 4.0
由图1可知,pH 4.0条件下,紫甘薯花色苷在紫外光区和可见光区均有吸收峰,在295、326、533 nm波长处有3 个吸收峰。
2.2 柠檬酸对紫甘薯花色苷的辅色效果

图2 柠檬酸对紫甘薯花色苷的辅色效果Fig.2 Copigmentation effect of citric acid on purple sweet potato anthocyanins
由图2可知,以不添加柠檬酸的紫甘薯花色苷为空白对照,当柠檬酸浓度≥0.01 mol/L时,紫甘薯花色苷的吸光度与空白相比差异性显著(P<0.05);当柠檬酸浓度≥0.02 mol/L时,与空白相比紫甘薯花色苷吸光度显著提高(P<0.01)。当柠檬酸浓度由0.01 mol/L逐渐上升时,紫甘薯花色苷的吸光度呈平缓的上升趋势,紫甘薯花色苷的最大吸收波长均为533 nm,保持不变。实验表明,柠檬酸对紫甘薯花色苷有辅色作用,这与Hubbermann等[10]关于柠檬酸对黑胡萝卜和接骨木花色苷有辅色作用的研究结果一致。
2.3 DL-苹果酸对紫甘薯花色苷的辅色效果
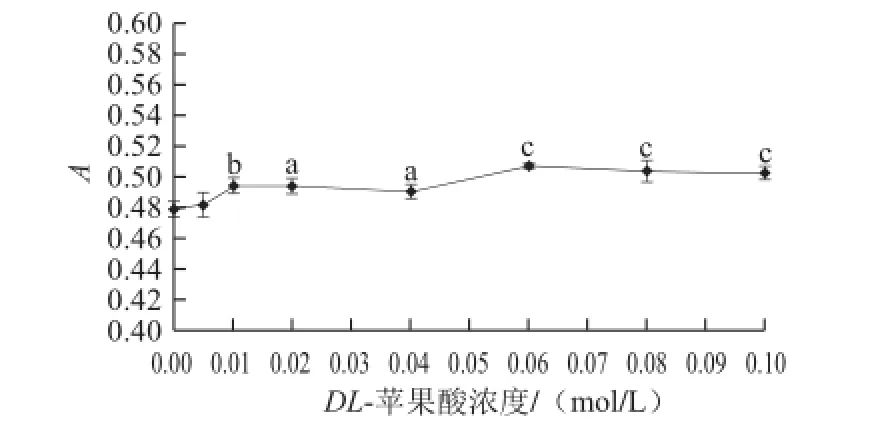
图3 3DL-苹果酸对紫甘薯花色苷的辅色效果Fig.3 Copigmentation effect of DL-malic acid on purple sweet potato anthocyanins
由图3可知,以不添加DL-苹果酸的紫甘薯花色苷为空白对照,当DL-苹果酸浓度≥0.01 mol/L时,紫甘薯花色苷的吸光度与空白比较差异性显著(P<0.05)。当DL-苹果酸浓度达到0.06 mol/L时,紫甘薯花色苷的吸光度与空白相比显著提高(P<0.001)。当DL-苹果酸浓度逐渐上升时,DL-苹果酸对紫甘薯花色苷的辅色作用呈上升趋势,紫甘薯花色苷的最大吸收波长均为533 nm,保持不变。实验结果表明DL-苹果酸对紫甘薯花色苷有辅色作用。
2.4 酒石酸对紫甘薯花色苷的辅色效果

图4 酒石酸对紫甘薯花色苷的辅色效果Fig.4 Copigmentation effect of tartaric acid on purple sweet potato anthocyanins
由图4可知,以不添加酒石酸的紫甘薯花色苷为空白对照,酒石酸浓度为0.02 mol/L时,酒石酸对紫甘薯花色苷吸光度与空白相比差异性显著(P<0.05),浓度达到0.04 mol/L时,差异性显著(P<0.01)。当酒石酸浓度大于0.04 mol/L时,与空白对比紫甘薯花色苷的吸光度显著提高(P<0.001)。从整体趋势来看,随酒石酸浓度提高,酒石酸对紫甘薯花色苷的辅色效果呈上升趋势,紫甘薯花色苷的最大吸收波长均为533 nm,保持不变。实验结果表明酒石酸对紫甘薯花色苷有辅色作用。
2.5 咖啡酸对紫甘薯花色苷的辅色效果
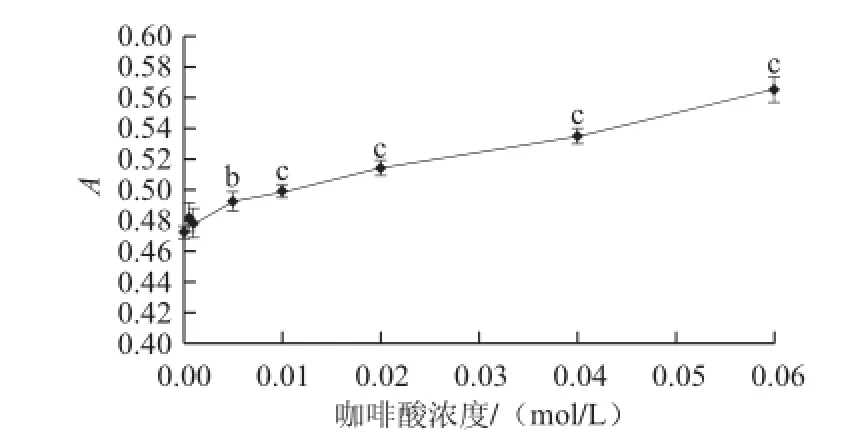
图5 咖啡酸对紫甘薯花色苷的辅色效果Fig.5 Copigmentation effect of caffeic acid on purple sweet potato anthocyanins
由图5可知,以不添加咖啡酸的紫甘薯花色苷为空白对照,当咖啡酸浓度为0.005 mol/L时,咖啡酸辅色后紫甘薯花色苷的吸光度与空白相比差异性显著(P<0.01),当浓度≥0.01 mol/L时,与空白对比紫甘薯花色苷吸光度显著提高(P<0.001)。实验结果表明咖啡酸对紫甘薯花色苷有辅色作用,并且从整体趋势来看,咖啡酸对紫甘薯花色苷的辅色作用随着咖啡酸浓度的增大而增强,紫甘薯花色苷的最大吸收波长均为533 nm,保持不变。
2.6 阿魏酸对紫甘薯花色苷的辅色效果
由图6可知,以不添加阿魏酸的紫甘薯花色苷为空白对照,阿魏酸的浓度达到0.005 mol/L时,阿魏酸对紫甘薯花色苷的吸光度与空白相比差异性显著(P<0.05),当阿魏酸浓度大于0.01 mol/L时,差异性显著(P<0.01),阿魏酸浓度达到0.04 mol/L时,阿魏酸对紫甘薯花色苷的吸光度与空白相比显著提高(P<0.001)。实验结果表明,阿魏酸对紫甘薯花色苷有辅色作用,并且随着阿魏酸浓度的上升,阿魏酸对紫甘薯花色苷的辅色效果逐渐增强,紫甘薯花色苷的最大吸收波长均为533 nm,保持不变。

图6 阿魏酸对紫甘薯花色苷的辅色效果Fig.6 Copigmentation effect of ferulic acid on purple sweet potato anthocyanins
2.7 5 种有机酸对紫甘薯花色苷的辅色效果比较

图7 5 种有机酸对紫甘薯花色苷辅色效果的比较Fig.7 Comparison of copigmentation effect of 5 organic acids on purple sweet potato anthocyanins
由图7可知,5 种有机酸在不同浓度处辅色度(I值)差异较大,说明这5 种有机酸对紫甘薯花色苷的辅色度与其浓度不呈线性关系,其中柠檬酸、DL-苹果酸和酒石酸的I值变化没有什么规律,咖啡酸和阿魏酸浓度越低,I值越大。柠檬酸浓度为0.01 mol/L时,对紫甘薯花色苷的辅色效果最佳。DL-苹果酸浓度为0.01 mol/L时,对紫甘薯花色苷的辅色效果最佳。酒石酸浓度为0.06 mol/L时,对紫甘薯花色苷的辅色效果最佳。当咖啡酸和阿魏酸浓度为0.000 5 mol/L时,I值最大,但是当咖啡酸和阿魏酸浓度小于0.005 mol/L时,紫甘薯花色苷的辅色度与空白对比差异性不显著(P<0.05),因此确定0.005 mol/L为咖啡酸和阿魏酸的最佳辅色浓度。
由图7可知,比较最佳辅色浓度处的I值,5 种有机酸的辅色效果按照强弱顺序依次为咖啡酸>阿魏酸>DL-苹果酸>柠檬酸>酒石酸。由图2~6可以看出,5 种有机酸的浓度为0.06 mol/L时,柠檬酸、DL-苹果酸、酒石酸、柠檬酸、咖啡酸和阿魏酸的增色率(U)分别为4.59%、5.95%、7.52%、19.69%和15.03%,由此可以看出,5 种有机酸的辅色效果按照强弱顺序依次为咖啡酸>阿魏酸>酒石酸>DL-苹果酸>柠檬酸。综合来看,咖啡酸和阿魏酸的辅色效果比柠檬酸、DL-苹果酸和酒石酸好。
2.8 有机酸辅色前后紫甘薯花色苷的HPLC图谱分析


图8 有机酸辅色前后紫甘薯花色苷的高效液相色谱图Fig.8 HPLC chromatogram of purple sweet potato anthocyanins with and without acids
由图8可知,5 种有机酸辅色后,与紫甘薯花色苷的高效液相色谱图相比较,没有产生新的峰,结合上述结果,5 种不同浓度有机酸辅色后,紫甘薯花色苷的最大吸收波长没有发生偏移,可以推测5 种有机酸辅色后紫甘薯花色苷没有生成新的花色苷衍生物,所有的溶液pH值均为4.0,因此排除pH值的变化对紫甘薯花色苷吸光度的影响。可能由于紫甘薯花色苷酰化程度高,难以再与有机酸发生共价结合生成新的花色苷衍生物,氢键和非共价结合力被认为是分子间共色形成的主要作用力[11],有机酸可能是通过氢键和疏水相互作用来达到辅色作用。
2.9 有机酸对紫甘薯花色苷热降解动力学参数的影响

表1 有机酸对紫甘薯花色苷热降解动力学参数的影响Table1 Kinetics parameters for the thermal degradation of purple sweet potato anthocyanins with acids
由表1可知,加入这5 种有机酸以后,紫甘薯花色苷的热降解符合一级热降解动力学。用50%乙醇替代蒸馏水配制的紫甘薯花色苷溶液与水缓冲溶液配制的紫甘薯花色苷溶液相比较,90 ℃水浴加热5 h,紫甘薯花色苷的保留率均为79.89%,相同温度水浴加热相同时间,紫甘薯花色苷的保留率基本相同,因此排除乙醇对紫甘薯花色苷热稳定性的影响。加入柠檬酸、DL-苹果酸、酒石酸以后,紫甘薯花色苷的速率常数皆小于空白组,半衰期都比空白组长,如90 ℃条件下,空白组的半衰期为15.3 h,柠檬酸、DL-苹果酸和酒石酸辅色后紫甘薯花色苷的半衰期分别为19.1、19.0 h和16.9 h,说明加入柠檬酸、DL-苹果酸、酒石酸能提高紫甘薯花色苷的热稳定性。空白组紫甘薯花色苷的活化能为64.73 kJ/mol,柠檬酸、DL-苹果酸和酒石酸、咖啡酸和阿魏酸辅色后紫甘薯花色苷的活化能分别为51.16、42.04、55.70、58.62、49.50 kJ/mol,均小于空白组,说明加入5 种有机酸辅色后,紫甘薯花色苷对温度的敏感度降低。加入咖啡酸和阿魏酸以后,在80 ℃和90 ℃条件下,紫甘薯花色苷的降解速率常数(k)与空白组相比有较大程度提高,半衰期有较大程度降低,90 ℃条件下咖啡酸和阿魏酸辅色后的紫甘薯花色苷半衰期分别降至1.8 h和1.6 h,约为空白组的1/9。文献[11-14]研究表明,在酚酸类中,阿魏酸被发现是非常稳定的共色素,能增强花色苷颜色和提高稳定性,咖啡酸也被证实是非常有效的共色素;咖啡酸能提高葡萄花色苷、紫玉米色素、胭脂萝卜红色素的稳定性。紫甘薯花色苷与葡萄花色苷[15]、紫玉米色素[13]和胭脂萝卜红色素[16]的区别在于紫甘薯花色苷包含咖啡酸酰化结构和阿魏酸酰化结构,可能是由于结构上的差异导致结果相反。
3 结 论
食品中存在的小分子有机酸中,柠檬酸、酒石酸、DL-苹果酸等羟基酸以及阿魏酸、咖啡酸等酚酸对紫甘薯色素有一定的辅色作用,综合比较5种有机酸最佳辅色浓度处的I值和相同浓度时有机酸的U值,可以看出咖啡酸和阿魏酸的辅色效果比柠檬酸、DL-苹果酸和酒石酸好。
这5 种有机酸辅色后,紫甘薯花色苷没有生成新的花色苷衍生物,有机酸可能是通过氢键和疏水相互作用与紫甘薯花色苷结合,减少水分子对花色苷的攻击,从而达到辅色效果。
柠檬酸、DL-苹果酸和酒石酸都不同程度地提高了色素的热稳定性,这与大多数文献数据结果一致;而作为大多数色素的有效辅色剂的咖啡酸和阿魏酸对紫甘薯色素热稳定性不利,可能与紫甘薯花色苷的结构有关,促降解机制尚不清楚。
参考文献:
[1] 王宇滨. 紫玉米花色苷稳定性的研究及其在酸奶中的应用[D]. 沈阳: 沈阳农业大学, 2010.
[2] 李杰. 紫甘薯色素苷的提取、组分分析及热稳定性研究[D]. 武汉:华中农业大学, 2012.
[3] FENNEMA O R. 食品化学[M]. 王璋, 译. 北京: 中国轻工业出版社, 1991: 464-468.
[4] CABRITA L, FOSSEN T, ANDERSEN M. Colour and stability of the six common anthocyandin 3-glucosides in aqueous solutions[J]. Food Chemistry, 2000, 68(1): 101-107.
[5] 金英实, 朱蓓薇. 食品添加剂对提高越桔色素稳定性的研究[J]. 大连轻工业学院学报, 2003, 22(3): 117-120.
[6] 王宇滨, 张超, 马越, 等. 几种有机酸对紫玉米花青素热稳定性的影响[J]. 食品科学, 2010, 31(7): 164-167.
[7] 朱洪梅, 韩永斌, 顾振新, 等. 单宁对紫甘薯花色苷的辅色作用研究[J].南京农业大学学报, 2006, 29(3): 98-102.
[8] GARZON G A, WROLSTAD R E. Comparison of the stability of pelargonidin-based anthocyanins in strawberry juice and concentrate[J]. Journal of Food Science, 2002, 67(4): 1288-1299.
[9] WANG Weidong, XU Shiying. Degradation kinetics of anthocyanins in blackberry juice and concentrate[J]. Journal of Food Engineering, 2007, 82(3): 271-275.
[10] HUBBERMANN E M, HEINS A, STÖCKMANN H, et al. Influence of acids, salt, sugars and hydrocolloids on the colour stability of anthocyanin rich black currant and elderberry concentrates[J]. European Food Research and Technology, 2006, 223(1): 83-90.
[11] 王峰, 邓洁红, 谭兴, 等. 花色苷及其共色作用研究进展[J]. 食品科学, 2008, 29(2): 472-476.
[12] GRIS E F, FERREIRA E A, FALCAO L D, et al. Caffeic acid copigmentation of anthocyanins from Cabernet Sauvignon grape extracts in model system[J]. Food Chemistry, 2007, 100(3): 1289-1296.
[13] 慕妮, 吴海浩, 顾振新, 等. 咖啡酸对紫玉米花色苷辅色作用研究[J].食品科学, 2010, 31(5): 58-62.
[14] 董楠, 宋会歌, 刘嘉, 等. 咖啡酸对胭脂萝卜红色素辅色作用及稳定性的影响[J]. 食品科学, 2011, 32(7): 61-64.
[15] FULCRAND H, BENABDELJALIL C, RIGAUD J, et al. A new class of wine pigments generated by reaction between pyruvic acid and grape anthocyanins[J]. Phytochemistry, 1998, 47(7): 1401-1407.
[16] 张媛媛. 萝卜红色素的提取及稳定性提高[D]. 广州: 华南理工大学, 2011.
Copigmentation Effect of Organic Acids on Purple Sweet Potato Anthocyanins
WANG Meng, LI Xiao-ding*, LIU Shuo, ZHU Shao-hua, JIANG Hong
(Key Laboratory of Environment Correlative Dietology, Ministry of Education, College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
The copigmentation is an effective way to enhance the color of anthocyanins. Copigmentation effects of citric acid, DL-malic acid, tartaric acid, caffeic acid and ferulic acid on purple sweet potato anthocyanins were studied. Results showed that these five organic acids increased the absorption value of purple sweet potato anthocyanins, but did not change the anthocyanin composition. The half-life (15.3 h) was increased by citric acid, DL-malic acid and tartaric acid to 19.1, 19.0 and 16.9 h at 90 ℃, but reduced by caffeic acid and ferulic acid to 1.8 and 1.6 h, respectively, indicating an unfavorable effect on the thermal stability of purple sweet potato anthocyanins.
purple sweet potato anthocyanins; organic acid; copigmentation; thermal stability
TS202.3
A
1002-6630(2014)23-0119-06
10.7506/spkx1002-6630-201423024
2014-01-02
王萌(1989—),女,硕士研究生,研究方向为天然产物化学。E-mail:wm-070707@163.com
*通信作者:李小定(1968—),男,副教授,博士,研究方向为粮食油脂与植物蛋白工程、天然产物化学。E-mail:lixd@mail.hzau.edu.cn
