局部晚期非小细胞肺癌p53蛋白表达与同步放化疗疗效的关系研究
2014-02-08汪宏斌杨俊泉
汪宏斌,杨俊泉
局部晚期非小细胞肺癌(locally advanced non-small cell lung cancer,LA-NSCLC)目前尚无统一、明确的定义,通常是指:肺癌侵犯到胸壁或膈肌(T3),或侵犯到纵隔、大血管、气管、食管和/或椎体等(T4);或者肺癌伴有同侧纵隔或隆突下淋巴结转移(N2),或锁骨上、对侧纵隔淋巴结转移(N3);尚未发生远处转移(M0)的患者,即ⅢA 或ⅢB 期,占非小细胞肺癌的30%~40%,其中80%以上由于局部肿瘤进展而无法手术切除[1-3]。联合放化疗已成为LA-NSCLC的标准治疗,美国国家综合癌症网(NCCN)也推荐LA-NSCLC行同步放化疗[4-6]。有研究表明:p53蛋白表达与非小细胞肺癌放化疗效果相关[7-8]。本研究回顾性分析了86例同步放化疗LA-NSCLC患者p53阳性表达情况,探讨p53蛋白表达与LA-NSCLC同步放化疗疗效的关系。
1 资料与方法
1.1 一般资料 选取唐山市人民医院2007年7月—2010年7月完成同步放化疗的86例局部晚期不可切除的非小细胞肺癌(ⅢA/ⅢB)初治患者,均有明确的组织病理学诊断,病理组织分型按世界卫生组织(WHO)组织学分类(1999)标准,临床分期按2009年国际抗癌联盟(UICC)肺癌TNM分期第7版标准;除外脑转移、骨转移及其他脏器转移者,无放化疗禁忌证。
86例患者中,男51例,女35例;年龄为35~73岁,中位年龄为59岁;鳞癌45例,腺癌37例,其他4例(腺鳞癌2例,大细胞癌2例);ⅢA期30例,ⅢB期56例;美国东部肿瘤协作组(ECOG)ZPS评分:0分29例,1分53例,2分4例。
1.2 治疗方法 放化疗前患者均行严格的分期检查,包括胸部CT,颅脑CT或MR,腹部CT或B超,全身骨骼核素扫描,常规检查心电图、血常规、尿常规、生化常规等。
放疗:采用6-MV直线加速器常规分割三维适形放疗,2 Gy/次,5次/周,总量(DT)60~70 Gy/6~7周。放疗在化疗结束后1 h内进行。适形放疗方法:患者平卧,双手抱头,热缩体膜固定,做体表定位标记点。西门子螺旋CT下平静呼吸后平扫加增强,扫描层厚5 mm,传输至医科达TPS工作站。一般设1~2个大体肿瘤靶区(GTV),GTV为CT确定的原发病灶和淋巴结(CT图像显示最短径>10 mm的淋巴结)。临床靶区(CTV)为GTV外放5~10 mm和受累淋巴引流区,不做淋巴引流区的预防性照射。计划靶区(PTV)为CTV外放5~10 mm,采用3~6个共面或非共面固定野。经剂量体积直方图(DVH)评价,90%以上的等剂量线包绕靶区,双肺照射20 Gy的体积(V20)<30%。放疗剂量至50 Gy后再行定位、确定和勾划靶区、制订治疗计划、完成治疗。
化疗:在放疗的第1天开始同步进行化疗,采用EP方案,即依托泊苷50 mg/m2第1~5天、第29~33天,顺铂50 mg/m2第1、8、29、36天。常规应用5-羟色胺受体阻断剂等药物防治恶心、呕吐。
1.3 观察指标
1.3.1 检测p53阳性表达率 试剂和免疫组织化学染色:p53单克隆抗体购自福州迈新生物技术开发有限公司,采用SP法:患者病理组织切片厚4 μm,高温高压抗原修复,严格按照试剂盒说明书进行染色。用已知阳性切片作为阳性对照,用磷酸盐缓冲液(PBS)代替第一抗体,作为阴性对照。随机选择10个高倍(×400)视野,对免疫组织化学染色结果进行评估。p53染色的判断标准为:细胞核染色为棕黄色者为阳性细胞,阳性细胞数≥10%为阳性表达;细胞核内未见染色颗粒或阳性细胞数<10%为阴性表达。
1.3.2 疗效 放疗结束1个月进行疗效评价,之后每3个月复查1次。疗效评价采用实体瘤客观疗效评价标准(RECIST):完全缓解(complete response,CR),所有目标病灶消失,至少维持4周;部分缓解(partial response,PR),基线病灶最大径之和至少减少30%,至少维持4周;病变进展(progression disease,PD),基线病灶最大径之和至少增加20%或出现新病灶;病变稳定(stable disease,SD),基线病灶最大径之和有减少但未达PR或有增加但未达PD。CR+PR计算客观有效率(objective response rate,ORR),CR+PR+SD计算疾病控制率(disease control rate,DCR),经1个月后检查确认。总生存期(overall survival,OS)为治疗首日至死亡日或失访日;无进展生存期(progression free survival,PFS)指治疗首日至病变进展日,OS和PFS均以月计。随访截至2012年7月,以月为时间单位,中位随访时间16个月(7~49个月)。
1.4 统计学方法 采用SPSS 16.0统计软件包进行统计检验。计数资料比较采用χ2检验或Fisher确切概率法;Kaplan-Meier曲线比较采用Log-rank检验。检验水准α=0.05。
2 结果
2.1 p53蛋白表达与临床病理特征的关系 本组患者p53阳性表达率为48.8%(42/86)。不同性别、年龄、临床分期、病理类型、ECOG ZPS评分者,其p53阳性表达率间差异均无统计学意义(P>0.05,见表1)。
表1 不同临床病理特征者p53蛋白表达情况比较〔n(%)〕
Table 1 Comparison of p53 expressions in patients with different clinical features
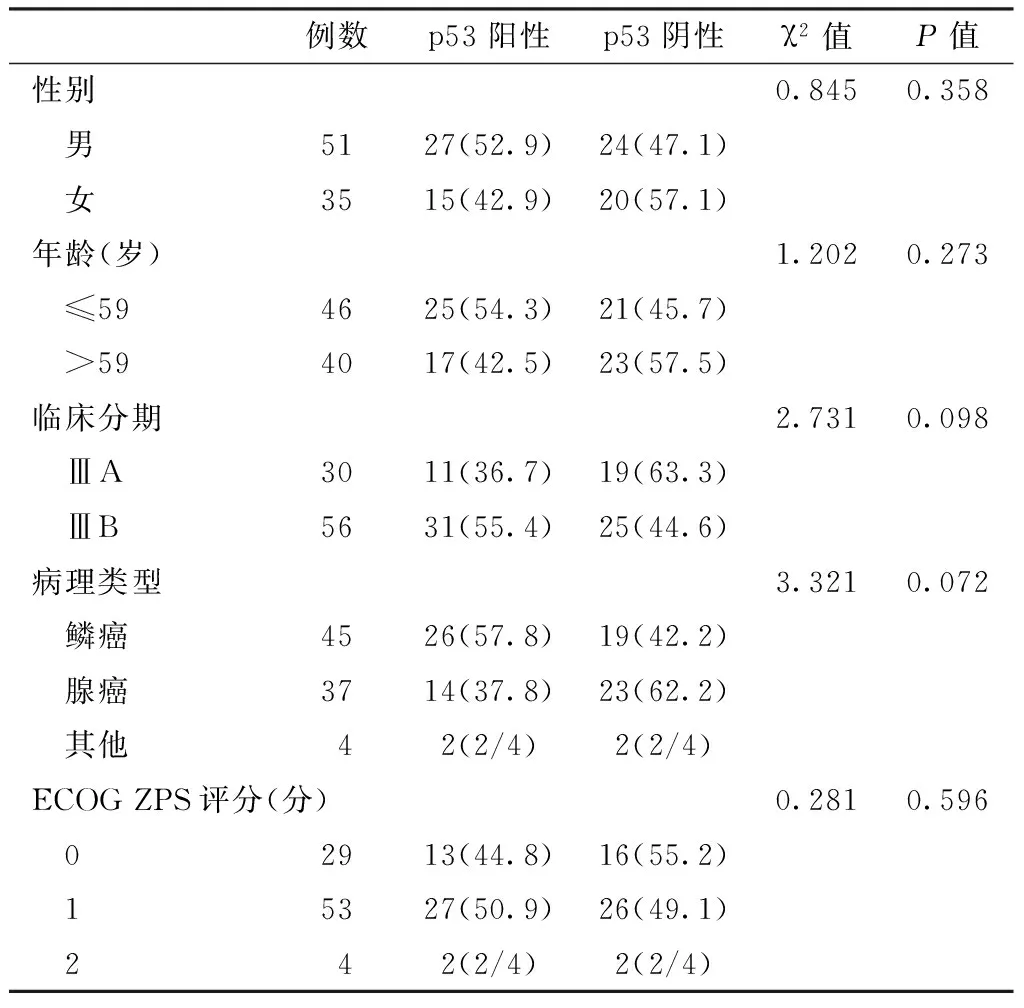
例数p53阳性p53阴性χ2值P值性别0.8450.358 男5127(52.9)24(47.1) 女3515(42.9)20(57.1)年龄(岁)1.2020.273 ≤594625(54.3)21(45.7) >594017(42.5)23(57.5)临床分期2.7310.098 ⅢA3011(36.7)19(63.3) ⅢB5631(55.4)25(44.6)病理类型3.3210.072 鳞癌4526(57.8)19(42.2) 腺癌3714(37.8)23(62.2) 其他 4 2(2/4)2(2/4)ECOGZPS评分(分)0.2810.596 02913(44.8)16(55.2) 15327(50.9)26(49.1) 2 4 2(2/4)2(2/4)
注:ECOG=美国东部肿瘤协作组;病理类型中的其他类型未进行统计分析,ECOG ZPS评分中的2分者未进行统计分析
2.2 客观疗效 放疗结束后1个月评价患者的客观疗效,其中CR 30例,PR 27例,SD 26例,PD 3例,计算出ORR为66.3%(57/86),DCR为96.5%(83/86);p53阳性者ORR为54.8%(23/42),p53阴性者ORR为77.3%(34/44),两组ORR比较,差异有统计学意义(χ2=4.872,P=0.027);两组DCR分别为95.2%(40/42)和97.7%(43/44),差异无统计学意义(Fisher确切概率法,P>0.05)。
2.3 远期疗效 本组患者中位OS为16个月,其中p53阳性组为15个月,p53阴性组为19个月。86例患者1、2、3年生存率分别为:79.1%(68/86)、39.5%(34/86)、26.7%(23/86);其中p53阳性组1、2、3年生存率分别为73.8%(31/42)、35.7%(15/42)、21.4%(9/42),p53阴性组分别为84.1%(37/44)、43.2%(19/44)、31.8%(14/44)。Kaplan-Meier生存分析显示两组患者OS间差异有统计学意义(χ2=4.146,P=0.042,见图1)。
本组患者中位PFS为13个月,其中p53阳性组为12个月,p53阴性组为15个月。p53阳性组1、2、3年无进展生存率分别为54.8%(23/42)、28.6%(12/42)、19.0%(8/42),p53阴性组分别为68.2%(30/44)、40.9%(18/44)、31.8%(14/44)。Kaplan-Meier生存分析显示两组患者PFS间差异有统计学意义(χ2=4.293,P=0.038,见图2)。
3 讨论
肺癌的发病率和致死率皆为恶性肿瘤之首,严重威胁着人类健康。非小细胞肺癌约占所有肺癌病例的80%,约40%的非小细胞肺癌患者就诊时已为局部晚期,不到20%的LA-NSCLC患者有手术切除机会。对于不能手术的LA-NSCLC,单纯放疗的中位生存期仅为9~11个月。由于癌细胞有异质性,放疗的作用主要针对的是G1、M、G2期的癌细胞,而对活跃的S期的癌细胞无作用;但大多数化疗药物作用于S期的癌细胞,故放疗联合化疗可以发挥更大的作用。序贯性放化疗效果优于单纯放疗,中位生存期延长3~4个月(从10个月延长到13~14个月);同步放化疗具有空间协同作用、细胞周期时相协同作用、影响DNA损伤和修复。故同步放化疗比序贯性放化疗延长中位生存期3~4个月(达17个月),3年时绝对受益率为5.7%(23.8%∶18.1%),5年为4.5%(15.1%∶10.6%)[1-4,6,9]。因此,同步放化疗已成为LA-NSCLC的标准治疗方法。化疗方案多采用EP方案,冯勤付等[9]采用新化疗药物和新方案,但未显示出优势,且其毒性大。故本研究仍采用EP方案。

图1 p53阴性组与p53阳性组LA-NSCLC患者总生存期的Kaplan-Meier生存分析
Figure 1 Kaplan-Meier curves for overall survival of p53 positive and p53 negative patients with LA-NSCLC

图2 p53阴性组和p53阳性组LA-NSCLC患者无进展生存期的Kaplan-Meier生存分析
Figure 2 Kaplan-Meier curves for progression free survival of p53 positive and p53 negative patients with LA-NSCLC
三维适形放疗能精确确认靶区和正常组织,有更好的靶区适形度和剂量均匀性,能减少正常组织照射体积和剂量。LA-NSCLC三维适形放疗已取得约18个月的中位生存期、约40%的2年局部控制率和生存率,并发症发生率降低或无明显增加[9]。本研究结果显示:LA-NSCLC患者同步放化疗后中位OS为16个月,1、2、3年生存率分别为79.1%、39.5%和26.7%,与以往文献[9]报道相似。
p53基因是肿瘤抑癌基因家族中的重要成员之一,也是人类肿瘤中出现频率最高的肿瘤抑制基因,对细胞分裂和增殖起负向调节作用。野生型p53基因是维持细胞基因稳定和完整的卫士,与肿瘤的发生发展密切相关。突变型p53丧失了抑癌基因的功能,还获得了促进细胞恶性转化的癌基因功能。p53基因的突变或缺失是肺癌中最常见的基因改变。野生型p53蛋白在体内以四聚体形式存在,t1/2仅为6~20 min;而突变型p53蛋白由于其构象改变,稳定性增加,t1/2较长(4~12 h),使其可以蓄积到能够检测到的水平。故用免疫组织化学方法检测到的常是突变型p53蛋白。一般认为突变型p53蛋白在非小细胞肺癌中的阳性表达率约为50%,在小细胞肺癌中的阳性表达率约为75%[10-11]。本研究结果显示,86例LA-NSCLC患者中,p53阳性表达率为48.8%,且p53蛋白表达与性别、年龄、临床分期、病理类型及ECOG ZPS评分无关。
p53蛋白表达与非小细胞肺癌化疗敏感性的研究报道不尽相同。余辉等[7]研究提示,术后化疗组p53阳性者和阴性者的预期3年生存率分别是12.5%和68.5%(P=0.016);Cox多因素分析结果显示p53是影响术后化疗的独立指标。而汪进良等[12]Meta分析表明,非小细胞肺癌p53阴性者对铂类药物化疗敏感性并不明显优于p53阳性患者。Matsuzoe等[13]研究表明,p53基因突变的非小细胞肺癌患者放疗ORR(15.4%)低于p53野生型(61.9%,P=0.013)。余辉等[7]研究表明,非小细胞肺癌患者术后放疗组中p53阳性者和阴性者的2年生存率分别是26.8%和85.7%(P=0.031)。
p53蛋白表达与非小细胞肺癌同步放化疗疗效的关系尚未见报道,本研究结果显示:p53阳性组ORR为54.8%,明显低于p53阴性组的77.3%。p53阳性组中位OS为15个月,阴性组为19个月;p53阳性组1、2、3年生存率分别为73.8%、35.7%、21.4%,而p53阴性组分别为84.1%、43.2%、31.8%,提示p53阴性者预后好,且对放化疗的敏感性较高。有研究报道,p53基因治疗非小细胞肺癌可提高疗效[14-15]。为了进一步提高非小细胞肺癌的疗效,我们正在进行重组人腺病毒p53注射液(今又生)联合同步放化疗治疗LA-NSCLC的临床试验,结果待总结。
1 van Meerbeeck JP,Meersschout S,De Pauw R,et al.Modern radiotherapy as part of combined modality treatment in locally advanced non-small cell lung cancer:present status and future prospects[J].Oncologist,2008,13(6):700-708.
2 林展,严浩林,朱海生,等.阿米福汀在局部晚期非小细胞肺癌放疗中的作用研究[J].中国全科医学,2013,16(4):1247.
3 Rengan R,Maity AM,Stevenson JP,et al.New strategies in non-small cell lung cancer:improving outcomes in chemoradiotherapy for locally advanced disease[J].Clin Cancer Res,2011,17(13):4192-4199.
4 李付海,石安辉,朱广迎.局部晚期非小细胞肺癌同步放化疗进展[J].中国肿瘤,2009,18(10):831-834.
5 于金明,孙新东.局部晚期非小细胞肺癌累及野照射的研究进展[J].中华放射肿瘤学杂志,2005,14(4):338-341.
6 Auperin A,Le Pechoux C,Rolland E,et al.Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small-cell lung cancer[J].J Clin Oncol,2010,28(13):2181-2190.
7 余辉,吴一龙,戎铁华,等.非小细胞肺癌组织中p53蛋白的表达对预后及术后化放疗疗效的影响[J].肿瘤研究与临床,2006,18(1):16-18.
8 唐怀民,黄根池.血清VEGF和p53抗体与非小细胞肺癌的相关性研究[J].实用心脑肺血管病杂志,2011,19(9):1469.
9 冯勤付,陈雪松.局部晚期非小细胞肺癌的放疗进展[J].中华放射肿瘤学杂志,2007,16(4):317-320.
10 Berghmans T,Mascaux C,Martin B,et al.Prognostic role of p53 in stage Ⅲ non-small cell lung cancer[J].Anticancer Res,2005,25(3c):2385-2389.
11 Uramoto H,Sugio K,Oyama T,et al.Expression of the p53 family in lung cancer[J].Anticancer Res,2006,26(3A):1785-1790.
12 汪进良,焦顺昌,叶平,等.非小细胞肺癌患者p53蛋白异常表达与铂类化疗敏感性的Meta分析[J].南方医科大学学报,2008,28(5):770-773.
13 Matsuzoe D,Hideshima T,Kimura A,et al.p53 mutations predict non-small cell lung carcinoma response to radiotherapy[J].Cancer Lett,1999,135(2):189-194.
14 Guan YS,Liu Y,Zou Q,et al.Adenovirus-mediated wild-type p53 gene transfer in combination with bronchial arterial infusion for treatment of advanced non-small-cell lung cancer,one year follow-up[J].J Zhejiang Univ Sci B,2009,10(5):331-340.
15 Mogi A,Kuwano H.TP53 mutations in nonsmall cell lung cancer[J].J Biomed Biotechnol,2011,2011:583929.
