散发性结直肠癌患者错配修复基因蛋白表达水平及其临床意义
2014-02-08于显博王海江孙振强许睿玮赵泽亮
于显博,王海江,孙振强,许睿玮,赵泽亮,张 烁
结直肠癌是常见的恶性消化道肿瘤,且发病率呈逐渐增高趋势,造成的危害也日益严重[1-3]。结直肠癌的发生、发展是十分复杂的过程,涉及多个肿瘤相关基因的参与,包括癌基因的激活、抑癌基因的失活和错配修复基因(mismatch repair gene,MMR)的突变以及基因启动子甲基化等[4-5]。目前发现的MMR包括7种,即hMLH1、hMSH2、hMSH6、hPSM1、hPSM2、hMSH3、hMSH5,其表达产物是一种核酸水解酶,可纠正DNA复制过程中错配的碱基,使复制过程更具保真性,并与肿瘤患者某些临床病理特征有一定的关系。本研究采用免疫组织化学染色方法检测404例新疆散发性结直肠癌患者肿瘤切除标本hMLH1、hMSH2、hPSM2、hMSH6蛋白表达水平,并探讨其与患者临床病理特征之间的关系,现报道如下。
1 对象与方法
1.1 研究对象 选择新疆医科大学附属肿瘤医院2009年5月—2012年6月收治的散发性结直肠癌患者404例为研究对象,均经术后病理证实,其中男233例,女171例;年龄25~81岁,平均63.2岁;排除符合Amsterdam Ⅱ诊断标准的遗传性非息肉病性结直肠癌(hereditary non-polyposis colorectal cancer,HNPCC)、术前接受过放化疗及资料不全患者。
1.2 相关定义 (1)BMI:以BMI<18.5 kg/m2为偏瘦,18.5~23.9 kg/m2为正常,24.0~27.9 kg/m2为超重,≥28.0 kg/m2为肥胖;(2)贫血:男性Hb<120 g/L,女性Hb<115 g/L。
1.3 方法 收集上述患者肿瘤切除标本,40 g/L中性甲醛固定,常规石蜡包埋,5 μm厚连续切片,采用PV-9000二步法检测hMLH1、hMSH2、hPSM2、hMSH6蛋白表达水平,hMLH1、hMSH2、hMSH6、hPSM2一抗鼠抗人单克隆抗体购自北京中杉金桥生物有限公司,工作浓度均为1∶150;通用型两步法(HRP)检测试剂盒购自福建迈新生物制品有限公司。采用磷酸盐缓冲液(PBS缓冲液)替代一抗做阴性对照,以正常结直肠黏膜上皮和/或浸润的淋巴细胞为阳性对照。
1.4 hMLH1、hMSH2、hPSM2、hMSH6阳性判断标准 参考许良中等[6]制定的“免疫组织化学反应结果的判断标准”,结合染色强度和阳性细胞百分比进行判断。hMLH1、hMSH2、hPSM2、hMSH6均在细胞核表达,在光镜下每张切片选取癌细胞较多的5个高倍镜视野,每个视野计数100个细胞。按染色强度分级:细胞核无着色计0分,淡黄色计1分,黄色计2分,棕黄色计3分;按阳性细胞百分比分级:无阳性细胞计0分,阳性细胞数≤10%计1分,11%~50%计2分,51%~75%计3分,>75%计4分;最后将两项得分相乘结果≥2分为阳性表达,<2分为阴性表达。阳性对照阳性判断标准为正常结直肠黏膜上皮和/或浸润的淋巴细胞核染色阳性,阴性判断标准为细胞核染色缺失。
1.5 统计学方法 采用SPSS 13.0统计软件进行数据分析,计数资料的比较采用χ2检验;多因素分析采用Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 hMLH1、hMSH2、hPSM2、hMSH6蛋白表达情况 404例标本中,共110例hMLH1、hMSH2、hPSM2、hMSH6蛋白表达缺失(见图1),MMR表达缺失率为27.23%,其中hMLH1独立表达缺失17例,hMSH2独立表达缺失9例,hPSM2独立表达缺失7例,hMSH6独立表达缺失5例;hMLH1/hPSM2联合表达缺失29例,hMSH2/hMSH6联合表达缺失17例,hMLH1/hMSH2联合表达缺失7例,hMLH1/hMSH6联合表达缺失5例,hMSH2/hPSM2联合表达缺失4例,hMLH1/hMSH2/hMSH6联合表达缺失3例,hMSH2/hMSH6/hPSM2联合表达缺失4例,hMLH1、hMSH2、hPSM2、hMSH6同时表达缺失3例。

注:A1、B1、C1、D1分别为hMLH1、hMSH2、hPSM2、hMSH6蛋白正常表达,A2、B2、C2、D2分别为hMLH1、hMSH2、hPSM2、hMSH6蛋白表达缺失
图1 hMLH1、hMSH2、hPSM2、hMSH6蛋白表达情况(免疫组织化学染色,×100)
Figure1 Protein expressions of hMLH1,hMSH2,hPSM2,hMSH6
2.2 单因素分析 将294例hMLH1、hMSH2、hPSM2、hMSH6蛋白表达正常患者列为A组,110例表达缺失患者列为B组,两组患者年龄、性别、民族、贫血发生率、肿瘤直径、肿瘤类型、TNM分期比较,差异均无统计学意义(P>0.05),两组患者BMI、肿瘤位置、肿瘤分化程度、肿瘤家族史比较,差异均有统计学意义(P<0.05,见表1)。
2.3 多因素分析 以单因素分析有统计学差异的临床病理特征为自变量(BMI≤24 kg/m2=1,BMI≥24kg/m2=0;高、中分化腺癌=1,低分化腺癌、黏液腺癌、印戒细胞癌=0;左半结肠、直肠=1,右半结肠=0;肿瘤家族史阴性=1,肿瘤家族史阳性=0),以hMLH1、hMSH2、hPSM2、hMSH6蛋白表达缺失为因变量(是=0,否=1)进行多因素Logistic回归分析,结果显示BMI、肿瘤分化程度、肿瘤位置、肿瘤家族史对回归方程的影响有统计学意义(P<0.05,见表2)。
表2 hMLH1、hMSH2、hPSM2、hMSH6蛋白表达缺失与散发性结直肠癌患者临床病理特征关系的多因素分析结果
Table2 Correlation between protein expressions deficiency of hMLH1,hMSH2,hPSM2,hMSH6 and clinical pathological features in patients with sporadic colorectal carcinoma by multivariate analysis
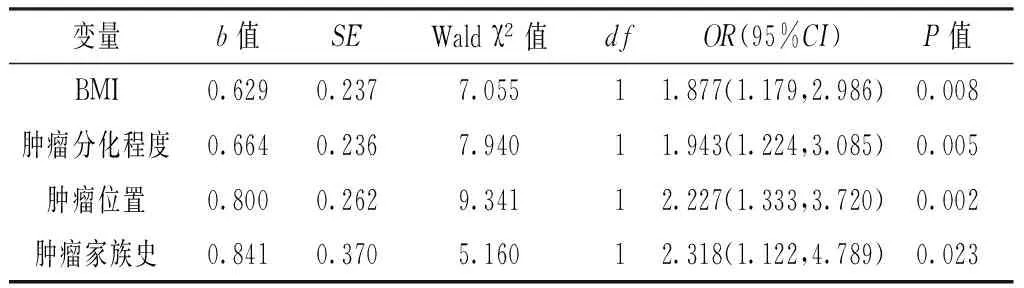
变量b值SEWaldχ2值dfOR(95%CI)P值BMI0.6290.2377.05511.877(1.179,2.986)0.008肿瘤分化程度0.6640.2367.94011.943(1.224,3.085)0.005肿瘤位置0.8000.2629.34112.227(1.333,3.720)0.002肿瘤家族史0.8410.3705.16012.318(1.122,4.789)0.023
3 讨论
结直肠癌分为遗传性和散发性两种,其中散发性结直肠癌约占全部结直肠癌的85%[7-8],HNPCC是遗传性结直肠癌中研究较多且发病机制较明确的,其遗传学基础被认为与MMR的种系突变密切相关[9],且约15%的散发性结直肠癌有着与HNPCC相同的发病机制[10]。MMR在生物进化过程中扮演着重要的角色,DNA复制过程十分精细但常会出现碱基错配,当发生碱基错配时MMR蛋白开始发挥作用,它们识别并修复错配的碱基、维持基因组的稳定性,但当MMR存在缺陷不能完整表达时,就会加剧DNA突变频率,最终导致肿瘤的发生。目前,hMLH1和hMSH2突变是MMR中研究最多的,共占MMR突变的80%以上,其表达缺失与自身甲基化的发生密切相关[11-12],且两者的表达情况对微卫星不稳定(microsatellite instability,MSI)的存在有很好的预测价值[13],而多数研究表明MSI的存在预示更好的预后[14-15]。
表1 hMLH1、hMSH2、hPSM2、hMSH6蛋白表达缺失与散发性结直肠癌患者临床病理特征关系的单因素分析结果
Table1 Correlation between protein expressions deficiency of hMLH1,hMSH2,hPSM2,hMSH6 and clinical pathological features in patients with sporadic colorectal carcinoma by univariate analysis
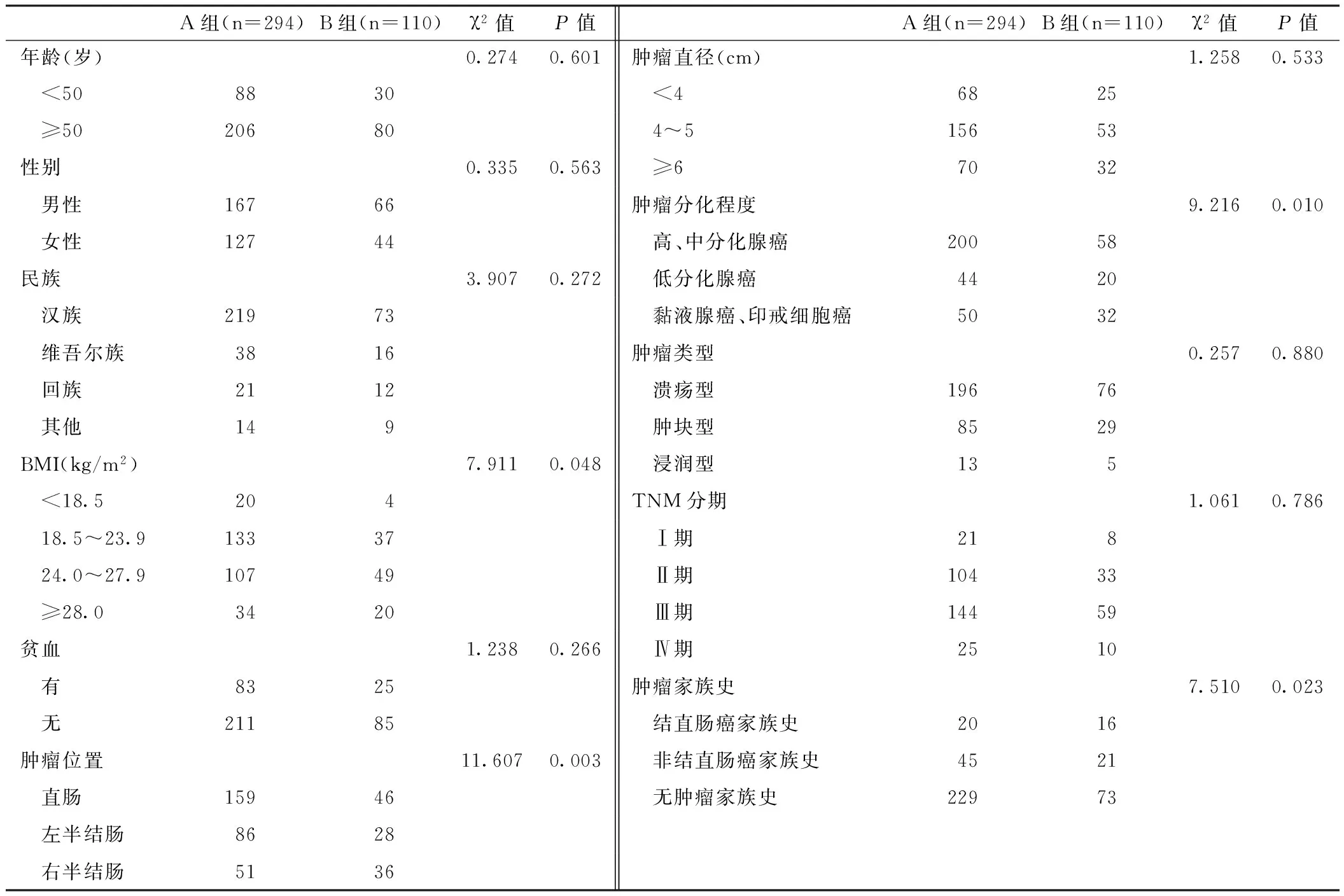
A组(n=294)B组(n=110)χ2值P值A组(n=294)B组(n=110)χ2值P值年龄(岁)0.2740.601肿瘤直径(cm)1.2580.533 <508830 <46825 ≥5020680 4~515653性别0.3350.563 ≥67032 男性16766肿瘤分化程度9.2160.010 女性12744 高、中分化腺癌20058民族3.9070.272 低分化腺癌4420 汉族21973 黏液腺癌、印戒细胞癌5032 维吾尔族3816肿瘤类型0.2570.880 回族2112 溃疡型19676 其他149 肿块型8529BMI(kg/m2)7.9110.048 浸润型135 <18.5204TNM分期1.0610.786 18.5~23.913337 Ⅰ期218 24.0~27.910749 Ⅱ期10433 ≥28.03420 Ⅲ期14459贫血1.2380.266 Ⅳ期2510 有8325肿瘤家族史7.5100.023 无21185 结直肠癌家族史2016肿瘤位置11.6070.003 非结直肠癌家族史4521 直肠15946 无肿瘤家族史22973 左半结肠8628 右半结肠5136
注:其他民族包括哈萨克族、蒙古族、锡伯族、满族;右半结肠癌包括回盲部癌、升结肠癌、结肠肝曲癌、横结肠癌,左半结肠癌包括结肠脾曲癌、降结肠癌、乙状结肠癌
Lindor等[16]通过对1 114例散发性结直肠癌患者进行检测发现,其中20.4%患者存在hMLH1蛋白表达缺失,8.8%存在hMSH2蛋白表达缺失,且hMLH1蛋白表达缺失率高于hMSH2蛋白。本研究结果显示,hMLH1蛋白表达缺失率为15.84%(64/404),hMSH2蛋白表达缺失率为11.63%(47/404),hMLH1蛋白表达缺失率高于hMSH2蛋白,提示hMLH1和hMSH2突变在散发性结直肠癌的发生、发展中有一定作用;而hMLH1蛋白表达缺失率高的原因是hMLH1基因启动子区域CpG岛易被甲基化,从而导致转录和翻译障碍,最终造成表达缺失[11],hMSH2表达缺失主要是由错义突变(missense mutations)引起[17]。Bellizzi等[18]研究指出,MMR蛋白表达缺失与结直肠癌患者某些临床病理特征有一定相关性,在结直肠癌的临床诊治中具有重要的指导意义。本研究进行的单因素分析和多因素Logistic回归分析结果均显示,hMLH1、hMSH2、hPSM2、hMSH6蛋白表达正常患者与表达缺失患者间BMI、肿瘤位置、肿瘤分化程度、肿瘤家族史存在明显差异,提示hMLH1、hMSH2、hPSM2、hMSH6蛋白表达与散发性结直肠癌患者BMI、肿瘤位置、肿瘤分化程度、肿瘤家族史有一定相关性。
目前,随着人们生活水平的提高及膳食结构的变化,多肉食少纤维的饮食习惯导致超重、肥胖者越来越多,而多数研究表明肥胖与结直肠癌的发病有着密切联系[19]。本组患者中,hMLH1、hMSH2、hPSM2、hMSH6蛋白表达缺失患者中超重、肥胖者所占比例更高,提示超重、肥胖的散发性结直肠癌患者MMR蛋白更容易出现表达缺失,与文献报道一致[20-21]。但Duval等[22]研究认为MMR蛋白表达缺失会导致胰岛素样生长因子受体(IGFR)突变,而肥胖是否会影响MMR蛋白表达缺失的结直肠癌患者IGFR突变尚不可知,肥胖与MMR蛋白表达缺失之间的相关性还有待于进一步研究明确。本组患者中,hMLH1、hMSH2、hPSM2、hMSH6蛋白表达缺失患者多为低分化腺癌、黏液腺癌、印戒细胞癌,与文献报道一致[16,23],提示分化程度低的散发性结直肠癌患者MMR蛋白更容易出现表达缺失,其原因可能与低分化腺癌、黏液腺癌、印戒细胞癌的病理组织学特征多表现为MSI-H(MSI-high)有关。此外,本组患者中,hMLH1、hMSH2、hPSM2、hMSH6蛋白表达缺失患者肿瘤多位于右半结肠,与文献报道一致[24-25],提示肿瘤位于右半结肠的散发性结直肠癌患者MMR蛋白更容易出现表达缺失,右半结肠癌与直肠癌、左半结肠癌患者存在差异,分析其原因与右半结肠癌发生阶段可能存在更高比例的基因启动子甲基化、病理组织学特征倾向于MSI-H表达及右半结肠与左半结肠、直肠生物学和分子学特征不同有关[26],MMR蛋白表达可能更多地参与肿瘤发生的早期阶段。Aaltonen等[27]研究指出,结直肠癌患者中有遗传病史者占15%~20%,且HNPCC占有一定比例(1%~6%),而结直肠癌发病机制与MMR蛋白表达缺失密切相关,但有关结直肠癌家族史阳性患者发病机制与MMR蛋白表达缺失的关系研究报道较少。本组患者中,hMLH1、hMSH2、hPSM2、hMSH6蛋白表达缺失患者肿瘤家族史阳性所占比例更高,提示肿瘤家族史阳性的散发性结直肠癌患者MMR蛋白更容易出现表达缺失,与Molaei等[24]研究报道一致,肿瘤家族史阳性散发性结直肠癌患者的发病机制与MMR蛋白表达密切相关。
研究表明,MMR蛋白表达缺失的散发性结直肠癌患者有着更好的预后[28],且无贫血者预后更好[29]。本研究结果显示,hMLH1、hMSH2、hPSM2、hMSH6蛋白表达正常患者与表达缺失患者间年龄、性别、民族、贫血发生率、肿瘤直径、肿瘤类型、TNM分期均无明显差异,分析其原因主要有以下两个方面:(1)新疆地区人群构成特殊,而本研究中少数民族患者数量较少,未能分析不同民族间MMR蛋白表达差异;(2)本研究以hMLH1、hMSH2、hPSM2、hMSH6蛋白中任意一种蛋白表达阴性即判定为MMR蛋白表达缺失,未单独对每种蛋白表达缺失情况与患者临床病理特征间的相关性进行分析。因此,需在今后的研究中开展更大样本量及更细致的研究,进一步深入研究其作用机制。
综上所述,新疆地区散发性结直肠癌患者存在MMR蛋白表达缺失,且其表达缺失与患者BMI、肿瘤位置、肿瘤分化程度、肿瘤家族史有关,采用免疫组织化学染色方法检测MMR蛋白表达对判断散发性结直肠癌病情及预后具有重要的指导意义。
1 方阳,张筱骅,夏建福.人表皮生长因子受体-2与拓扑异构酶Ⅱ在结直肠癌中的表达及意义[J].中国医刊,2012,47(10): 59.
2 陈明科,曾家耀.国内关于结直肠癌组织血管内皮细胞生长因子表达及其意义的Meta分析[J].中国全科医学,2012,15(12):4205.
3 朱朝英,周建荣.结直肠癌患者术后住院期间真实体验的现象学研究[J].中国全科医学,2012,15(6):2004.
4 Kotepui M,Piwkham D,Songsri A,et al.Histopathology analysis of benign colorectal diseases and colorectal cancer in Hatyai Hospital,Songkhla,Thailand[J].Asian Pac J Cancer Prev,2013,14(4):2667-2671.
5 常春.CD44v6与结直肠癌浸润和转移关系的研究[J].海南医学院学报,2011,17(6):731-734.
6 许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,2006,6(4):229-231.
7 Markowitz SD,Bertagnolli MM.Molecular origins of cancer:Molecular basis of colorectal cancer[J].N Engl J Med,2009,361(25):2449-2460.
8 侯立朝,王海久,樊海宁,等.胃肠减压在择期结直肠癌术后有效性和安全性的Meta分析[J].中国全科医学,2012,15(6):2071.
9 Wei W,Liu F,Liu L,et al.Distinct mutations in MLH1 and MSH2 genes in hereditary non-polyposis colorectal cancer(HNPCC)families from China[J].BMB Rep,2011,44(5):317-322.
10 Win AK,Young JP,Lindor NM,et al.Colorectal and other cancer risks for carriers and noncarriers from families with a DNA mismatch repair gene mutation:a prospective cohort study[J].J Clin Oncol,2012,30(9):958-964.
11 Poynter JN,Siegmund KD,Weisenberger DJ,et al.Molecular characterization of MSI-H colorectal cancer by MLHI promoter methylation,immunohistochemistry,and mismatch repair germline mutation screening[J].Cancer Epidemiol Biomarkers Prev,2008,17(11):3208-3215.
12 Zhang H,Fu WL,Huang Q.Mapping of the methylation pattern of the hMSH2 promoter in colon cancer,using bisulfite genomic sequencing[J].J Carcinog,2006,5:22.
13 Shia J.Immunohistochemistry versus microsatellite instability testing for screening colorectal cancer patients at risk for hereditary nonpolyposis colorectal cancer syndrome.Part Ⅰ.The utility of immunohistochemistry[J].J Mol Diagn,2008,10(4):293-300.
14 Merok MA,Ahlquist T,Røyrvik EC,et al.Microsatellite instability has a positive prognostic impact on stage Ⅱ colorectal cancer after complete resection:results from a large,consecutive Norwegian series[J].Ann Oncol,2013,24(5):1274-1282.
15 Sinicrope FA,Sargent DJ.Molecular pathways:microsatellite instability in colorectal cancer:prognostic,predictive,and therapeutic implications[J].Clin Cancer Res,2012,18(6):1506-1512.
16 Lindor NM,Burgart LJ,Leontovich O,et al.Immunohistochemistry versus microsatellite instability testing in phenotyping colorectal tumors[J].J Clin Oncol,2002,20(4):1043-1048.
17 Belvederesi L,Bianchi F,Galizia E,et al.MSH2 missense mutations and HNPCC syndrome:pathogenicity assessment in a human expression system[J].Hum Mutat,2008,29(11):E296-E309.
18 Bellizzi AM,Frankel WL.Colorectal cancer due to deficiency in DNA mismatch repair function:a review[J].Adv Anat Pathol,2009,16(6):405-417.
19 Campbell PT,Cotterchio M,Dicks E,et al.Excess body weight and colorectal cancer risk in Canada:associations in subgroups of clinically defined familial risk of cancer[J].Cancer Epidemiol Biomarkers Prev,2007,16(9):1735-1744.
20 Win AK,Dowty JG,English DR,et al.Body mass index in early adulthood and colorectal cancer risk for carriers and non-carriers of germline mutations in DNA mismatch repair genes[J].Br J Cancer,2011,105(1):162-169.
21 Botma A,Nagengast FM,Braem MG,et al.Body mass index increases risk of colorectal adenomas in men with Lynch syndrome:the GEOLynch cohort study[J].J Clin Oncol,2010,28(28):4346-4353.
22 Duval A,Hamelin R.Mutations at coding repeat sequences in mismatch repair-deficient human cancers[J].Cancer Res,2002,62(9):2447-2454.
23 卢晓晔,罗惠莉,覃莉,等.散发性结直肠癌组织中hMSH2和hMLH1的表达及其意义[J].广东医学,2011,32(8):1018-1020.
24 Molaei M,Mansoori BK,Ghiasi S,et al.Colorectal cancer in Iran:immunohistochemical profiles of four mismatch repair proteins[J].Int J Colorectal Dis,2010,25(1):63-69.
25 于静,赵峰,梁丽萍,等.hMLH-1和hMSH-2蛋白在新疆汉族散发性大肠癌中的表达及意义[J].世界华人消化杂志,2012,20(33):3218-3224.
26 Iacopetta B.Are there two sides to colorectal cancer?[J].Int J Cancer,2002,101(5):403-108.
27 Aaltonen LA,Salovaara R,Kristo P,et al.Incidence of hereditary nonpolyposis colorectal cancer and the feasibility of molecular screening for the disease[J].N Engl J Med,1998,338(21):1481-1487.
28 Park JW,Chang HJ,Park S,et al.Absence of hMLH1 or hMSH2 expression as a stage-dependent prognostic factor in sporadic colorectal cancers[J].Ann Surg Oncol,2010,17(11):2839-2846.
29 魏宜胜,洪楚原,赵楚雄,等.结直肠癌患者合并癌性贫血的临床病理特征及预后分析[J].中华胃肠外科杂志,2012,15(4):385-387.
