溶瘤病毒OncoVexGM-CSF在恶性肿瘤中的应用及研究进展
2014-02-08柯雪,董武,白枫,杨琨
柯 雪,董 武,白 枫,杨 琨
近年来,随着基因工程在医学领域的应用,一种新型抗肿瘤方法——溶瘤病毒(Oncolytic viruses)疗法成为肿瘤治疗的研究热点,溶瘤病毒疗法具有选择性杀伤恶性肿瘤细胞、疗效可靠且毒副作用少等优点。溶瘤病毒对恶性肿瘤细胞有很强的感染力,可在恶性肿瘤细胞中大量复制、增殖,并溶解破坏恶性肿瘤细胞并释放更多的病毒,感染更多的恶性肿瘤细胞,且正常细胞不受其影响,从而达到清除恶性肿瘤的治疗目的[1-3]。早在20世纪初,研究者们便发现在接种病毒疫苗的肿瘤患者中,肿瘤出现自发性退化;早期的动物实验证实新城疫病毒和流感病毒可以使鼠肿瘤消退。经历了1个世纪的研究发展,溶瘤病毒载体范围越来越大,其中包括单纯疱疹病毒(HSV)、腺病毒、水泡性口炎病毒 (VSV)、新城疫病毒、麻疹病毒、脊髓灰质炎病毒、细小病毒、呼肠孤病毒、痘苗病毒等。笔者以“ Oncolytic viruses”为关键词在PubMed检索2006—2013年发表的相关文献,对溶瘤病毒OncoVexGM-CSF在恶性肿瘤中的应用及研究进展进行综述。
HSV是在基因工程中一种常用的病毒,野生型HSV分为Ⅰ型和Ⅱ型,其中Ⅰ型HSV(HSV-1)复制能力强、基因组大、能插入较大的基因片段、所引发的并发症较为轻微,因此在基因治疗中常被用作载体。OncoVexGM-CSF便是基于HSV-1研制的一种新型溶瘤病毒,目前被认为是单剂量治疗恶性肿瘤最具前景的溶瘤病毒[4-5]。
1 OncoVexGM-CSF的构建
HSV-1与其他溶瘤病毒载体相比具有以下优势:(1)能感染多种肿瘤细胞(包括人黑色素瘤细胞);(2)复制周期短,从而产生更好的溶瘤作用;(3)能够整合1种或多种外源基因,从而增强其抗瘤作用;(4)已被广大临床研究机构接受和运用[6]。对HSV-1的研究始于转基因溶瘤性HSV G207[7],研究者将G207用于恶性脑胶质瘤的治疗并取得了满意效果,从而开始了HSV-1应用于恶性肿瘤治疗的一系列研究。第二代HSV-1产品G47△改良自G207,已证实其在膀胱癌、结直肠癌、胃癌及前列腺癌中均有明显的治疗作用[8-11]。
OncoVexGM-CSF由HSV-1的JS1菌种构建,剔除了HSV-1中的ICP34.5和ICP47基因,并将人粒-巨噬细胞集落刺激因子(GM-CSF)整合插入到了ICP34.5位点,是一种加入了免疫调控因子GM-CSF的新型溶瘤病毒。因此,又称之JS1/ICP34.5/ICP47-/GM-CSF,其构建原理见表1。
ICP34.5基因是一种和神经毒性相关的基因,剔除ICP34.5基因后HSV-1失去了神经毒活性并能选择性地在肿瘤细胞中快速复制[12-13]。剔除ICP34.5基因的HSV-1能选择性地在肿瘤细胞复制,其作用机制在于肿瘤细胞高表达DNA复制修复蛋白和增殖细胞核抗原(PCNA),导致病毒在无ICP34.5基因的情况下在肿瘤细胞内正常复制[14],而在正常的真核细胞,病毒复制依赖于PCNA-ICP34.5复合体。因此,剔除ICP34.5基因后的HSV-1只能在肿瘤细胞内有效复制。ICP47基因在病毒的免疫逃逸中扮演了重要角色,其主要通过抑制抗原提呈相关转运蛋白1(TAP1)和抗原提呈相关转运蛋白2(TAP2)而阻止抗原递呈作用[15]。因此,剔除ICP47基因可促进病毒抗原递呈作用,有利于建立特异性免疫反应。此外,剔除ICP47基因还可增加HSV独特型短-(US)11基因的表达,从而在不削弱肿瘤选择性的同时促进病毒增殖。US11基因在正常情况下由延迟型病毒启动子操控,剔除ICP47基因后,US11则受控于立早型ICP47启动子。由US11基因编码的21 kDa RNA结合蛋白集中于胞核且具有抑制细胞蛋白激酶R(PKR)激活的作用。早期US11的表达阻断了PKR激活过程并促进剔除ICP34.5基因的HSV-1在肿瘤细胞内复制[14]。因此,剔除ICP34.5和ICP47基因的OncoVexGM-CSF可选择性地在肿瘤细胞内复制,且免疫原性增强,致病性减弱。
OncoVexGM-CSF最大的特点是整合了人GM-CSF编码序列,而GM-CSF是一种强有力的树突状细胞(DC细胞)募集和促成熟因子。OncoVexGM-CSF在体外对各种肿瘤细胞株的溶瘤活性已被证实。Cody等[13]在鼠腹部双侧建立了A20肿瘤模型,证实剔除ICP34.5和ICP47基因的HSV(JS1/ICP34.5-/ICP47-)只能引起注射区瘤体消失,但剔除ICP34.5和ICP47基因并同时加载了人GM-CSF(JS1/ICP34.5-/ICP47-/GM-CSF)的HSV则能引起注射区和对侧未注射区瘤体同时消失。所以,人GM-CSF对引发全身免疫反应起决定作用。
2 OncoVexGM-CSF的溶瘤机制
在黑色素瘤体区域直接注射OncoVexGM-CSF能在局部募集GM-CSF,从而吸引成熟DC细胞吞噬濒死的黑色素瘤细胞。因此,OncoVexGM-CSF通过两种作用机制而发挥治疗作用:(1)对肿瘤细胞的直接溶瘤、破坏作用及刺激DC细胞等而引发肿瘤特异性免疫反应;(2)启动抗原特异性T细胞免疫反应。
表1 OncoVexGM-CSF的构建原理
Table1 The construction principle of OncoVexGM-CSF
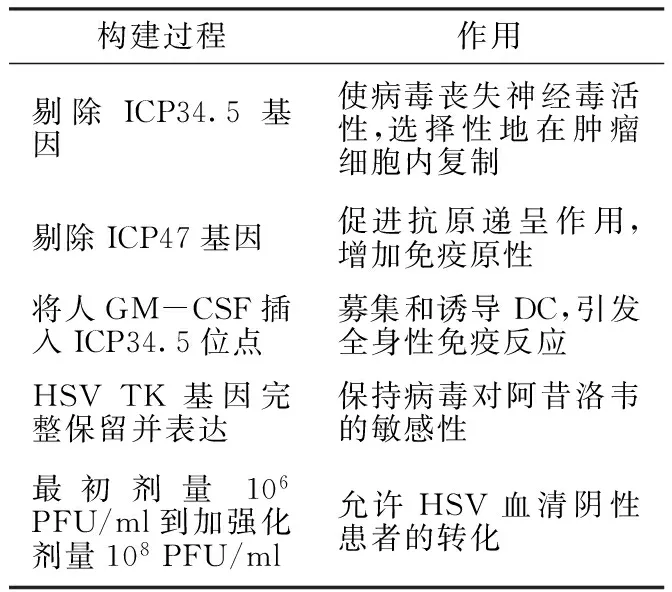
构建过程作用剔除ICP34.5基因使病毒丧失神经毒活性,选择性地在肿瘤细胞内复制剔除ICP47基因促进抗原递呈作用,增加免疫原性将人GM-CSF插入ICP34.5位点募集和诱导DC,引发全身性免疫反应HSVTK基因完整保留并表达保持病毒对阿昔洛韦的敏感性最初剂量106PFU/ml到加强化剂量108PFU/ml允许HSV血清阴性患者的转化
注:GM-CSF=粒-巨噬细胞集落刺激因子,DC=树突状细胞,HSV TK=单纯疱疹病毒胸腺嘧啶核苷激酶,PFU=空斑形成单位;HSV=单纯疱疹病毒

3 OncoVexGM-CSF的安全性和耐受性
Koga等[24]对9位放弃后续放疗的神经瘤患者进行早期溶瘤病毒HSV 1716治疗安全性评价,证实了105PFU/ml剂量的HSV 1716直接注射入瘤体并未产生任何毒副作用;实验室检查和尸检均证明无一例患者在瘤体注射HSV 1716后发生脑炎。而在转移性黑色素瘤中,此剂量的HSV 1716也不会产生毒性或在非瘤细胞内复制。研究人员正在试图进一步证明HSV能够在神经胶质瘤中生存和复制,且不会对宿主造成毒性作用[25]。对于恶性胶质瘤,另一种溶瘤病毒HSV G207也被证实在3×109PFU/ml剂量时没有毒副作用。
Hu等[5]对30例难治性恶性肿瘤(乳腺癌、头颈癌、胃肠癌、恶性黑色素瘤)患者进行的Ⅰ期临床试验中,13例患者分别接受了单次剂量为106、107和108PFU/ml的OncoVexGM-CSF治疗,1次/1~3周,而由于HSV血清阴性患者在接受了107PFU/ml的OncoVexGM-CSF治疗后出现了局部红斑扩大和炎性反应,因此,研究者认为单次剂量107PFU/ml为HSV血清阴性患者血清转化为阳性前的OncoVexGM-CSF最大耐受剂量;研究者还对注射OncoVexGM-CSF后1、4、8、24、48 h注射病损区进行刮拭,并对所取下的标本进行噬菌斑测定,结果表明皮肤表面均无病毒存在,提示OncoVexGM-CSF耐受性较好。在该临床试验中还发现,单次剂量组患者的主要毒副作用为肿瘤局部反应和低热,且在HSV血清阴性患者中更为明显;多剂量组患者的毒副作用主要是全身症状,如发热、出汗、疲乏,也可见食欲减退、恶心、呕吐、便秘等;研究者对2例单次剂量给药患者和8例多剂量给药患者进行血液和尿液检查,均未检出HSV DNA,表明HSV未感染未注射区[5]。Senzer等[18]对50例不能切除的转移性黑色素瘤患者进行的Ⅱ期临床试验中,共有42例(85%)患者存在毒副作用,多数为全身症状,其中发热26例(52%)、寒战24例(48%)、疲劳16例(32%)、恶心15例(30%)、呕吐10例(20%)、头痛10例(20%)、呼吸困难10例(20%);其他毒性作用则与OncoVexGM-CSF治疗无关。

表2 OncoVexGM-CSF的各期临床试验
注:SD=完全缓解
此外,病毒复制和肿瘤细胞增殖速度的相互作用也是溶瘤病毒治疗中有待攻克的难点,有学者通过大量实验建立了两者达到平衡的计算机模型,可以帮助选择OncoVexGM-CSF最佳治疗剂量[26]。
4 OncoVexGM-CSF的各期临床试验
对OncoVexGM-CSF进行的前期临床前试验均证实了其安全性,未出现病毒外溢或产生神经毒性,这为后期进行更多的临床试验奠定了基础。2001年开始的一项小型临床试验中,首次将ICP34.5基因缺失型HSV用于5例转移性黑色素瘤患者的治疗,注射剂量为103PFU/ml,其中2例患者接受了1次注射,2例患者接受了2次注射,1例患者接受了4次注射;结果显示,1例患者在2次注射后出现了瘤体变平,接受了2次及以上注射的3例患者的肿瘤都有坏死现象[27],与早期对胶质瘤患者的研究结果相似[6]。Hu等[5]对30例难治性恶性肿瘤(乳腺癌、头颈癌、胃肠癌、恶性黑色素瘤)患者进行的Ⅰ期临床试验中,将患者分为单次剂量组13例和多剂量组17例,并将OncoVexGM-CSF注射入患者表皮或皮下组织,其中单次剂量组患者分别接受106、107、108PFU/ml的OncoVexGM-CSF,多剂量组患者接受多次治疗。结果显示,患者的主要毒副作用是局部炎症、红斑和发热,引起HSV血清阴性患者产生局部炎症的剂量上限是107PFU/ml,多剂量组患者血清HSV转化为阴性的剂量上限为106PFU/ml,但即使到了108PFU/ml,患者耐受性也很好;生物学活性(病毒复制、局部反应、GM-CSF表达和HSV抗原相关的肿瘤坏死)方面,OncoVexGM-CSF1次/2~3周给药产生的局部反应较小,病毒复制速度也较快。在该试验中,19例患者治疗后接受了活检,其中14例患者出现肿瘤坏死现象,坏死区域都能检测到HSV。研究者据此认为,OncoVexGM-CSF耐受性良好,多次治疗也是安全的,且抗肿瘤效果明显。可以说,Ⅰ期临床试验证实了OncoVexGM-CSF的安全性和生物学活性,为后续研究拟定了剂量计划。
Senzer等[18]进行的一项多中心Ⅱ期临床试验中纳入了50例Ⅲc或Ⅳ期不可切除黑色素瘤患者,根据肿瘤数量和大小,OncoVexGM-CSF初始剂量为106PFU/ml,每次4 ml,3周后改为108PFU/ml,1次/2周。根据实体瘤应答评价标准(RECIST),该试验获得了28%(14/50)的客观应答(即注射区和未注射区瘤体消退)率。而肿瘤免疫治疗不能忽略的一个问题是其低反应性,该试验中28%的客观反应率高于IL-2治疗的客观反应率(10%~15%)[28]。生存率方面,患者两年生存率为52%(26/50),且患者肿瘤微环境MART-1特异性T细胞数量在注射区和未注射区均升高。
对黑色素瘤最有效的溶瘤载体是可复制传代并整合了GM-CSF的HSV-1,已证实OncoVexGM-CSF的体外溶瘤活性及在小鼠体内的抗瘤作用,并在Ⅰ期和Ⅱ期临床试验中验证了其安全性和有效剂量。基于这些成果,OncoVexGM-CSF对黑色素瘤的Ⅲ期试验正在进行中,但具体内容尚未报道。Ⅲ期临床试验最初共纳入360例黑色素瘤患者,其中对照组240例,试验组120例。Ⅲ期临床试验与Ⅱ期临床试验不同之处在于:(1)Ⅲ期临床试验不仅纳入Ⅲc期和Ⅳ期黑色素瘤患者,还纳入了Ⅲb期黑色素瘤患者;(2)伴有广泛内脏损伤,转移灶直径>3 cm,骨和中枢神经系统受到侵蚀或血清乳酸脱氢酶升高的患者被排除在外,因为Ⅱ期临床试验表明这些患者反应性较差;(3)与对照组相比,试验组必须有10%及以上的患者在至少6个月内达到了持续的客观应答,才认为该试验结果为阳性;(4)对照组给予GM-CSF治疗而不是安慰剂,其原因在于患者更易接受和有报道认为GM-CSF能够延缓黑色素瘤病情发展[6]。各期临床试验内容及结果见表2。
5 展望
溶瘤病毒疗法是一种将病毒导入瘤体的新型恶性肿瘤治疗方法,在专业领域,人们最为关心的还是能否将其应用于临床,创造一种微型生物学武器以特异性地杀伤瘤细胞而又不对正常组织或细胞造成损伤是肿瘤治疗领域亟待攻克的难点,创造一种新的可复制病毒疗法远比测试已有病毒载体的治疗作用更迫切。早期临床试验不仅证明溶瘤病毒疗法是一项“有趣的”学术活动,而且其具有巨大的开发前景。
OncoVexGM-CSF代表了一种操控免疫系统的抗癌新疗法,与直接的抗瘤细胞相比更具优越性,不需要昂贵且耗时耗力的体外疫苗制备。Ⅰ期临床试验已证实了OncoVexGM-CSF的耐受性和安全性,Ⅱ期临床试验证实了其对不可切除的Ⅲc期及Ⅳ期黑色素瘤患者良好的客观反应率,Ⅲ期临床试验结果是目前最值得期待的,且研究者有把握此试验会成功。相信随着研究的进一步深入及问题的逐步解决,OncoVexGM-CSF治疗恶性肿瘤的安全性、有效剂量、溶瘤效果在Ⅲ期临床试验中的进一步验证,OncoVexGM-CSF在恶性肿瘤治疗中的作用将是未来备受瞩目的焦点,有可能成为恶性肿瘤治疗的分水岭。
1 Liu R,Varghese S,Rabkin SD.Oncolytic herpes simplex virus vector therapy of breast cancer in C3(1)/SV40 T-antigen transgenic mice[J].Cancer Res,2005,65(4):1532-1540.
2 Liu RB,Martuza RL,Rabkin SD.Intracarotid delivery of oncolytic HSV vector G47 to metastatic breast cancer in the brain[J].Gene Therapy,2005,12(8):647-654.
3 Liu RB,Rabkin SD.Oncolytic herpes simplex virus vectors for the treatment of human breast cancer[J].Chinese Medical Journal,2005,118(4):307-312.
4 Tamura K,Wakimoto H,Agarwal AS.Multimechanistic tumor targeted oncolytic virus overcomes resistance in brain tumors[J].Mol Ther,2013,21(1):68-77.
5 Hu JC,Coffin RS,Davis CJ,et al.A phase Ⅰ study of OncoVexGM-CSF,a second-generation oncolytic herpes simplex virus expressing granulocyte macrophage colony-stimulating factor[J].Clin Cancer Res,2006,12(22):6737-6747.
6 Kaufman HL,Bines SD.OPTIM trial:a Phase Ⅲ trial of an oncolytic herpes virus encoding GM-CSF for unresectable stage Ⅲ or Ⅳ melanoma[J].Future Oncol,2010,6(6):941-949.
7 Aghi MK,Chiocca EA.Phase ib trial of oncolytic herpes virus G207 shows safety of multiple injections and documents viral replication[J].Mol Ther,2009,17(1):8-9.
8 Muthana M,Rodrigues S,Chen YY,et al.Macrophage delivery of an oncolytic virus abolishes tumor regrowth and metastasis after chemotherapy or irradiation[J].Cancer Res,2013,73(2):490-495.
9 Passer BJ,Cheema T,Wu S,et al.Combination of vinblastine and oncolytic herpes simplex virus vector expressing IL-12 therapy increases antitumor and antiangiogenic effects in prostate cancer models[J].Cancer Gene Ther,2013,20(1):17-24.
10 Zeng W,Hu P,Wu J,et al.The oncolytic herpes simplex virus vector G47△ effectively targets breast cancer stem cells[J].Oncol Rep,2013,29(3):1108-1114.
11 Hemminki A.Portrait of a leader in immunotherapeutics:oncolytic viruses for treatment of cancer[J].Hum Vaccin Immunother,2012,8(8):1018-1021.
12 施桂兰,庄秀芬,韩香萍.新型溶瘤病毒oHSV2 hGM-CSF的构建及其抗肿瘤作用[J].中华肿瘤杂志,2012,34(2):89-95.
13 Cody JJ,Scaturro P,Cantor AB,et al.Preclinical evaluation of oncolytic δγ(1)34.5 herpes simplex virus expressing interleukin-12 for therapy of breast cancer brain metastases[J].Int J Breast Cancer,2012(2012):628697.
14 Friedman GK,Haas MC,Kelly VM,et al.Hypoxia Moderates γ(1)34.5-Deleted Herpes Simplex Virus Oncolytic Activity in Human Glioma Xenoline Primary Cultures[J].Transl Oncol,2012,5(3):200-207.

16 Lin YC,Mahalingam J,Chiang JM,et al.Activated but not resting regulatory T cells accumulated in tumor microenvironment and correlated with tumor progression in patients with colorectal cancer[J].Int J Cancer,2013,132(6):1341-1350.
17 施桂兰,张叔人,刘滨磊.肿瘤微环境与炎症反应及溶瘤病毒治疗的关系[J].中国肿瘤生物治疗杂志,2012,19(1):87-92.
18 Senzer NN,Kaufman HL,Amatruda T,et al.Phase Ⅱ clinical trial of a granulocyte-macrophage colony-stimulating factor-encoding,second-generation oncolytic herpesvirus in patients with unresectable metastatic melanoma[J].J Clin Oncol,2009,27(34):5763-5771.


21 Gabrilovich DI,Nagaraj S.Myeloid-derived suppressor cells as regulators of the immune system[J].Nat Rev Immunol,2009,9(3):162-174.
22 Kaufman HL,Kim DW,DeRaffele G,et al.Local and distant immunity induced by intralesional vaccination with an oncolytic herpes virus encoding GM-CSF in patients with stage Ⅲc and Ⅳ melanoma[J].Ann Surg Oncol,2010,17(3):718-730.
23 Zea AH,Rodriguez PC,Atkins MB,et al.Arginase-producing myeloid suppressor cells in renal cell carcinoma patients:a mechanism of tumor evasion[J].Cancer Res,2005,65(8):3044-3048.
24 Koga,M,Nakayama I,Sakai T,et al.Disseminated herpes simplex virus type-1 infection in long-term usage of everolimus[J].J Dermatol,2013,40(1):83-84.
25 Mace AT,Ganly I,Soutar DS,et al.Potential for efficacy of the oncolytic Herpes simplex virus 1716 in patients with oral squamous cell carcinoma[J].Head Neck,2008,30(8):1045-1051.
26 Wodarz D,Komarova N.Towards predictive computational models of oncolytic virus therapy:basis for experimental validation and model selection[J].PLoS One,2009,4(1):e4271.
27 Urdinguio RG,Fernandez AF,Moncada-Pazos A,et al.Immune-dependent and independent antitumor activity of GM-CSF aberrantly expressed by mouse and human colorectal tumors[J].Cancer Res,2013,73(1):395-405.
28 Bell J.Oncolytic viruses:an approved product on the horizon?[J].Mol Ther,2010,18(2):233-234.
29 Harrington K,Hingorani M,Tanay M,et al.Phase Ⅰ/Ⅱ dose escalation study of OncoVexGM-CSFand chemoradiotherapy(CRT)in untreated stage Ⅲ/Ⅳ squamous cell cancer of the head and neck(SCCHN)[J].J Clin Oncol,2009,27(15 Suppl):6018.
