慢性阻塞性肺疾病患者血浆晚期糖基化终末产物和可溶性糖基化终末产物受体浓度变化及其临床意义
2014-02-08胡占升
雷 超,胡占升
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一组以气流受限不完全可逆为特征的可以预防和治疗的慢性炎症性疾病,该病病程中气流受限持续存在且呈进行性发展,但其确切发病机制目前尚不清楚。晚期糖基化终末产物(advanced glycation end-products,AGEs)是一种在人体内以脂肪、蛋白质、核酸以及还原糖(大部分为葡萄糖)等为原料通过催化化学反应生成的有机化合物。可溶性晚期糖基化终末产物受体(soluble receptor for advanced glycation end products,sRAGE)是一种可以与AGEs、淀粉样肽、S100钙粒蛋白等多种配体结合的受体,AGEs通过与sRAGE结合而启动细胞信号转导通路,发挥其生物学效应。国外研究表明,AGEs和sRAGE与炎症密切相关[1-2],可能与COPD有关并具有一定的诊治意义。本研究旨在探讨COPD患者血浆AGEs和sRAGE浓度变化及其意义。
1 资料与方法
1.1 一般资料 选取2012年5月—2013年5月辽宁医学院附属第一医院重症监护病房收治的患者共102例,其中COPD患者53例为COPD组,非COPD患者49例为非COPD组;COPD的诊断符合中华医学会呼吸病学分会慢性阻塞性肺疾病学组制定的《慢性阻塞性肺疾病诊治指南(2007年修订版)》中的诊断标准[3-4];排除高血压、糖尿病、肾衰竭及肿瘤患者。非COPD组中癫痫7例,消化道出血8例,脑梗死9例,药物中毒12例,创伤术后13例。两组患者性别构成、平均年龄、BMI及吸烟率比较,差异均无统计学意义(P>0.05,见表1),具有可比性。
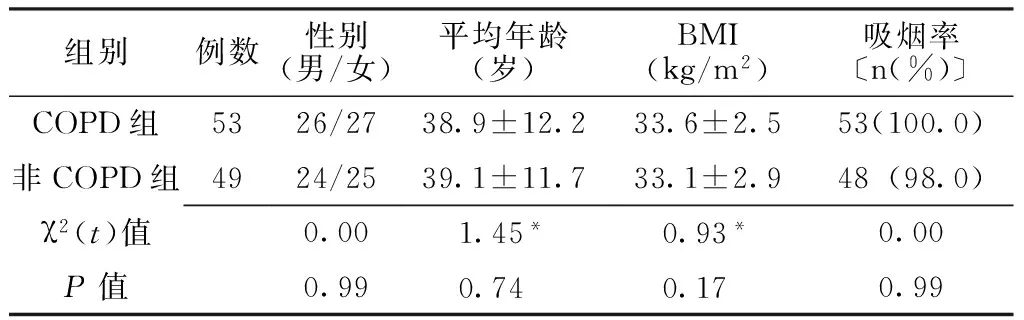
表1 两组患者一般资料比较
注:*为t值
1.2 观察指标
1.2.1 血浆AGEs和sRAGE浓度 采集每例患者外周静脉血6 ml,分为2管,每管3 ml,用EDTA抗凝,-20 ℃冰箱保存。采用酶联免疫吸附试验(ELISA)测定所有患者血浆AGEs和sRAGE浓度,人AGEs抗体试剂盒购自天津瑞爱生物科技有限公司,人sRAGE抗体试剂盒购自上海研域生物科技有限公司,均严格按照试剂盒说明操作。
1.2.2 肺功能 两组患者均在吸入支气管舒张剂后测定一秒用力呼气容积(FEV1)、用力肺活量(FVC)及FEV1占预计值百分比(FEV1%),并将COPD严重程度分为4级:(1)轻度:FEV1/FVC<70%,FEV1%≥80%,患者有或无慢性咳嗽、咳痰症状;(2)中度:FEV1/FVC<70%,50%≤FEV1%<80%,患者有或无慢性咳嗽、咳痰症状;(3)重度:FEV1/FVC<70%,30%≤FEV1%<50%,患者有或无慢性咳嗽、咳痰症状;(4)极重度:FEV1/FVC<70%,FEV1%<30%或FEV1%<50%而患者伴有慢性呼吸衰竭[3]。

2 结果
2.1 血浆AGEs和sRAGE浓度 正态性检验结果显示,血浆AGEs和sRAGE浓度近似正态分布。COPD组患者血浆AGEs浓度为(35.45±3.30)μg/ml,非COPD组为(29.62±0.83)μg/ml,COPD组血浆AGEs浓度高于非COPD组,差异有统计学意义(t=3.25,P<0.001)。COPD组患者血浆sRAGE浓度为(330.15±112.11)pg/ml,非COPD组为(884.53±190.94)pg/ml,COPD组血浆sRAGE浓度低于非COPD组,差异有统计学意义(t=3.32,P<0.001)。
2.2 亚组分析 根据肺功能检测结果,将COPD患者分为轻度COPD组15例、中度COPD组13例、重度COPD组15例以及极重度COPD组10例。轻度COPD组血浆AGEs浓度为(31.93±0.90)μg/ml、中度COPD组为(33.87±0.70)μg/ml、重度COPD组为(36.99±1.13)μg/ml、极重度COPD组为(40.47±1.87)μg/ml,4个亚组COPD患者血浆AGEs浓度比较,差异有统计学意义(F=3.99,P=6.30×10-4);极重度COPD组高于重度COPD组,重度COPD组高于中度COPD组,中度COPD组高于轻度COPD组,差异均有统计学意义(P<0.01)。轻度COPD组血浆sRAGE浓度为(372.13±130.64)pg/ml、中度COPD组为(322.92±117.39)pg/ml、重度COPD组为(322.53±92.59)pg/ml、极重度COPD组为(288.00±96.32)pg/ml,4个亚组COPD患者血浆sRAGE浓度比较,差异无统计学意义(F=2.71,P=0.84)。
2.3 相关性分析 直线相关分析结果显示,COPD患者血浆AGEs浓度与FEV1%呈负相关(r=-0.90,P<0.05,见图1);血浆sRAGE浓度与FEV1%无直线相关关系(r=0.270,P>0.05,见图2)。

注:AGEs=晚期糖基化终末产物,FEV1=一秒用力呼气容积
图1 COPD患者血浆AGEs浓度与FEV1%的相关性
Figure1 Correlation between plasma AGEs and FEV1% in COPD patients

注:sRAGE=可溶性晚期糖基化终末产物受体
图2 COPD患者血浆sRAGE浓度与FEV1%的相关性
Figure2 Correlation between plasma sRAGE and FEV1% in COPD patients
3 讨论
COPD是一种由个体易感因素和环境因素共同作用导致的常见、多发呼吸系统疾病。目前,虽然COPD的确切发病机制还不是很清楚,但普遍认为COPD以气道、肺血管以及肺实质细胞的慢性炎症为特征,COPD患者肺部T淋巴细胞、单核-巨噬细胞及中性粒细胞明显增多。被激活的炎性细胞可合成与释放大量活性炎性递质,如白介素8、白三烯B4、可溶性糖基化终末产物(RAGE)、白介素6及肿瘤坏死因子α等,而这些活性炎性递质不仅能够破坏肺部正常组织,还可以促进炎性反应。AGEs是在人体内以脂肪、蛋白质、核酸以及还原糖(大部分为葡萄糖)等为原料通过催化化学反应生成的有机化合物,存在人体肺、血液、肾脏等多个部位,不易被分解,具有稳定性。在多种细胞如系膜细胞、巨噬细胞、内皮细胞表面存在AGEs的受体sRAGE,该受体能与AGEs结合而形成AGEs-sRAGE复合物,从而激活细胞内信号转导通路,引起细胞中一系列生物化学反应,进而导致大量细胞因子、生长因子、活性氧自由基等活性炎性递质合成并释放入血,引起血管内皮细胞损伤或凋亡、血管损伤、微循环障碍、血流动力学变化、“瀑布样”炎性反应等多种病理反应。van Zoelen等[5]研究证实RAGE与感染相关并在感染过程中扮演着重要角色;Friggeri等[6]研究认为AGEs与脓毒症相关的炎症有关。sRAGE可由多种细胞合成与分泌,肺泡Ⅰ型上皮细胞是其主要来源[7-9],主要用于维持肺泡的稳定性以及辅助肺气体交换[10]。
近年来,国外关于血浆AGEs、RAGE以及sRAGE在COPD中的作用研究报道很多。Wu等[11]研究表明COPD患者血浆AGEs及其受体sRAGE浓度增高,Smith等[12]研究表明COPD患者血浆sRAGE浓度降低,Sukkar等[13]研究表明中性粒细胞性哮喘和COPD患者血浆sRAGE浓度下降。而在国内,AGEs、sRAGE及RAGE研究报道主要集中在糖尿病[14]、动脉粥样硬化[15]及肿瘤[16]等,而其在COPD中的作用研究报道极少,因此,本研究检测了COPD患者血浆中AGEs及其受体sRAGE浓度变化,并探讨其临床意义。本研究结果显示,COPD组血浆AGEs浓度明显高于非COPD组,而COPD组血浆sRAGE浓度明显低于非COPD组;极重度COPD组血浆AGEs浓度明显高于重度COPD组,重度COPD组明显高于中度COPD组,中度COPD组明显高于轻度COPD组,但各亚组血浆sRAGE浓度无明显差异;直线相关分析结果显示,COPD患者血浆AGEs浓度与FEV1%呈负相关。表明血浆AGEs浓度与COPD病情严重程度相关,与文献报道一致[11-13],血浆AGEs浓度升高可能是COPD的危险因素,而血浆sRAGE浓度降低可能是COPD的保护因素。因此,血浆AGEs浓度可以作为判断COPD患者病情严重程度的指标,血浆AGEs浓度升高预示COPD患者预后不良,甚至死亡;而血浆sRAGE浓度变化是否为COPD患者的保护性因素还有待于进一步扩大样本量研究验证。
至于COPD患者血浆AGEs浓度升高的机制,笔者认为可能包括以下两个方面:(1)COPD患者体内炎症-抗炎平衡系统被破坏,出现炎症失控,导致体内细胞代谢紊乱,AGEs合成增加;(2)COPD患者体内炎症-抗炎平衡系统被破坏,导致单核-巨噬细胞功能障碍或吞噬能力减弱,不能有效地清除合成AGEs的炎性细胞,而AGEs通过血液运输到达肾脏,与肾脏系膜细胞上的sRAGE结合,大量AGEs-sRAGE复合物沉积在滤过膜上,引起肾脏排泄障碍。John等[17]研究认为COPD患者血浆AGEs浓度升高的机制可能与P40有关。而COPD患者血浆sRAGE浓度下降的机制,笔者认为可能是COPD患者体内AGEs-sRAGE复合物活化而促进炎症级联反应,引起包括肺泡Ⅰ型上皮细胞在内的肺实质细胞损伤,进而引起sRAGE合成减少。Gopal等[18]研究认为COPD患者血浆sRAGE浓度下降的机制可能与氧治疗的影响有关。
总之,COPD是一种发病率和致残率均较高的慢性疾病[19],如能尽早做出明确诊断并在早期预测COPD高危患者预后,早期积极给予有针对性的合理的治疗,是可以改善COPD患者预后及降低COPD患者病死率的。目前,常用的COPD患者预后预测指标有FEV1%及FEV1/FVC、吸气分数(IC/TLC)[20]、最大呼气流速(PEF)与用力呼气时间、BODE(BMI、气流阻塞、呼吸困难、运动能力)指数[21]、呼吸功能[22]及QQL[23]等,均具有一定的预测价值,但也存在自身缺陷,如敏感度不高、特异性不强或最佳临界值难以确定等。本研究结果表明,血浆AGEs浓度升高可能是COPD的危险因素,而血浆sRAGE浓度降低可能是COPD的保护因素,血浆AGEs浓度可以作为判断COPD患者病情严重程度的指标,血浆AGEs浓度升高预示COPD患者预后不良。但本研究样本量较小,条件有限,COPD患者血浆AGEs浓度升高或血浆sRAGE浓度下降的确切机制及血浆AGEs对COPD患者预后的预测价值还有待于进一步研究。而对COPD患者血浆AGEs及其受体sRAGE浓度变化的深入研究有助于科研工作者开发AGEs分解剂或抑制剂,寻找新的COPD治疗靶点,为临床医师提供COPD诊治新思路[24]。
1 Ramasamy R,Vannucci SJ,Yan SS,et al.Advanced glycation end-products and RAGE:a common thread in aging,diabetes,neurodegeneration,and inflammation[J].Glycobiology,2005,15(7):16R-28R.
2 Yan SF,Ramasamy R,Schmidt AM.Mechanisms of disease:advanced glycation end-products and their receptor in inflammation and diabetes complications[J].Nat Clin Pract Endocrinol Metab,2008,4(5):285-293.
3 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华结核和呼吸杂志,2007,30(1):8-17.
4 Zhong N,Wang C,Yao W,et al.Prevalence of chronic obstructive pulmonary disease in China:a large,population-based survey[J].Am J Respir Crit Care Med,2007,176(8):753-760.
5 van Zoelen MA,Achouiti A,van der Poll T.The role of receptor for advanced glycation endproducts(RAGE)in infection[J].Crit Care,2011,15(2):208.
6 Friggeri A,Banerjee S,Biswas S,et al.Participation of the receptor for advanced glycation end products in efferocytosis[J].J Immunol,2011,186(11):6191-6198.
7 Kikkawa T,Sato N,Kojika M,et al.Significance of measuring S100A12 and sRAGE in the serum of sepsis patients with postoperative acute lung injury[J].Dig Surg,2010,27(4):307-312.
8 Buckley ST,Ehrhardt C.The receptor for advanced glycation end products(RAGE)and the lung[J].J Biomed Biotechnol,2010(2010):917108.
9 Kim JK,Park S,Lee MJ,et al.Plasma levels of soluble receptor for advanced glycation end products(sRAGE)and proinflammatory ligand for RAGE(EN-RAGE)are associated with carotid atherosclerosis in patients with peritoneal dialysis[J].Atherosclerosis,2012,220(1):208-214.
10 Demling N,Ehrhardt C,Kasper M,et al.Promotion of cell adherence and spreading:a novel function of RAGE,the highly selective differentiation marker of human alveolar epithelial type Ⅰ cells[J].Cell Tissue Res,2006,323(3):475-488.
11 Wu L,Ma L,Nicholson LF,et al.Advanced glycation end products and its receptor(RAGE)are increased in patients with COPD[J].Respir Med,2011,105(3):329-336.
12 Smith DJ,Yerkovich ST,Towers MA,et al.Reduced soluble receptor for advanced glycation end-products in COPD[J].Eur Respir J,2011,37(3):516-522.
13 Sukkar MB,Wood LG,Tooze M,et al.Soluble RAGE is deficient in neutrophilic asthma and COPD[J].Eur Respir J,2012,39(3):721-729.
14 杨生.2型糖尿病合并下肢血管病变患者与晚期糖基化终末产物及脂联素相关性研究[J].中国全科医学,2011,14(5):1643-1645.
15 王瑞良,苏青.RAGE及其配体的临床意义研究进展[J].国际内分泌代谢杂志,2006,26(3):160-162.
16 景蓉蓉,王惠民.晚期糖基化终末产物受体与肿瘤的关系[J].实验与检验医学,2008,26(5):541-542,547.
17 John M,Hussain S,Selvarajah S,et al.P40 increased advanced glycation end products in patients with chronic obstructive pulmonary disease(COPD)[J].Thorax,2011,66(Suppl 4):A84.
18 Gopal P,Rutten EP,Dentener MA,et al.Decreased plasma sRAGE levels in COPD:influence of oxygen therapy[J].Eur J Clin Invest,2012,42(8):807-814.
19 Rabe KF,Hurd S,Anzueto A,et al.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease:GOLD executive summary[J].Am J Respir Crit Care Med,2007,176(6):532-555.
20 Casanova C,Cote C,de Torres JP,et al.Inspiratory-to-total lung capacity ratio predicts mortality in patients with chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2005,171(6):591-597.
21 Celli BR,Cote CG,Marin JM,et al.The body mass index,airflow obstruction,dyspnea,and exercise capacity index in chronic obstructive pulmonary disease[J].N Engl J Med,2004,350(10):1005-1012.
22 Schlecht NF,Schwartzman K,Bourbeau J.Dyspnea as clinical indicator in patients with chronic obstructive pulmonary disease[J].Chron Respir Dis,2005,2(4):183-191.
23 Seemungal TA,Donaldson GC,Paul EA,et al.Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,1998,157(5 Pt 1):1418-1422.
24 Chen L,Liu L,Wang T,et al.Receptor for advanced glycation end products:a new theraputic target for chronic obstructive pulmonary disease?[J].Arch Med Res,2013,44(1):75-76.
