核基质蛋白22定量分析及尿液细胞学检查评估膀胱癌复发的价值研究
2014-02-08彭晓晖梁培育欧善际祖雄兵
彭晓晖,梁培育,欧善际,祖雄兵
膀胱癌是目前泌尿生殖系统最常见的肿瘤之一,发病率较高。流行病学调查研究发现,膀胱癌的发病率占整个泌尿系统肿瘤的48.3%[1]。浅表性膀胱癌是来自泌尿系统上皮的恶性肿瘤,能达到70%的发病率,且浅表性膀胱癌复发的几率较高。有研究证实,浅表性膀胱癌的复发率可达到60%~85%[2-3]。临床建议对肿瘤患者进行长时间的随访以监测肿瘤的复发及病情的进展,因此膀胱癌患者通常在手术后前2年,每3个月或4个月行膀胱镜检查以及尿液细胞学检查,其中膀胱镜检查被认为是诊断的金标准。在后期也建议对患者进行定期随访以监测肿瘤的复发情况[4-6]。但由于膀胱镜在检查中易对人体造成侵袭性损伤,且检查费用相对较高,因此临床中出现了很多新技术用于对膀胱癌的复发监测,包括:流式细胞术、定量荧光图像分析,核基质蛋白22(NMP22)定量分析法等,目前针对这些方法在膀胱癌复发检测中的准确性研究现已广泛开展[7-11]。NMP22试验可以定量分析核基质蛋白的含量,NMP22即为核有丝分裂器蛋白,其中核有丝分裂器由泌尿上皮细胞凋亡后产生[12-14]。NMP22主要存在于尿液中,膀胱癌患者尿液中的NMP22水平显著增高。有研究表明,膀胱癌患者尿液中NMP22的水平可达到正常人群的20~80倍[13]。NMP22在膀胱癌诊断中的灵敏度可以达到尿液细胞学检查的灵敏度[15]。鉴于此,本研究通过对膀胱移行细胞癌复发的不同阶段和时期进行尿液NMP22定量分析以及尿液细胞学检查,以比较两种方法评估膀胱癌复发的价值。
1 资料与方法
1.1 一般资料 选取2008—2012年在海南医学院附属医院住院的浅表性膀胱癌患者144例,其中男125例,女19例;年龄26~86岁,平均61.8岁。浅表性膀胱癌的诊断标准[16]为:非肌层浸润性膀胱癌或浅表性膀胱癌占初发膀胱癌的70%,其中Ta期占70%、T1期占20%、Tis期占10%。排除合并尿路感染、泌尿系结石及其他恶性肿瘤的患者。本研究经医院伦理委员会批准,且患者均签署书面知情同意书。
1.2 试验方法 患者均在3 d内连续每天提供3份用于尿液细胞学检查的尿液样本以及1份用于NMP22定量分析的尿液样本。
1.2.1 尿液细胞学检查 将患者尿液离心取沉淀物制片,干燥后行苏木精-伊红染色(HE染色),普通光镜观察并进行细胞学诊断,发现膀胱肿瘤细胞(肿瘤细胞具有核大、畸形、深染等特点),为尿液细胞学检查阳性。
1.2.2 NMP22定量分析 本研究使用Matritech公司的NMP22试剂盒(Matritech Inc,330 Nevada St,Newton,MA)进行检测,NMP22定量分析按Matritech公司的试剂盒说明书进行操作。于膀胱镜检查前收集患者单次新鲜自排尿50~100 ml,采用酶联免疫吸附试验(ELISA)法(美国Matritech公司生产),按照说明书操作,经全自动酶标仪在490 nm处比色,数据经仪器所配置计算机处理系统处理,绘制标准曲线,计算样本NMP22水平。NMP22试剂盒将膀胱癌定性的截点设定为10 U /ml,测试结果> 10 U /ml作为阳性结果。
1.2.3 膀胱镜检查 患者均经膀胱镜检查常规观察肿瘤部位、形态,并做肿瘤活检,其病理结果作为金标准。膀胱镜检查过程中,任何可疑的肿块以及病灶均取病理活检,检查结果按照TNM系统[17]进行分期〔原位癌(CIS)、Ta期(非浸润性乳头状癌)、T1期(肿瘤侵及上皮下结缔组织)、T2期(肿瘤侵犯肌层)〕以及WHO系统[18]进行分级〔Ⅰ级(尿路上皮癌,分化良好)、Ⅱ级(尿路上皮癌,中度分化)、Ⅲ级(尿路上皮癌,分化不良)〕。在膀胱镜检查中视野内为正常组织或者组织病理学检查结果为非恶性组织的定义为阴性;对于膀胱镜检查未发现肿块,但患者尿液细胞学检查以及NMP22定量分析有阳性发现的患者需要进一步行膀胱内随机组织病理学活检[19]以排除泌尿系肿瘤的可能。根据膀胱癌复发进展等方面的风险因素,将所有患者病理学结果划分为3个风险层次:低度风险(单个病灶为TaG1期,且病灶直径<3 cm),中度风险〔排除低度及高度风险的患者,包括肿瘤多发、Ta~T1期、G1~G2期(低级别尿路上皮癌)、病灶直径>3 cm〕,高度风险〔多个病灶T1G2期,Tis期(CIS),T1G3期,TaG3期〕对于高度风险的患者应每4周复查1次,直至治疗后9个月。明确具有上尿路病灶以及膀胱病灶的患者定义为阳性。
1.4 统计学方法 使用SPSS 13.0软件对数据进行统计学分析,计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤特征 144例患者中,52例(36.1%)诊断为复发性膀胱移行细胞癌,其中48例通过首次膀胱镜检查直接诊断,4例在随访期间膀胱镜检查诊断。随访期间诊断的4例患者中1例为CIS伴尿液细胞学检查为阳性,其余3例肿瘤较小且伴NMP22定量分析阳性(其中2例患者为T1G2期,1例为T1G3期)。52例膀胱癌复发患者中,Ⅰ级16例,Ⅱ级20例,Ⅲ级16例; Ta期18例,T1期22例,CIS 3例,T2期9例;风险分层:低度风险25例,中度风险19例,高度风险8例。
2.2 NMP22定量分析及尿液细胞学检查对膀胱癌复发的诊断价值 52例膀胱癌复发患者中,41例NMP22定量分析结果为阳性,23例尿液细胞学检查为阳性。NMP22定量分析诊断膀胱癌复发的灵敏度为78.8%(41/52),特异度为69.6%(64/92),阳性预测值为59.4%(41/69),阴性预测值为85.3%(64/75);尿液细胞学检查诊断膀胱癌复发的灵敏度为44.2%(23/52),特异度为83.7%(77/92),阳性预测值为60.5%(23/38),阴性预测值为72.6%(77/106,见表1)。两种方法诊断膀胱癌复发的灵敏度和特异度比较,差异有统计学意义(χ2=6.58、5.40,P=0.01、0.02);而两种方法诊断膀胱癌复发的阳性预测值和阴性预测值比较,差异无统计学意义(χ2=3.13、0.50,P=0.08、0.48)。
2.3 两种方法对肿瘤分期及分级的灵敏度分析 52例膀胱癌患者中按不同分期,NMP22定量分析CIS 2例,Ta期11例,T1期21例,T2期7例;尿液细胞学检查CIS 3例,Ta期2例,T1期10例,T2期8例。按不同分级,NMP22定量分析I级11例,Ⅱ级17例,Ⅲ级13例;尿液细胞学检查I级0例,Ⅱ级8例,Ⅲ级15例。按风险分层,NMP22定量分析低度风险17例、中度风险17例、高度风险7例;尿液细胞学检查低度风险4例、中度风险10例、高度风险9例。NMP22定量分析与尿液细胞学检查在不同分期、分级、风险分层中的灵敏度比较,差异有统计学意义(P<0.05,见表2)。
表1 NMP22定量分析及尿液细胞学检查对膀胱癌复发的诊断价值
Table1 Value of voided urine cytology and NMP22 quantitative analysis in the diagnosis of recurrent bladder TCC
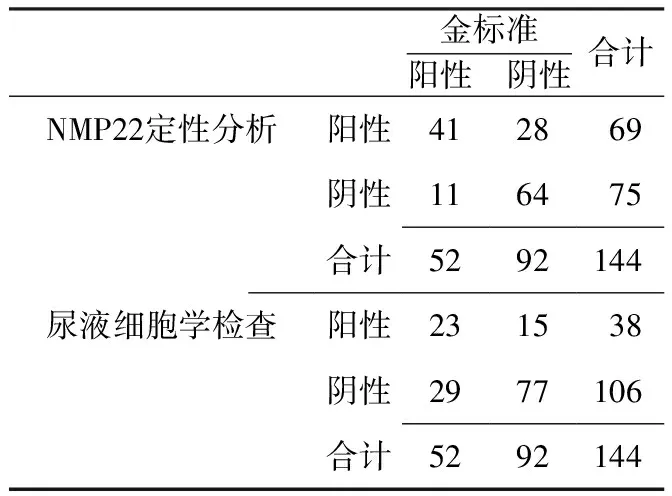
金标准阳性 阴性合计NMP22定性分析阳性412869阴性116475合计5292144尿液细胞学检查阳性231538阴性2977106合计5292144
2.4 联合两种检测方法对膀胱癌复发的诊断价值 NMP22定量分析联合尿液细胞学检查、NMP22定量分析联合膀胱镜检查、尿液细胞学检查联合膀胱镜检查诊断膀胱癌复发的灵敏度分别为88.5%(46/52)、98.1%(51/52)及94.2%(49/52)。
3 讨论
膀胱镜检查目前被认为是膀胱癌诊断的金标准,但其也存在侵袭性损伤以及相对昂贵的检查费用等不足[20-21]。尿液细胞学检查是针对尿液中尿路脱落上皮细胞的细胞形态学检查,但对于体积较小的肿瘤以及组织分化较好的患者,因自然脱落的细胞较少,因而诊断具有一定难度。正因为如此,尿液细胞学检查在低度风险组的肿瘤患者中灵敏度较低,仅为15%~30%[14]。目前在临床膀胱癌检测中也出现了很多基于尿液标记物的新检测手段以替代尿液细胞学检查,其中包括:BTA stat,BTA trak,NMP22,UroVysion等检测[22-23]。NMP首先于1974年被发现,是一种非染色质结构,作为细胞核形态支撑组织构建DNA,同时NMP还参与DNA的复制和转录,以及RNA加工过程。NMP22是核蛋白质,其在染色体的调控、复制过程中以及细胞分离中意义重大。
目前大量研究和报道已证明NMP22检测比尿液细胞学检测具有更好的应用前景[24-25]。有研究认为,NMP22检测在膀胱癌检测中的灵敏度为70%~80%,而尿液细胞学检查的灵敏度仅为10%~40%[9,26-28],NMP22的敏感度为后者的2倍以上。本研究发现,NMP22定量分析诊断膀胱癌复发的灵敏度为78.8%,特异度为69.6%,阳性预测值为59.4%,阴性预测值为85.3%;尿液细胞学检查诊断膀胱癌复发的灵敏度为44.2%,特异度为83.7%,阳性预测值为60.5%,阴性预测值为72.6%;两种方法诊断膀胱癌复发的灵敏度和特异度有明显差异。提示NMP22的定量分析诊断膀胱癌复发的灵敏度较高,但其特异度较尿液细胞学检查低。本研究中尿液细胞学检查的灵敏度较目前其他研究者报道的灵敏度较高,这可能与本研究在行尿液细胞学检测时,使用3个血样本进行反复检测,从而提高了尿液细胞学检测的灵敏度有关。
NMP22检测方法也存在一定缺陷,如缺乏确切的定量分界点等[29-31]。Jamshidian等[24]研究建议将NMP22水平为10.1 U/ml作为患者的膀胱癌检测分界点。本研究使用Matritech公司的NMP22试剂盒(Matritech Inc,330 Nevada St,Newton,MA)进行检测,并将膀胱癌定性的截断值设定为10 U /ml,测试结果>10 U /ml作为阳性结果。本研究表明,在不同分期和分级的浅表性膀胱癌复发患者中,NMP22定量分析在Ta期、T1期、I级、Ⅱ级诊断膀胱癌复发的灵敏度高于尿液细胞学检查,但在Ⅲ级以及高度风险的患者中,两种方法之间无明显差异。Kumar等[25]研究发现NMP22在低度风险膀胱癌患者中的灵敏度能到达尿液细胞学检查的8倍,但在中度风险以及高度风险患者中无此差异。提示检测尿中NMP22可能对膀胱癌的早期诊断有一定价值。本研究还发现,NMP22定量分析联合尿液细胞学检查、NMP22定量分析联合膀胱镜检查、尿液细胞学检查联合膀胱镜检查诊断膀胱癌复发的灵敏度分别为88.5% (46/52)、 98.1% (51/52)及94.2% (49/52),优于单独使用NMP22定量分析或者尿液细胞学检查对膀胱癌复发的诊断价值,为今后进一步研究提供了参考依据。
综上所述,本研究发现将NMP22定量分析作为一种监测标志物,可以早期、敏感地发现肿瘤的复发与进展,且无创伤,不仅可以有效减少有创的膀胱镜检查次数,减少患者的痛苦,还有利于患者进行早期治疗与干预,值得临床推广应用。由于本次研究的阳性样本数较少,以及研究手段的局限,可能会对研究结果造成一定的影响,提示今后还可增大样本量,或者采用分子生物学研究方法对本次研究进行验证。

表2 NMP22定量分析及尿液细胞学检查在不同分期及分级膀胱癌复发中的灵敏度分析(%)
注:与NMP22定量分析比较,*P<0.05
1 Akbari ME,Hosseini SJ,Rezaee A,et al.Incidence of genitourinary cancers in the Islamic Republic of Iran:a survey in 2005[J].Asian Pac J Cancer Prev,2008,9(4):549-552.
2 Babjuk M,Oosterlinck W,Sylvester R,et al.EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder[J].European Urology,2008,54(2):303-314.
3 Jones JS,Campbell SC.Non-muscle-invasive bladder cancer(Ta,T1,and CIS)[J].Campbell-Walsh Urology,2007,9:2447-2467.
4 Mufti GR,Singh M.Value of random mucosal biopsies in the management of superficial bladder cancer[J].Eur Urol,1992,22(4):288-293.
5 Kriegmair M,Baumgartner R,Knüchel R,et al.Detection of early bladder cancer by 5-aminolevulinic acid induced porphyrin fluorescence[J].J Urol,1996,155(1):109-110.
6 徐晓亮,刘振湘,黄义,等.膀胱癌肉瘤的临床特征[J].海南医学院学报,2010,16(1):73-75.
7 Berezney R,Coffey DS.Identification of a nuclear protein matrix[J].Biochemical and Biophysical Research Communications,1974,60(4):1410-1417.
8 Cordon-Cardo C,Wartinger DD,Melamed MR,et al.Immunopathologic analysis of human urinary bladder cancer.Characterization of two new antigens associated with low-grade superficial bladder tumors[J].Am J Pathol,1992,140(2):375-385.
9 Soloway MS,Briggman V,Carpinito GA,et al.Use of a new tumor marker,urinary NMP22,in the detection of occult or rapidly recurring transitional cell carcinoma of the urinary tract following surgical treatment[J].J Urol,1996,156 (2 Pt 1):363-367.
10 Sarosdy MF,deVere White RW,Soloway MS,et al.Results of a multicenter trial using the BTA test to monitor for and diagnose recurrent bladder cancer[J].J Urol,1995,154 (2 Pt 1):383-384.
11 Parry WL,Hemstreet GP 3rd.Cancer detection by quantitative fluorescence image analysis[J].J Urol,1988,139(2):270-274.
12 Yang CH,Snyder M.The nuclear-mitotic apparatus protein is important in the establishment and maintenance of the bipolar mitotic spindle apparatus[J].Mol Biol Cell,1992,3(11):1259-1267.
13 Keesee SK,Briggman JV,Thill G,et al.Utilization of nuclear matrix proteins for cancer diagnosis[J].Crit Rev Eukaryot Gene Expr,1996,6:189-214.
14 Talwar R,Sinha T,Karan SC,et al.Voided urinary cytology in bladder cancer:is it time to review the indications?[J].Urology,2007,70(2):267-271.
15 Hosseini J,Golshan AR,Mazloomfard MM,et al.Detection of recurrent bladder cancer:NMP22 test or urine cytology?[J].Urology Journal,2012,9(1):367-372.
16 史时芳.浅表性膀胱癌的现代诊断[J].中国医师进修杂志,2006,29(23):1-3.
17 Henson J S,Hutter D E,O′Sullivan,et al.AJCC cancer staging manual[M].5 ed.Philadelphia:Lippincott-Raven,1997:241-243.
18 Mostofi FK,Davis CJ,Sesterhenn IA.Pathology of tumors of the urinary tract[M]//Skinner DG,Lieskovsky G.Diagnosis and management of genitourinary cancer.Philadelphia:WB Saunders,1988:83-117.
19 Solsona E,Iborra I,Ricos JV,et al.Clinical panurothelial disease in patients with superficial bladder tumors:therapeutic implications[J].J Urol,2002,167(5):2007-2011.
20 Lotan Y,Roehrborn CG.Cost-effectiveness of a modified care protocol substituting bladder tumor markers for cystoscopy for the followup of patients with transitional cell carcinoma of the bladder:a decision analytical approach[J].J Urol,2002,167(1):75-79.
21 王声兴, 张阳德, 梁培育,等.膀胱正常组织和癌组织的显微自体荧光差异研究[J].海南医学院学报,2011,17(2):267-269.
22 van Rhijn BW,van der Poel HG,van der Kwast TH.Urine markers for bladder cancer surveillance:a systematic review[J].Eur Urol,2005,47(6):736-748.
23 陈智,梁培育,徐海波,等.NMP22、BTAstat和B超联合运用诊断膀胱肿瘤[J].海南医学院学报,2009,15(5):413-416.
24 Jamshidian H,Kor K,Djalali M.Urine concentration of nuclear matrix protein 22 for diagnosis of transitional cell carcinoma of bladder[J].Urol J,2008,5(4):243-247.
25 Kumar A,Kumar R,Gupta NP.Comparison of NMP22 BladderChek test and urine cytology for the detection of recurrent bladder cancer[J].Jpn J Clin Oncol,2006,36(3):172-175.
26 Stampfer DS,Carpinito GA,Rodriquez-Villanueva J,et al.Evaluation of NMP22 in the detection of transitional cell carcinoma of the bladder[J].The Journal of Urology,1998,159(2):394-398.
27 Miyanaga N,Akaza H,Ishikawa S,et al.Clinical evaluation of nuclear matrix protein 22 (NMP22) in urine as a novel marker for urothelial cancer[J].Eur Urol,1997,31(2):163-168.
28 Landman J,Chang Y,Kavaler E,et al.Sensitivity and specificity of NMP-22,telomerase,and BTA in the detection of human bladder cancer[J].Urology,1998,52(3):398-402.
29 Grossman HB,Soloway M,Messing E,et al.Surveillance for recurrent bladder cancer using a point-of-care proteomic assay[J].JAMA,2006,295:299-305.
30 Badalament RA,Hermansen DK,Kimmel M,et al.The sensitivity of bladder wash flow cytometry,bladder wash cytology,and voided cytology in the detection of bladder carcinoma[J].Cancer,1987,60(7):1423-1427.
31 Shariat SF,Zippe C,Lüdecke G,et al.Nomograms including nuclear matrix protein 22 for prediction of disease recurrence and progression in patients with Ta,T1 or CIS transitional cell carcinoma of the bladder[J].J Urol,2005,173(5):1518-1525.
