风湿性心脏病左房室瓣狭窄合并右房室瓣反流患者中球囊扩张术的应用价值
2014-02-08陈章强陆林祥尹秋林赖珩莉李华泰
陈章强,洪 浪,王 洪,陆林祥,尹秋林,赖珩莉,李华泰
1984年Inoue首次成功应用经皮左房室瓣球囊扩张成形术(percutaneous balloon mitral valvuloplasty,PBMV)治疗风湿性心脏病左房室瓣狭窄患者,此后在我国各地区广泛开展。球囊扩张成形术对于单纯左房室瓣狭窄的疗效已经明确,但对于合并右房室瓣关闭不全患者的疗效如何?目前国内外文献报道较少[1-3]。本院自从1986年开展PBMV以来,已完成PBMV术4 000余例。本研究选择左房室瓣狭窄合并右房室瓣关闭不全患者220例,以探讨风湿性心脏病左房室瓣狭窄合并右房室瓣反流患者中球囊扩张成形术的应用价值。
1 资料与方法
1.1 一般资料 选择2000年1月—2012年6月在江西省人民院因风湿性心脏病左房室瓣狭窄符合1998年美国《心脏瓣膜病诊疗指南》的诊断标准(有明显的活动后胸闷、气促的临床症状,左房室瓣口面积≤1.5 mm2),并且均通过经胸超声心动图或食管超声心动图(美国惠普公司5500)确诊,排除严重感染、严重贫血(血红蛋白<70 g/L)、严重血小板减少(<50×109/L)、左房血栓、严重肝肾功能不全、中重度左房室瓣反流、重度左房室瓣钙化,合并主动脉瓣重度狭窄或重度反流等住院行PBMV的患者1 700例。其中220例合并右房室瓣反流,男90例,女130例;年龄29~67岁,平均(47.5±7.4)岁;病程3~20年,平均(10.5±5.4)年;左房室瓣口面积为0.4~1.5 cm2,平均(0.9±0.3)cm2;右房室瓣反流面积为3.2~26.0 cm2,平均(11.2±6.5)cm2。其中合并右房室瓣轻中度反流者160例,重度反流者60例。220例患者均出现胸闷、气促症状,其中有60例患者出现不同程度的双下肢水肿,有30例出现肝脏肿大和肝区搏动,120例合并肺动脉高压(≥25 mm Hg,1 mm Hg=0.133 kPa)。
1.2 研究方法及检测指标 选择自制的左房室瓣单球囊导管(江西益康有限公司生产),PBMV前做碘皮试,皮试阴性者,以76%泛影葡胺,皮试阳性者选择碘葡罗胺(优维显370)充盈球囊,从16 ml(1.6~1.8 mm,瓣膜口面积=3.14 mm×0.8 mm)开始以逐步递增法扩张,每扩张一次增加0.5~1.0 ml。扩张终点应使左房压(LAP)下降50%以上,或左心房平均压降到15 mm Hg以下,左房室瓣区舒张期隆隆样杂音消失或明显减轻。合并右房室瓣重度反流患者,联合使用利尿剂,使24 h尿量保持在2 000 ml以上。如果合并心房纤颤,经胸超声或食管超声未见左房内血栓者,常规静脉滴注尿激酶(10~20)万单位,2次/d,共3~7 d;如果合并左心房血栓者,口服华法林3~6个月复查心脏彩超左房血栓消失后再行球囊扩张成形术。术后2~3 d内经胸超声心动图复查左房室瓣口面积(MVA)、右房室瓣反流面积(TRA)、LAP、右房压(RAP)、左房直径(LAD)、右房直径(RAD)、肺动脉压(PAP)、左心室射血分数(LVEF)。PBMV术后定期电话或门诊随访6个月~9年,平均(75±32)个月,并在随访结束时经彩色多普勒超声心动图复查上述指标(MVA、TRA、LAD、RAD、PAP以及LVEF),以心血管事件(如血栓栓塞、心力衰竭、恶性心律失常、死亡等)的发生为随访终点。
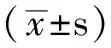
2 结果
2.1 PBMV前后各参数的变化 220例患者经PBMV后MVA较术前增加,差异有统计学意义(P<0.01)。轻中度右房室瓣反流者术后TRA较术前减少,差异有统计学意义(P<0.01);重度右房室瓣反流者术后TRA低于术前,但差异无统计学意义(P>0.05)。术后LAP、RAP、LAD、RAD均较术前减小,差异有统计学意义(P<0.01)。合并PAP患者术后压力低于术前,差异有统计学意义(P<0.01,见表1)。
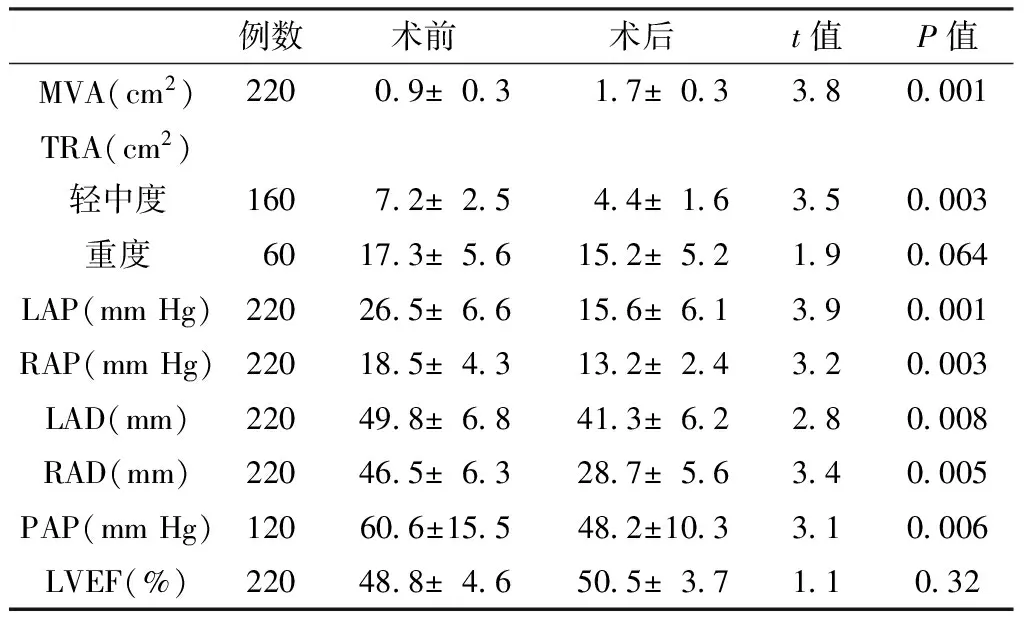
表1 PBMV前后各参数的变化Table 1 The change of each parameter before and after PBMV
注: MVA=左房室瓣口面积,TRA=右房室瓣反流面积,LAP=左房压,RAP=右房压,LAD=左房直径,RAD=右房直径,PAP=肺动脉压,LVEF=左心室射血分数
2.2 随访过程 无论合并右房室瓣轻中度反流,还是合并重度反流,左房室瓣区舒张期隆隆样杂音均从中重度减为轻度,收缩期吹风样杂音从术前0~1/6级升高到1~2/6级,右房室瓣区收缩期杂音从3~4/6级降低到2~3/6级,双下肢水肿明显减轻,肝脏肿大和肝区搏动明显减轻或消失,胸闷、气促症状明显缓解(即术前可登楼2~4层即感觉胸闷、气促,术后可以登4~7层)。随访过程中,合并轻中度右房室瓣反流患者中有2例失访,合并重度右房室瓣反流患者中有2例死亡(大面积脑梗死1例,心力衰竭1例,分别在术后第6年和第8年死亡)。患者无严重并发症发生。
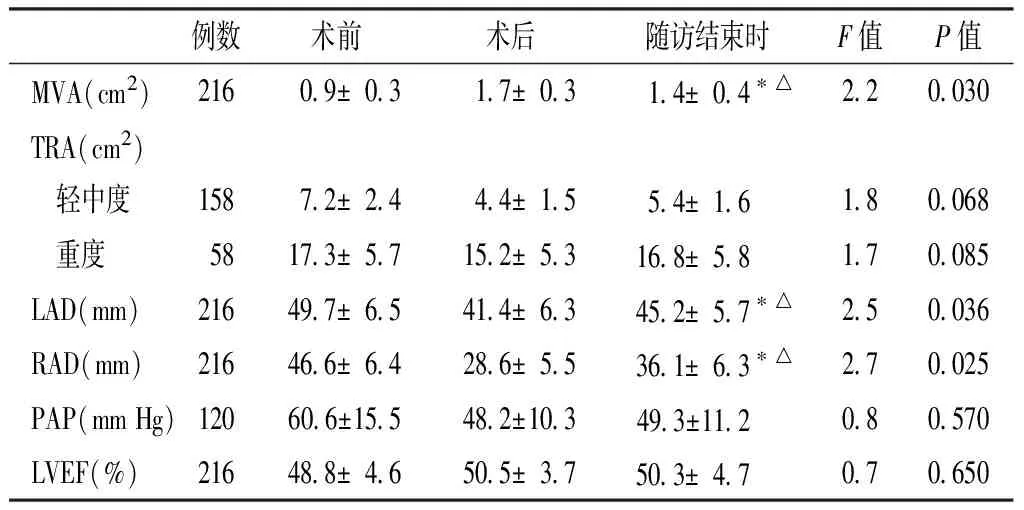
2.3 随访结束时超声心动图各参数的变化 随访结束时经彩色多普勒超声心动图复查,结果显示:MVA较术后减小,差异有统计学意义(P<0.05);LAD、RAD较术后增大,差异有统计学意义(P<0.05),但均未达到术前水平;术前、术后及随访结束时TRA、PAP、LVEF间比较,差异无统计学意义(P>0.05,见表2)。
表2 随访结束时超声心动图各参数的变化
Table2 The change of each parameters of echocardiograph at the end of follow up
例数术前术后随访结束时F值P值MVA(cm2)2160 9±0 31 7±0 31 4±0 4∗△2 20 030TRA(cm2) 轻中度1587 2±2 44 4±1 55 4±1 6 1 80 068 重度5817 3±5 715 2±5 316 8±5 8 1 70 085LAD(mm)21649 7±6 541 4±6 345 2±5 7∗△2 50 036RAD(mm)21646 6±6 428 6±5 536 1±6 3∗△2 70 025PAP(mmHg)12060 6±15 548 2±10 349 3±11 2 0 80 570LVEF(%)21648 8±4 650 5±3 750 3±4 7 0 70 650
注:与术后比较,*P<0.05;与术前比较,△P<0.05
3 讨论
风湿性心脏瓣膜病变由于肺血管长期淤血、肺血管和肺间质纤维化致肺阻力增高,产生肺动脉高压,右心房、右心室扩大与心肌劳损;同时由于右房室瓣结构薄,瓣叶的接触面较少,瓣环在前瓣与后瓣的附着处均在右心室游离壁上,当右心室扩大后右房室瓣环也随之扩大,致使右房室瓣前后瓣对合不良,出现功能性右房室瓣反流,而瓣膜本身可能并无病变[1-3]。
有文献报道,左房室瓣狭窄合并右房室瓣关闭不全的发生率为22%~50%[4]。美国的一项流行病学调查显示,中重度右房室瓣反流的患者约有160万之多,而每年行外科手术治疗的患者仅为8 000余人,许多患者在行左房室瓣或主动脉瓣手术时,医生忽略了对右房室瓣反流情况的检查。球囊扩张术是治疗有左房室瓣狭窄的有效方法[5-6],但对于合并右房室瓣关闭不全的患者疗效如何?早期报道认为,轻度的右房室瓣关闭不全在左心瓣膜病变得到纠正后就可得到逆转[2-5],然而,部分回顾性随访研究发现,尽管风湿性心脏病患者进行了左心瓣膜置换或修复术,术后右房室瓣关闭不全并未随左心瓣膜问题的改善而消失,有些患者甚至出现右房室瓣的重度关闭不全,并且成为风湿性心脏病患者瓣膜手术后远期死亡的主要原因之一,因而大部分研究者认为需要行PBMV治疗右房室瓣关闭不全[7-10]。本研究结果显示,经PBMV后MVA较术前增加,轻中度右房室瓣反流者术后TRA低于术前,术后LAP、RAD、LAD、RAD均较术前减小,且合并PAP患者术后压力低于术前;术后随访过程中患者胸闷、气促症状缓解,双下肢水肿明显减轻,肝脏肿大和肝区搏动明显减轻或消失,患者无严重并发症发生;同时随访结束时经彩色多普勒超声心动图复查结果发现MVA较术后减小,LAD、RAD较术后增大,但均未达到术前水平。提示对于风湿性心脏病以左房室瓣狭窄继发右房室瓣轻中度关闭不全的患者,及时行PBMV治疗不仅能显著增大左房室瓣口面积,减轻肺循环淤血,改善患者的症状和血流动力学,提高活动体力和生活质量,也可以减轻肺动脉高压和右房室瓣的反流,缩小RAD,阻止右心房的重构和右心衰竭,对于改善患者的预后有积极意义。
对于左房室瓣狭窄合并右房室瓣轻中度关闭不全,PBMV术是有效的治疗方法,但是合并右房室瓣重度关闭不全的患者PBMV治疗目前意见不一。本研究结果显示,对于重度右房室瓣反流者,术后TRA低于术前,但差异无统计学意义;且术前、术后及随访结束时TRA、PAP、LVEF间比较无差异。出现此现象的原因可能为右房室瓣重度关闭不全不单纯是功能性右房室瓣反流,部分合并右房室瓣器质性病变,而且持续肺动脉高压,右心室已经发生机械重构及明显扩大,即使成功的PBMV术也不能完全解决右房室瓣反流的问题。
综上所述,PBMV治疗风湿性心脏病左房室瓣中重度狭窄合并右房室瓣轻中度反流患者,可以改善生活质量,疗效肯定;但对于合并右房室瓣重度反流患者的疗效还有待于进一步观察。
1 Song JM,Kang DH,Song JK,et al.Outcome of significant functional tricuspid regurgitation after percutaneous mitral valvuloplasty[J].American Heart Journal,2003,145(2):371-376.
2 Sagie A,Schwammenthal E,Newell JB,et al.Significant tricuspid regurgitation is a marker for adverse outcome in patients undergoing percutaneous ballon mitral valvuloplasty[J].Journal of the American College of Cardiology,1994,24(3):696-702.
3 Hannoush H,Fawzy ME,Stefadouros M,et al.Regression of significant tricuspid regurgitation after mitral balloon valvotomy for severe mitral stenosis[J].American Heart Journal,2004,148(5):865-870.
4 Porter A,Shapira Y,Wurzel M,et al.Tricuspid regurgitation late after mitral valve replacement:clinical and echocardiographic evaluation[J].J Heart Valve Dis,1999,8(1):57-62
5 Oukerraj L,El Houari T,El Haitem N,et al.Percutaneous mitral valvuloplasty in patients with low cardiac output at high surgical risk[J].International Journal of Cardiology,2008,130(2):285-287.
6 Cubeddu RJ,Palacios IF.Percutaneous techniques for mitral valve disease[J].Cardiology Clinics,2010,28(1):139-153.
7 Shiran A,Sagie A.Tricuspid regurgitation in mitral valve diseaseincidence,prognostic implications,mechanism,and management[J].Journal of the American College of Cardiology,2009,53(5):401-408.
8 Boyaci A,Gokce V,Topaloglu S,et al.Outcome of significant functional tricuspid regurgitation late after mitral valve replacement for predominant rheumatic mitral stenosis[J].Angiology,2007,58(3):336-342.
9 Smíd M,Cech J,Rokyta R,et al.Mild to moderate functional tricuspid regurgitation:retrospective comparison of surgical and conservative treatment[J].Cardiol Res Pract,2010,pii:143878.
10 Song H,Kang DH,Kim JH,et al.Percutaneous mitral valvuloplasty versus surgical treatment in mitral stenosis with severe tricuspid regurgitation[J].Circulation,2007,116(11 Suppl):I246-I250.
