横断胸骨扩大胸腺切除治疗全身型重症肌无力
2014-02-08陈刚陈志明马勤运陈佶朱勇俊苗峰伍宁庞烈文
陈刚 陈志明 马勤运 陈佶 朱勇俊 苗峰 伍宁 庞烈文
自Blalock发现胸腺切除治疗重症肌无力的疗效以来,该方法已被胸外科及神经科领域医师认可。尽管详细的机制尚未完全阐明,临床实践证明实施胸腺切除术后,重症肌无力的缓解率可以达70%~80%。为使重症肌无力外科治疗效果得以进一步提高,在手术指征、手术时机、手术方式和围手术期处理方面仍存在不少争议。扩大胸腺切除术能够彻底切除胸腺(瘤)以及纵隔内常见的异位胸腺组织,并且有大量的临床结果已证实其确切疗效,因此仍然是众多重症肌无力治疗术式中最广泛和最常使用的术式[1-6]。
胸腺位于狭小的前纵隔间隙,毗邻纵隔结构复杂。为达到治疗重症肌无力的手术要求,以及外科手术自身的发展和外部需要,外科医师已经发展了多种手术入路,如经颈部入路、经胸膜腔入路(包括侧胸切口入路和胸腔镜入路)、经胸骨入路(包括胸部正中切口入路、部分胸骨切开入路和横断胸骨入路)。目前,以上各种手术入路在临床实践中均有应用。了解经不同手术入路行胸腺扩大切除的手术特点及临床结果,对于应对复杂多变的临床情况以及制定更好的临床决策有十分重要的意义。横断胸骨入路行胸腺切除最早由Otto等[7]在1987年予以系统报道,但系统性评价和大病例组报道并不多见,这可能与重症肌无力散在发病的特点以及大病例组长时间数据搜集和积累的难度较大有关。
自1997年起,横断胸骨扩大胸腺切除成为本单位外科治疗重症肌无力主要的手术入路之一,其早期结果由陈佶等[8]报道。随着该入路手术实践经验的积累以及长时间临床观察结果的不断显现,有必要对该手术入路进行阶段性审视,以便为不断改进我们的临床工作提供参考资料。为此,我们对该手术入路患者的临床资料进行回顾性分析,结合重症肌无力随访结果进行报道,并结合文献资料对该手术入路的特点进行分析讨论。
资料与方法
一、 临床资料
复旦大学附属华山医院胸心外科在1998至2008年间共有416例患者实施胸腺切除,其中211例诊断为全身型(改良Osserman分型Ⅱa、Ⅱb、Ⅲ)重症肌无力,经由横断胸骨入路进行扩大胸腺切除。211例重症肌无力患者年龄为6~75岁,中位年龄35岁;男性116例(54.9%),女性95例(45.1%);术前重症肌无力病程2~63个月;有50.7%(107/211)的患者在围术期接受糖皮质激素或其他免疫抑制剂治疗。
二、 方法
患者术前评估及准备按照外科诊疗流程进行,评估重点为重症肌无力的起病和发展、危象的发生情况、既往接受的治疗以及并发症。采集重要脏器功能及实验室生化结果,并进行必要调整。纵隔CT或磁共振成像(magnetic resonance imaging,MRI)资料由影像科医师及胸外科医师共同评估。胸廓异常包括脊柱侧弯、漏斗胸、鸡胸、外伤或手术后遗症改变等由胸外科医师进行严重性评估,并排除高危对象。围术期药物治疗根据会诊医师建议进行调整。患者基线临床特征见表1。

表1 211例横断胸骨扩大胸腺切除患者临床特征
手术患者接受全身麻醉及气管插管,已行气管切开患者无须再行气管插管,仅需连接通气管道及气切套管即可。患者取仰卧位,肩胛骨之间垫一小枕。皮肤切口选择第2、3肋软骨之间行弧形切开约8 cm,弧形皮肤切口能够在有限的切口宽度内提供更好的切口延展性以增加显露。垂直分离皮下组织至胸骨骨膜并向两侧延展。切断少量胸大肌内侧肌纤维及肋间内、外肌即可显露胸廓内动静脉。切断血管,残端牢固缝扎以防血管收缩滑脱导致出血。用手指或直角钳分离胸骨后间隙形成左右贯通的隧道。在第3肋软骨上缘水平横断胸骨,该操作可以使用Gigli钢丝锯或电动胸骨锯完成。使用骨蜡封闭出血的骨髓腔,用小号肋骨撑开器撑开胸骨断端即可显露前纵隔。在该切口下扩大胸腺切除即可按照胸部正中切口入路的操作步骤实施。双侧膈神经可以在胸膜外显露,心膈角脂肪垫可行胸膜外切除。如胸腺瘤累及心包或胸膜,可在该术野中一并切除。术野放置Redon负压引流管引流创面渗出,引流管由切口旁另行戳创引出。一般不涉及肺实质切除的手术过程,无须进行胸膜腔引流。胸骨断端可使用两根医用钢丝间断缝合,也可使用钛合金胸骨固定板加固。切口软组织分层缝合(图1)。
该手术入路围术期管理与胸部正中切口一致。患者术后第2天即可下床行走活动。术后第2或第3天拔除引流管。围术期糖皮质激素及免疫抑制剂依诊疗指南执行或根据会诊建议调整。一般患者术后第4天即可出院或转诊,并继续针对重症肌无力进行治疗。建议患者定期进行门诊随访。
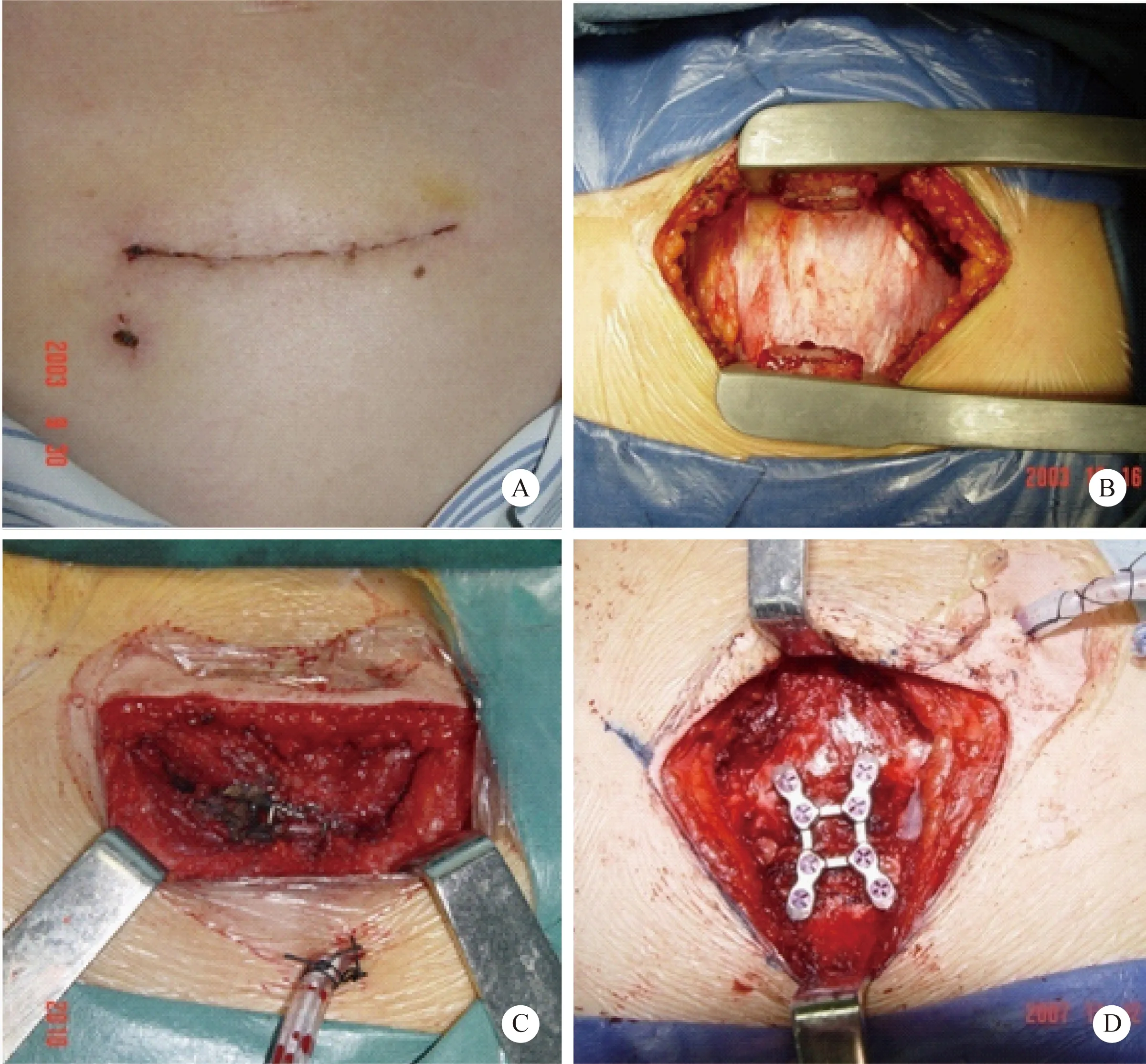
图1 横断胸骨入路手术切口
注:图A示切口部位选择,皮肤切口长约8 cm。弧形切口的底部位于第3肋软骨上缘,切口两侧上缘不超过第2肋软骨上缘。弧形切口在有限的切口长度内能够改善显露,过度延长的弧线既不美观也无增加显露的意义。该图例显示气管切开造口部位与横断胸骨切口的距离较远,便于术中操作及术后伤口护理,减少伤口感染机会。图B示横断胸骨撑开后暴露前纵隔,显露和操作空间均较为富足。图C和图D示胸骨对合可使用钢丝缝合或钛合金胸骨固定板固定
三、 疗效评估
完全缓解(complete remission,CR):患者无须服药,无重症肌无力症状,保持1年以上。部分缓解(partial remission,PR):重症肌无力症状明显减轻并且没有提高药物的治疗级别,或者偶尔出现重症肌无力症状但无须药物维持治疗或再入院治疗。疾病稳定(stable of disease,SD):症状无明显改善或加剧,仍然需接受药物治疗。疾病进展(progressive disease,PD):出现重症肌无力进展现象。
四、 统计学方法
统计学分析使用SPSS 11.0软件完成。对术后5年进行随访的患者根据是否合并胸腺瘤进行分组,并采用χ2检验比较两组间的疗效。P<0.05表示差异有统计学意义。
结 果
一、 术中和术后基本情况
211例选择横断胸骨实施扩大胸腺切除的患者手术过程中均无术中延长切口或改变手术入路的情况发生。其中15例患者手术时已行气管切开造口术,术中未出现操作不当引起的大出血。较为复杂的扩大切除包括胸膜切除36例,心包部分切除17例,肺组织部分切除7例,血管侧壁部分切除及血管成型5例。
77例患者术后病理证实为胸腺瘤,其中Masaoka-Koga Ⅰ期42例,Ⅱ期25例,Ⅲ期10例;1例患者病理证实为胸腺癌;7例为胸腺囊肿。
患者术后拔除引流管时间为1~10 d,平均(3.34±0.83)d;引流量30~380 ml,平均(198±72.29)ml。术后早期疼痛评估均为轻微至中度,患者出院时均无须继续使用镇痛药物。术后当天拔除气管插管176例,因围术期危象行再插管19例,气管切开9例;延期(术后1~5 d)拔除气管插管35例,因危象再插管5例,气管切开2例。除4例患者外,其他患者术后切口均愈合良好。其中2例患者出现胸骨断端轻微相对活动(均为钢丝固定),表面软组织愈合良好,临床评估患者无严重不适感。有1例男性患者行钢丝钛板复合固定,出院后第3天在家活动时跌倒,急诊入院再次手术发现胸骨断端撕脱,予以骨断面清创,再次以钢丝缝合,患者创面一期愈合。另有1例患者术后16个月出现胸骨固定钢丝断端组织不兼容表现(局部软组织红肿、刺痛),于局部麻醉下拆除固定钢丝。211例患者中未出现慢性骨髓炎或纵隔感染病例。患者对横断胸骨切口的美观效果接受程度较好(图2)。
二、 术后随访
对173例患者的术后5年随访结果分析表明,总缓解率为79.8%(138/173)。33例(19.1%)患者达到CR;105例患者(60.7%)达到PR;27例(15.6%)患者随访时SD,仍然在接受药物治疗,其中11例患者提高了药物治疗级别;8例患者在术后6个月出现PD,其中7例接受再入院治疗(3例因需要长时间呼吸支持进行了气管切开造口术),1例患者术后因出现重症肌无力危象未得到及时治疗而于院外死亡。
合并胸腺瘤组或未合并胸腺瘤组患者的随访结果见表2。有瘤和无瘤患者术后总缓解率分别为81.9%和78.2%,差异有统计学意义(χ2=0.362,P=0.548);两组患者在CR、PR、SD和PD等结局上差异无统计学意义。在合并有胸腺瘤的患者中,Masaoka-Koga Ⅰ期患者术后均无重症肌无力PD结局,Ⅱ期和Ⅲ期患者中分别有2例和3例出现PD结局。72例合并胸腺瘤患者在随访期内均未出现肿瘤复发征象。
讨 论
由于重症肌无力发病散在,疾病检出率不高,针对该疾病严格意义上的诊疗规范较难确立。技术发展带来新的术式和手术入路,使得医疗观念和实践在不同时期、不同地域甚至不同医疗机构之间的差异性较大。近年来此方面的讨论主要体现在手术范围和手术入路上[4-5,9-12]。横断胸骨手术入路在涉及纵隔部位的手术中早有应用,以病例报道为主,侧重于该入路特点的讨论较少。1987年,Otto等[7]报道了一组使用该入路进行胸腺切除的病例。

图2 行胸腺切除术的重症肌无力患者一期愈合的横断胸骨入路手术切口
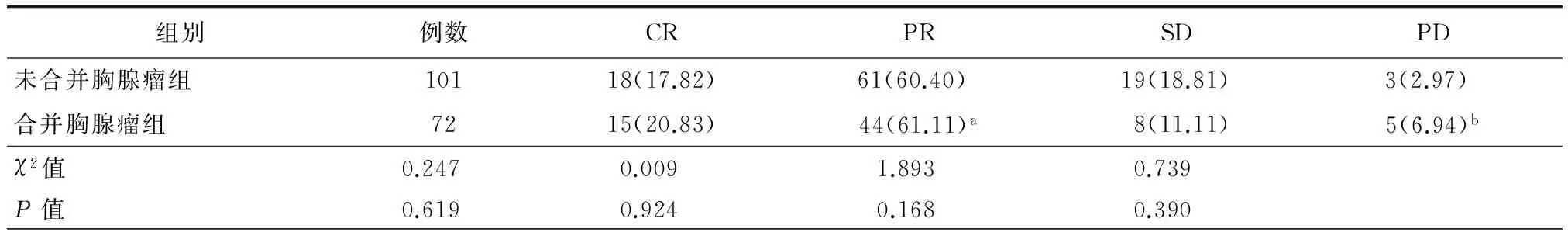
组别例数CRPRSDPD未合并胸腺瘤组10118(17.82)61(60.40) 19(18.81)3(2.97) 合并胸腺瘤组7215(20.83)44(61.11)a8(11.11)5(6.94)bχ2值0.247 0.009 1.893 0.739 P值0.619 0.924 0.168 0.390
注:a包括1例胸腺癌患者;b包括1例因重症肌无力危象发作于院外死亡患者;CR为完全缓解;PR为部分缓解;SD为疾病稳定;PD为疾病进展
此后一段时间内,亚、欧、美医师均有少量在此方面不同规模的临床实践报道。由于较大病例组横断胸骨扩大胸腺切除的应用局限于一部分医疗中心,将这部分资料整理后进行回顾性分析将有助于从多个角度理解重症肌无力的外科治疗,在临床实践决策时提供参考。
目前,大部分该领域的胸外科医师认同扩大胸腺切除对重症肌无力的治疗效果显著,并成为临床实践中选择的主要术式。从本组病例经验来看,横断胸骨入路能够满足扩大胸腺切除的需要,并且也适用于合并Masaoka-Koga Ⅰ期和Ⅱ期胸腺瘤的患者。随访结果证实,该组患者的重症肌无力缓解率及肿瘤控制效果与其他手术入路的结果相当。本组手术与Otto采用的横断胸骨手术入路相比有一些不同之处:(1)建议采用8 cm长度切口而不是6 cm;(2)横断胸骨的水平位于第3肋软骨上缘;(3)离断胸廓内动静脉。这些细微差异在实践中证实能够改善手术显露,并且不影响愈合及美观效果。
对于无瘤患者,即使是胸腺肥大的患者,该手术入路也足以提供充裕的探查及操作空间。我们采用比较公认的扩大胸腺切除术的定义,其范围包括上方至颈胸交界处的上极及其周围脂肪组织,下方至胸腺下极(通常位于第3或第4肋软骨水平)及向两侧延伸的心膈角脂肪垫,深部进入左无名静脉和升主动脉之间的不规则腺叶及脂肪组织,以及进入主-肺动脉窗的不规则腺叶组织,双侧沿膈神经前方延伸至双侧无名静脉向内侧汇聚处的脂肪组织[1,4]。
Masaoka-Koga Ⅰ期和Ⅱa期胸腺瘤大多呈圆形或椭圆形,可伴有浅分叶,包裹性一般较好。对于这一类肿瘤在横断胸骨切口术野中可以在直视下完整切除。对于Ⅱb期患者,受累及的心包和胸膜在安全距离外一并整块切除,以免出现切缘阳性的结果。通常切除后的胸膜和心包缺损不需修补重建。如术前影像学诊断为Ⅲ期胸腺瘤,应当慎重选择横断胸骨入路。从本组资料看来,术中偶尔发现的Ⅲ期胸腺瘤外侵范围有限,横断胸骨入路也能达到手术彻底切除的标准。如无名静脉侧壁受累,可以采取血管侧壁切除直接缝合修补,或者暂时阻断血管使用自体心包片进行修补。有时需要将升主动脉外膜连同肿瘤一并削下,谨慎的操作可以减少穿透血管壁的危险。如遇血管壁穿透,可用手指压迫再进行缝合止血。本组有2例患者左无名静脉因肿瘤累及直接切除并未进行重建(因同时进行心包部分切除),其中1例患者术后出现左无名静脉断端近端血栓形成,但无相关不适主诉或其他临床表现;另1例术后未出现异常。根据经验我们认为,对术前胸腺瘤分期在Ⅲ期以上的患者,为术中更好地对手术内容和远期肿瘤学控制,其他能够进行更大范围显露和操作的入路(如胸部正中切口、侧胸切口或联合切口)比横断胸骨入路更具优势。横断胸骨入路的手术切口也可以在必要时沿两侧肋间延长,形成类似“蚌壳切口”的显露,但在大多数情况下这不是一种最佳选择,术前影像解剖学分析对避免术中被动改变切口方式有重要意义。
胸部正中切口是处理前纵隔疾病的“外科标准入路”,对于评价胸腺切除术的入路也是如此。相对其他各种单一切口,胸部正中切口对前纵隔和颈根部的显露具有不可比拟的优势。双侧肺门及胸膜腔探查较为容易。因此,提倡对重症肌无力患者实施“最大胸腺切除术”的研究者更推荐该手术入路[9,13-15]。但临床观察表明,接受最大胸腺切除术的患者较接受扩大胸腺切除术的患者并没有因为切除更多的异位胸腺组织而得到明显的临床受益[10,16-18]。在对较大肿瘤或涉及复杂血管操作的手术过程中,选择胸部正中切口更为理性,手术过程会更加从容。但纵行切开的胸骨创面较大,手术开始及结束时需要耗费较多的时间用于止血及固定胸骨。胸骨向两侧撑开过大时易导致骨折以及压迫胸廓出口。对于已行气管切开或术后需行气管切开的患者,由于距离手术切口较近,易导致切口污染甚至引发纵隔感染[19]。一旦发生纵隔感染或胸骨骨髓炎,因炎症物质隐匿在暴露的骨小梁之间,较难彻底清除。胸部正中切口所造成的外观影响也是妨碍年轻人,尤其是女性患者及时接受手术的一个重要因素[20]。
如同其他手术一样,微创也是该领域外科医师不断追求的一个目标。颈部入路胸腺切除被认为是创伤最小的手术入路[4,21-33]。在特制的胸骨拉钩的帮助下,胸腺可由胸骨上切口牵出,完全包埋于胸腺实质内的小胸腺瘤也可经该切口一并切除。该入路下需要外科医师更多地使用钝性分离技术,发生血管或神经损伤的可能性较高。检查切除的胸腺标本往往会发现胸腺包膜已被撕裂,这意味着可能会有胸腺组织残留于术野。胸腺瘤一旦达到一定大小或与周围组织粘连紧密,该切口下可能会束手无策而需要改变手术策略或降低手术目标。胸腺周围组织清除不彻底是该入路最常被质问的弱点。即便采取了一些改进措施,如增加剑突下切口或胸骨旁切口,颈部入路的局限性对胸外科医师而言仍然是显而易见的。
胸腔镜胸腺切除手术是近年来关注最多的,并且已经有相当数量的早期结果见诸报道。该手术入路在技术上解决了保护胸骨的完整性问题,同时双侧胸腔镜技术满足了切除异位胸腺组织的要求,对膈神经的探查和保护较好,一些早期胸腺瘤也可在胸腔镜下实施完整切除[25-30],但双侧胸腔镜手术操作因为需要术中调整患者体位或改变手术台设置而更加费时。胸膜腔粘连以及不能耐受单肺通气的患者是此类手术的禁忌证。该项技术的主要难点在于保持胸骨完整性后前纵隔可操作间隙较小,而纵隔其他结构的形变性较低,尤其在体积较大的胸腺瘤存在时显得更为明显。对大多数胸外科医师而言,在胸腔镜下完成对心包内结构和大血管的手术操作仍然十分困难,这是Ⅱb期和Ⅲ期胸腺瘤手术中时常遇到的情况。术后双侧胸腔引流及伴随的肋间疼痛会影响患者术后早期活动和康复。该入路对胸膜腔密闭性的破坏也引起胸腺瘤组织在胸膜腔内种植的担忧。尽管存在许多尚需解决的问题和争论,但胸腔镜胸腺切除仍然是最有前景的。
综上所述,横断胸骨扩大胸腺切除治疗全身型重症肌无力,术后大多数患者得到缓解,缓解率与胸部正中切口相当。该手术入路适用于合并Masaoka-Koga分期Ⅰ期和Ⅱ期胸腺瘤的患者或无瘤患者。该手术入路的特点是对胸骨损伤远小于传统胸部正中切口,手术入路直接、易操作,术后伤口护理简单,手术并发症发生率低,对气切患者适用并且影响较小,术后不适感少,具有一定的美观效果。在重症肌无力的外科治疗时,该手术入路可以作为供选择的方案之一,尤其在其他入路实施困难时。对分期较高的胸腺瘤患者,应当首先考虑其他手术入路以便达到更好的手术和临床效果。结合患者具体情况进行分析,优化手术决策是外科治疗重症肌无力时的重要步骤[20,34]。
1Masaoka A, Yamakawa Y, Niwa H, et al. Extended thymectomy for myasthenia gravis patients: a 20-year review[J]. Ann Thorac Surg, 1996; 62(3):853-859.
2Park IK, Choi SS, Lee JG, et al. Complete stable remission after extended transsternal thymectomy in myasthenia gravis[J]. Eur J Cardiothorac Surg, 2006; 30 (3): 525-528.
3Zielinski M, Hauer L, Hauer J, et al. Comparison of complete remission rates after 5 year follow-up of three different techniques of thymectomy for myasthenia gravis[J]. Eur J Cardiothorac Surg, 2010, 37 (5): 1137-1143.
4Jaretzki A. Thymectomy for myasthenia gravis: analysis of controversies—patient management[J]. Neurologist, 2003, 9(2):77-92.
5Ponseti JM, Gamez J, Vilallonga R, et al. Influence of ectopic thymic tissue on clinical outcome following extended thymectomy in generalized seropositive nonthymomatous myasthenia gravis[J]. Eur J Cardiothorac Surg, 2008, 34(5):1062-1067.
6Mulder DG. Extended transsternal thymectomy[J]. Chest Surg Clin N Am, 1996, 6(1):95-105.
7Otto TJ, Strugalska H. Surgical treatment for myasthenia gravis[J]. Thorax, 1987, 42(3):199-204.
8陈佶,庞烈文,陈志明,等.第二肋间横断胸骨小切口胸腺切除治疗重症肌无力[J].中华外科杂志,2007,45(10):718-719.
9Jaretzki A, Wolff M. “Maximal” thymectomy for myasthenia gravis. Surgical anatomy and operative technique[J]. J Thorac Cardiovasc Surg, 1988; 96(5):711-716.
10 Masaoka A. Extended trans-sternal thymectomy for myasthenia gravis[J]. Chest Surg Clin N Am, 2001, 11(2):369-387.
11 Klimek-Piotrowska W, Mizia E, Kuzdzal J, et al. Ectopic thymic tissue in the mediastinum: limitations for the operative treatment of myasthenia gravis[J]. Eur J Cardiothorac Surg, 2012, 42(1):61-65.
12 Zieliński M, Kuzdzal J, Szlubowski A, et al. Comparison of late results of basic transsternal and extended transsternal thymectomies in the treatment of myasthenia gravis[J]. Ann Thorac Surg, 2004, 78(1):253-258.
13 Jaretzki A, Penn AS, Younger DS, et al. “Maximal” thymectomy for myasthenia gravis. Results[J]. J Thorac Cardiovasc Surg, 1988, 95(5):747-757.
14 Lee CY, Lee JG, Yang WI, et al. Transsternal maximal thymectomy is effective for extirpation of cervical ectopic thymic tissue in the treatment of myasthenia gravis[J]. Yonsei Med J, 2008; 49(6):987-992.
15 Prokakis C, Koletsis E, Salakou S, et al. Modified maximal thymectomy for myasthenia gravis: effect of maximal resection on late neurologic outcome and predictors of disease remission[J]. Ann Thorac Surg, 2009, 88(5):1638-1645.
16 Daniel VC, Wright CD. Extended transsternal thymectomy[J]. Thorac Surg Clin, 2010, 20(2):245-52.
17 Bulkley GB, Bass KN, Stephenson GR, et al. Extended cervicomediastinal thymectomy in the integrated management of myasthenia gravis[J]. Ann Surg, 1997, 226(3):324-334; discussion 334-335.
18 Kattach H, Anastasiadis K, Cleuziou J, et al. Transsternal thymectomy for myasthenia gravis: surgical outcome[J]. Ann Thorac Surg, 2006, 81(1):305-308.
19 Curtis JJ, Clark NC, McKenney CA, et al. Tracheostomy: a risk factor for mediastinitis after cardiac operation[J]. Ann Thorac Surg, 2001, 72(3):731-734.
20 Magee MJ, Mack MJ. Surgical approaches to the thymus in patients with myasthenia gravis[J]. Thorac Surg Clin, 2009, 19 (1):83-89.
21 Shrager JB. Extended transcervical thymectomy: the ultimate minimally invasive approach[J]. Ann Thorac Surg, 2010, 89(6):S2128-2134.
22 Meyers BF, Cooper JD. Transcervical thymectomy for myasthenia gravis[J]. Chest Surg Clin N Am, 2001, 11(2):363-368.
23 Komanapalli CB, Cohen JI, Sukumar MS. Extended transcervical video-assisted thymectomy[J]. Thorac Surg Clin, 2010, 20(2):235-243.
24 Ferguson MK. Transcervical thymectomy[J]. Semin Thorac Cardiovasc Surg, 1999, 11(1):59-64.
25 Scelsi R, Ferro MT, Scelsi L, et al. Detection and morphology of thymic remnants after video-assisted thoracoscopic extended thymectomy (VATET) in patients with myasthenia gravis[J]. Int Surg, 1996, 81(1):14-17.
26 Whitson BA, Andrade RS, Mitiek MO, et al. Thoracoscopic thymectomy: technical pearls to a 21st century approach[J]. J Thorac Dis, 2013, 5(2): 129-134.
27 Lee CY, Kim DJ, Lee JG. Bilateral video-assisted thoracoscopic thymectomy has a surgical extent similar to that of transsternal extended thymectomy with more favorable early surgical outcomes for myasthenia gravis patients[J]. Surg Endosc, 2011, 25(3):849-854.
28 Makoto O, Tadashi A, Shohei M. Oncological outcomes of thoracoscopic thymectomy for the treatment of stages Ⅰ-Ⅲ thymomas[J]. Interact Cardiovasc Thorac Surg, 2013, 17(2): 285-290.
29 Kimura T, Inoue M, Kadota Y. The oncological feasibility and limitations of video-assisted thoracoscopic thymectomy for early-stage thymomas[J]. Eur J Cardiothorac Surg, 2013, 44(3):e214-218.
30 Zahid I, Sharif S, Routledge T, et al. Video-assisted thoracoscopic surgery or transsternal thymectomy in the treatment of myasthenia gravis?[J] Interact Cardiovasc Thorac Surg, 2011, 12(1):40-46.
31 Youssef SJ, Louie BE, Farivar AS, et al. Comparison of open and minimally invasive thymectomies at a single institution[J]. Am J Surg, 2010, 199(5):589-593.
32 Meyer DM, Herbert MA, Sobhani NC, et al. Comparative clinical outcomes of thymectomy for myasthenia gravis performed by extended transsternal and minimally invasive approaches[J]. Ann Thorac Surg, 2009, 87(2):385-390.
33 Zielinski M, Kuzdzal J, Szlubowski A, et al. Transcervical-subxiphoid-videothoracoscopic “maximal” thymectomy—operative technique and early results[J]. Ann Thorac Surg, 2004; 78(2):404-409.
34 Urschel JD, Grewal RP. Thymectomy for myasthenia gravis[J]. Postgrad Med J, 1998, 74(869):139-144
