253例直径≤1 cm的孤立性肺结节的胸腔镜诊治经验
2014-02-08邱斌冯飞跃高树庚
邱斌 冯飞跃 高树庚
像学检查发现46例,恶性肿瘤随访检查发现64例。
随着CT扫描设备和扫描技术的进步,越来越多的肺部小结节得以发现。据文献报道,在年龄≥50岁的吸烟人群中,薄层胸部CT扫描发现肺部小结节的比例可高达51%[1]。尽管CT扫描所发现的肺部小结节绝大部分为良性,但也不能错过早期、可治愈肺癌的诊断机会。因此,其诊断、随访和处理对临床医师提出了新的挑战。在权衡了随访观察、活检和手术切除的风险与收益之后,NCCN和Fleischner学会分别提出了肺部小结节的随访和处理指南[1-2]。
本文回顾性总结中国医学科学院北京协和医学院肿瘤医院胸外科自2011年7月至2014年6月期间采用胸腔镜手术切除的253例肺部小结节(直径≤1 cm)的临床和病理特点,并探讨肺部小结节的临床诊治策略及胸腔镜外科处理的指征和方法。
资料与方法
一、 临床资料
自2011年7月至2014年6月,本院胸外科胸腔镜手术切除直径≤1 cm(CT肺窗测量)的肺部孤立性小结节253例,其中男性患者107例,女性患者146例;年龄27~81岁,中位年龄57岁;无症状健康查体发现75例,非特异性呼吸道症状(咳嗽、胸闷、胸疼)发现68例,非肿瘤性疾病胸部影
二、 术前检查
术前常规行血常规、血生化、凝血功能检查,以及心电图和增强CT检查。其中117例患者进行了PET/CT检查。肺窗测量病变的直径分布:<5 mm者27例,5~7 mm者60例,≥8 mm者166例。
三、 手术方法
全部患者均采用胸腔镜下手术,依据胸腔形状及病变位置不同,选择合适的切口。一般以腋前线第七肋间作为胸腔镜观察孔,上、下叶病变分别以腋前线第3、第4肋间2.5 cm切口作主操作孔,视病变位置及操作难易程度酌情附加腋后线第9肋间1.5 cm切口作副操作孔。其中34例采用单孔胸腔镜手术。
结 果
一、 手术过程及术后恢复情况
本组患者均采用胸腔镜下手术,其中3例患者因肺门结构解剖困难而中转腔镜辅助小切口手术。楔形切除98例,解剖性肺段切除52例,肺叶切除103例。术中冰冻考虑原发肺癌134例,均行纵隔及肺门淋巴结清扫,以获得准确的分期。本组患者手术时间20~190 min,平均(93.0±29.6)min,术中出血量5~180 ml,平均(45.0±31.0)ml;术后住院时间2~10 d,平均(5.6±1.8)d;术后胸管留置2~7 d,平均(3.9±1.2)d;术后引流总量60~1 210 ml,平均(394±254)ml。术后并发症:室上性心律失常10例,术后残肺漏气超过5 d者5例,乳糜胸1例,肺不张或肺炎6例,皮下气肿10例,切口愈合不良14例,全组无住院期间死亡病例。
二、 病理结果
本组253例直径≤10 mm的孤立性肺结节术后病理结果见表1。

表1 253例直径≤10 mm孤立性肺结节术后病理结果
三、 病变大小与病变性质的关系
本组253例不同直径的孤立性肺结节的术后病理结果见表2。
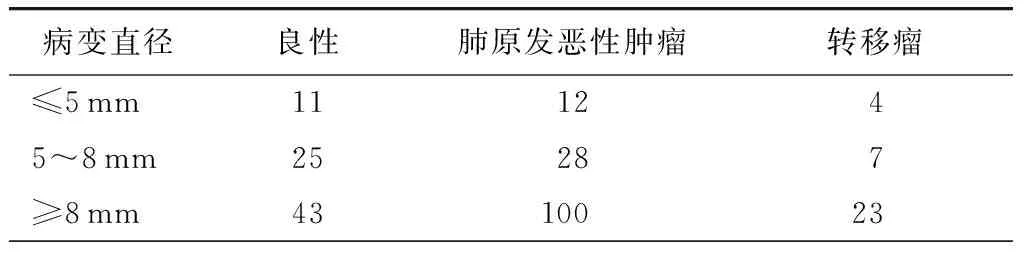
表2 253例直径≤10 mm的孤立性肺结节术后病理结果(例)
四、 病变大小与肺原发恶性肿瘤病理分期情况
本组140例肺原发恶性肿瘤病理分期见表3。
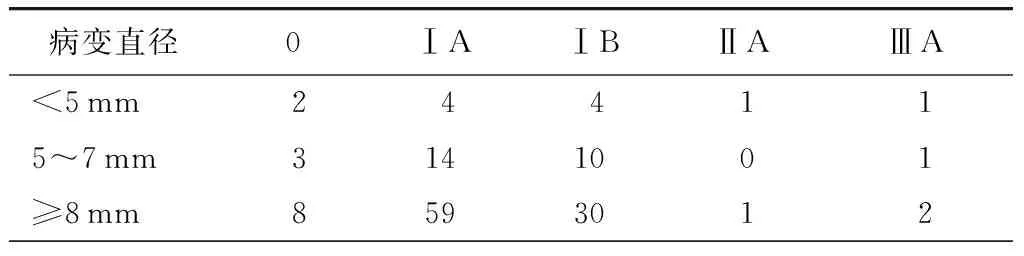
表3 140例原发肺癌分期及病变大小情况(例)
讨 论
孤立肺结节的病因很多,包括恶性疾病(如原发肺癌、类癌、淋巴瘤、单发肺转移瘤)和一系列良性疾病(如非特异性肉芽肿、特异性肉芽肿性炎、错构瘤等)[3]。低剂量CT筛查发现直径≤1 cm非钙化肺结节的长期随访结果显示,恶性发生比例较低[4]。
尽管CT扫描发现的肺部小结节绝大部分为良性,但也不能错过早期、可治愈肺癌的诊断机会,因此其诊断、随访和处理对临床医师提出了新的挑战。在权衡了随访观察、活检和手术切除的风险与收益之后,NCCN和Fleischner学会分别提出了肺部小结节的随访和处理指南[1-2];国内也有学者对肺部小结节的临床、病理特点进行了总结分析[5]。
胸部低剂量CT肺癌筛查研究使得人们对于肺部小结节的流行病学、影像病理联系、生物学特征、生长速度等方面积累了丰富的经验。高分辨薄层CT扫描能显示孤立肺结节的大小、密度特点、边缘特征、临近结构的改变以及强化程度等,提供良恶性鉴别的放射学证据,但大多数影像学征象在良恶性疾病中均可出现。
对于直径≤1 cm的孤立性肺部小结节,其大小的准确测量、影像学特征的良好观察以及随访复查时的动态观察比较,对CT设备和扫描技术提出了较高的要求。NCCN肺癌筛查指南要求使用16排以上的CT、在最大吸气相获取图像、单次屏气时间≤10 s并推荐扫描层厚≤1 mm。本组253例患者,术前均行64排及以上高分辨CT薄层扫描,对病变位置、大小、密度特点、有无钙化及脂肪密度、病变边缘和形态特征等进行仔细观察。
对于直径≤1 cm的孤立肺结节,其诊断要根据患者的临床危险因素和CT影像学特点,处理则要综合考虑恶性的可能性、手术治疗的可能益处和危害、现有诊断研究的准确性和患者的意愿。Mayo Clinic 6确立了6个独立预测恶性的因素(3个临床因素和3个影像学因素):年龄大、吸烟史、胸部以外肿瘤史、结节直径大、上叶病变以及出现毛刺,据此建立了评估恶性可能性的预测模型。对于恶性可能性非常低的患者,要求系列CT仔细观察;对于良恶性可能性不确定的患者,推荐CT引导下的针吸活检或PET/CT;对于恶性可能性高的患者,要求手术诊断[6]。
结节大小、边缘及密度特点对于良恶性判断具有重要意义。美国胸科医师协会(American College of Chest Physicians, ACCP)报道的7项肺癌筛查研究发现的肺结节中,不同直径肺结节的恶性比例分别为:<5 mm者为0~1%,5~10 mm者为6%~28%,11~20 mm者为33%~64%,>20 mm者为64%~82%[7]。弥漫性、中心性、层状或爆米花样良性钙化形式、结节内含有脂肪密度(例如错构瘤)预示恶性可能性较低,而点状钙化、偏心性钙化则不能排除恶性[8]。一般而言,结节边缘不规则、分叶、毛刺者较边缘光滑者的恶性可能性大,磨玻璃样结节或部分实性结节较实性结节的恶性可能性大[7]。
NCCN非小细胞肺癌治疗指南中,对于初次发现的直径<8 mm的实性结节、≤10 mm的非实性结节建议进行影像学随访观察;将实性和非实性结节体积增大或实性成分增多作为怀疑恶性的参考标准;而对于直径≥8 mm的实性非钙化结节,建议行PET/CT检查辅助诊断。
研究显示,对于恶性病变的诊断,PET的敏感度和特异度可达87%和83%,如临床判断恶性可能性较低且PET结果为阴性,可以考虑仔细随访观察[9]。然而,PET对于直径<8 mm的结节不敏感,对于原位腺癌、类癌和黏液腺癌,可表现为假阴性;而对于炎症反应(结节病、类风湿结节)或感染(真菌、分枝杆菌感染)可表现为假阳性[3]。
支气管镜检查对于周围型肺结节,尤其是体积较小者,诊断价值并不满意,因为小的周围型肺结节可能难以窥及,且抵达小的周围型肺结节的支气管径路的确定通常较困难,难以获取充足的标本以完全排除恶性可能。EBUS-TBLB、电磁导航支气管镜以及经皮肺穿刺活检等方法对直径<10 mm的肺结节进行准确诊断也仍有一定困难。
本组253例孤立性肺结节中,良性病变、恶性病变、原发肺癌分别占31.2%、68.8%和55.3%;其中,直径<5 mm、5~7 mm、≥8 mm者恶性占比分别为59.3%、58.3%和74.1%,原发肺癌占比分别为44.4%、46.7%和60.2%。本组253例直径≤1 cm的孤立性肺结节中有79例为良性病变,占31.2%。由于工作环境、收入、受教育程度等方面较为优越,患者对自身健康程度的重视度普遍较高,具有较强的手术意愿。本组资料显示不同大小的孤立性肺结节均有恶性可能,因此我们认为,孤立性肺结节良恶性可能性的判定和临床决策,不应仅依据结节大小,应综合考虑患者的临床危险因素、病变的影像学特征及大小,尤其是结节特征和大小的动态变化。
胸腔镜外科创伤小、恢复快,为孤立性肺结节的诊断和治疗提供了新的途径。对临床上无法排除恶性可能的孤立性肺结节,胸腔镜结合术中快速冰冻病理的诊治一体化模式显示出了明显的优势。周围型肺结节行电视辅助胸腔镜外科(video-assisted thoracic surgery, VATS)肺楔形切除、结节位置较深者可以行所在肺段的解剖性切除,结合术中快速冰冻病理检查即可以明确诊断。
孤立性肺结节的术中定位是胸腔镜外科诊治的重要环节,有手指或器械触摸法、hook-wire定位法、示踪剂注射标记法、术中超声定位法等。本组患者肺结节的术中定位,主要是依据术前胸部CT影像来确定病变解剖位置,有针对性地进行术中触摸。因此,要求术者在术前仔细阅读影像资料、形成清晰的三维立体解剖定位印象,并对萎陷后的肺解剖形态变化有深刻的理解。对于术中触摸不满意,尤其是病变位置深在或与正常肺组织难以区分者,行目标肺段的解剖性切除。对于术中定位不确切者,禁忌行盲目的肺楔形切除,以免遗漏病变并加大进一步寻找的难度。
如病理提示为原发肺癌,可依据具体情况选择部分肺叶(楔形、肺段)或肺叶切除。NCCN指南推荐进行解剖性肺切除(肺段或肺叶)并进行淋巴结系统性清扫或采样,目前肺叶切除仍然是肺癌手术的金标准,对于ⅠA期周围型肺癌也可选择解剖性肺段切除,但要求满足以下条件:(1)因合并疾病或肺功能降低不能耐受肺叶切除;(2)肿瘤直径≤20 mm,且满足下述标准之一:原位腺癌、磨玻璃样结节比例≥50%、肿瘤倍增时间≥400 d。
本组患者原发肺癌140例,其中6例(4.3%)病理检查发现肺门和(或)纵隔淋巴结转移,直径<5 mm、5~7 mm、≥8 mm者分别有2例(16.7%)、1例(3.6%)和3例(3.0%)发现淋巴结转移。我们认为,对于病理诊断为原发肺癌的肺部小结节,不论病变大小均有淋巴结转移的可能性,因此,系统性淋巴结清扫或采样不可或缺。
肺部小结节胸腔镜微创外科诊治一体化模式,为肺部小结节的诊治提供了新的途径。但外科干预时机的选择依然是临床上的难题,如何减少良性结节的外科干预比例以及正确把握癌前病变或原位癌以及早期肺癌的干预时机,是下一步研究的方向。期待分子诊断方法的发展能为肺部小结节的诊治提供有价值的参考。
1 MacMahon H, Austin JHM, Gamsu G, et al. Guidelines for management of small pulmonary nodules detected on CT scans: a statement from the Fleischner Society[J]. Radiology, 2005, 237(2): 395-400.
2 Naidich DP, Bankier AA, MacMahon H, et al. Recommendations for the management of subsolid pulmonary nodules detected at CT: a statement from the Fleischner Society[J]. Radiology, 2013, 266(1): 304-17.
3 Ost DE, Gould MK. Decision making in patients with pulmonary nodules[J]. Am J Resp Crit Care Med, 2012, 185(4): 363-72.
4 Slattery MM, Foley C, Kenny D, et al. Long-term follow-up of non-calcified pulmonary nodules (<10 mm) identified during low-dose CT screening for lung cancer[J]. Eur Radiol, 2012, 22(9): 1923-1928.
5 Shi CZ, Zhao Q, Luo LP, et al. Size of solitary pulmonary nodule was the risk factor of malignancy[J]. J Thorac Dis, 2014, 6(6): 668-676.
6 Swensen SJ, Silverstein MD, Ilstrup DM, et al. The probability of malignancy in solitary pulmonary nodules. Application to small radiologically indeterminate nodules[J]. Arch Intern Med, 1997, 157(8): 849-855.
7 Wahidi MM, Govert JA, Goudar PK, et al. American College of Chest Physicians. Evidence for the treatment of patients with pulmonary nodules: when is it lung cancer? ACCP evidence-based clinical practice guidelines (2nd edition)[J]. Chest, 2007, 132(3 Suppl): 94S-107S.
8 Siegelman SS, Khouri NF, Scott WW, et al. Pulmonary hamartoma: CT findings[J]. Radiology, 1986, 160(2): 313-317.
9 Swensen SJ, Jett JR, Hartman TE, et al. CT screening for lung cancer: five-year prospective experience[J]. Radio-logy, 2005, 235(1): 259-265.
