食管癌术后再入重症监护病房患者的严重并发症特征分析
2014-02-08杨玉赏彭俊王文凭胡杨王允陈龙奇
杨玉赏 彭俊 王文凭 胡杨 王允 陈龙奇
食管癌是目前人类常见的消化道恶性肿瘤[1],外科治疗是主要的治疗手段。虽然一个世纪以来食管癌外科技术不断进步,但仍存在着较高的围术期风险和术后并发症发生率[2]。术后并发症的发生可延长住院时间,增加术后病死率,加重患者的经济负担。根据并发症的特点,可大体将食管癌术后并发症分为两个方面:一是外科性并发症,包括吻合口瘘、出血、乳糜胸、膈疝、休克、脓胸等;二是内科性并发症,包括肺炎、心血管、肾功能不全、肝功能不全、神经系统并发症等[2-3]。在过去几十年中,食管癌术后主要致死性并发症的构成发生了变化,关于定义“严重并发症”,各类报道说法不一,统计上也可能有疏漏。在本研究中,我们以达到再入重症监护病房(intensive care unit,ICU)进行治疗和生命支持为标准,来界定并发症的严重程度,拟通过分析术后因为严重并发症导致再入ICU的患者资料,总结其临床特征。同时,检索关于食管癌术后并发症的文献报道,总结几十年来严重并发症构成的变化特点。
资料与方法
一、 病例资料
2009年1月至2013年12月,华西医院胸外科共实施3 171例食管癌切除术,其中153例(男性129例,女性24例)因术后严重并发症再入ICU,再入率为4.8%;再入ICU患者的年龄为40~83岁,平均(63.34±8.84)岁。所有食管癌切除术均在静脉-吸入复合麻醉、气管插管单肺通气条件下实施。患者手术结束拔除气管插管后将在麻醉复苏室或ICU度过初步苏醒期,再转回普通病房。“再入ICU”的定义:食管癌术后因为严重并发症,难以在普通病房处理,需转入ICU进行生命支持、治疗和监护。因术后严重并发症再入ICU患者的基本信息、并发症情况、治疗结局等资料都进行了收集和分析。另外,部分患者术后并发症在普通病房可进行有效处理,达不到再入ICU的标准,此类情况不纳入此次研究。分析导致再入ICU的严重并发症种类、发生率、病死率以及与ICU死亡相关的危险因素。
二、 文献分析
通过检索近一个世纪以来食管癌并发症相关的文献报道,分析严重并发症构成的变化特点和内在原因。以“esophageal cancer、esophagectomy、oesophagectomy、mortality、morbidity、complication”为主要检索词检索PubMed、Cochrane Library和EMbase数据库,检索时间截至2014年1月。此外,追查已纳入文献的参考文献。检索所得文献累计共纳入病例40 000例。
三、 统计学方法
采用SPSS 16.0 for Windows (SPSS Inc., Chicago, IL, USA)软件进行统计学分析。因非肺部并发症再入ICU后继发或未继发肺炎组病死率比较采用卡方检验;罹患继发肺炎患者与非继发肺炎患者ICU住院时间比较采用非参数秩和检验(Mann-Whitney检验);患者ICU死亡相关危险因素分析采用非条件Logistic多因素回归分析。P<0.05表示差异有统计学意义。
结 果
一、 基本情况和住院时间
153例食管癌患者肿瘤的位置、手术方法、病理类型和TNM分期见表1。患者再入ICU的时间为术后1~28 d,中位时间为术后5.0 d。不同并发症转入ICU的术后时间窗差异有统计学意义(χ2=21.012,P<0.01)。再入ICU住院时间为1~40 d,平均(7.7±6.5)d,其中治疗后顺利转回普通病房患者的平均ICU住院时间为(6.1±4.6)d,而最终死亡患者的ICU住院时间为(10.2±8.1)d,两组患者住院时间比较差异存在统计学意义(Z=-2.964,P<0.01)。
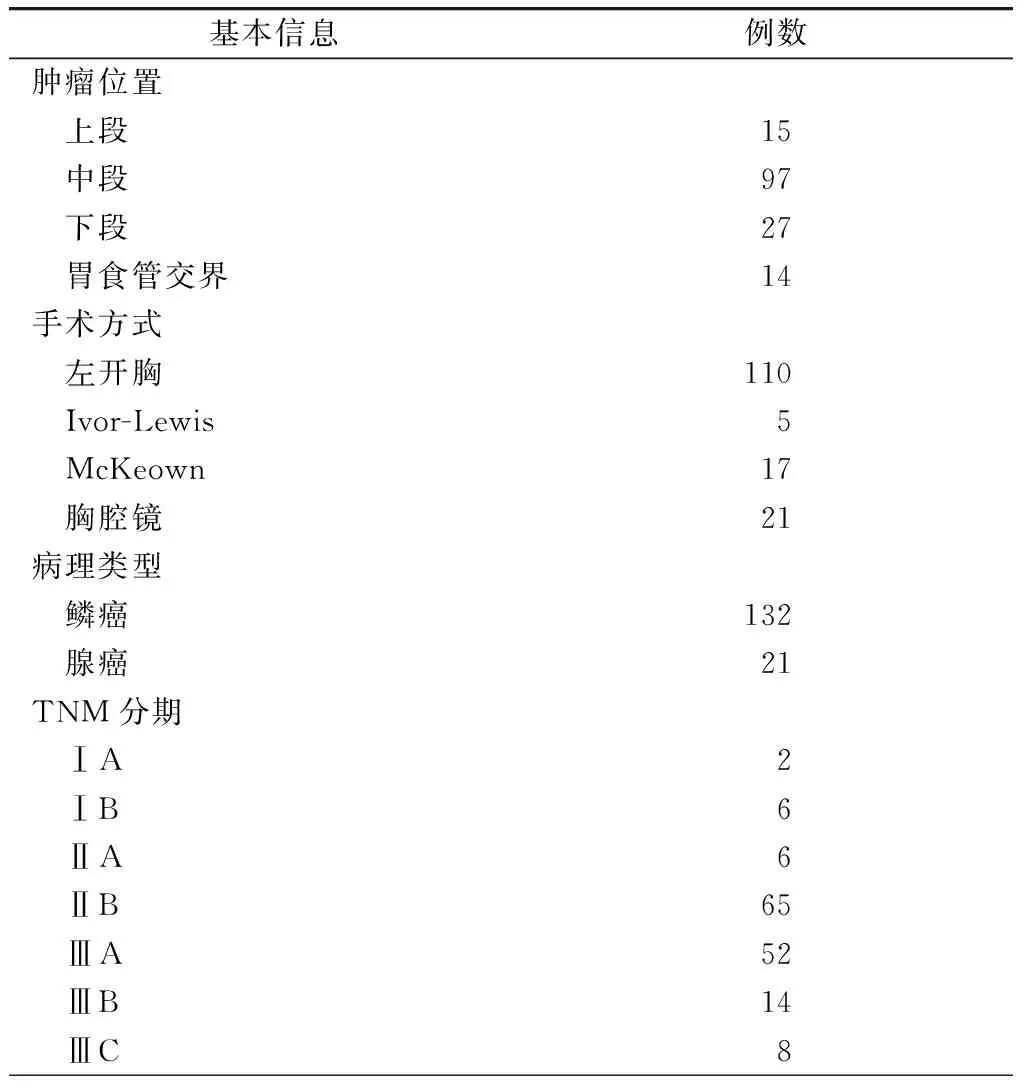
表1 153例食管癌术后再入ICU患者的基本信息
二、 严重并发症
肺部并发症是导致再入ICU的主要原因,占再入患者的55.6%(85/153)。其中,76例确诊为肺炎,4例为严重气道痰潴留,其他还包括肺动脉栓塞3例、支气管哮喘发作1例以及不明原因大咯血1例。患者转入ICU的中位时间为术后4.0 d。进一步分析显示,68例患者因为非肺部并发症(吻合口、心血管、二次手术等)转入ICU,有34例在ICU继发获得性肺炎,这部分患者的ICU住院时间明显延长(Z=-4.93,P<0.01),与未感染肺炎患者比较,首发并发症和获得性肺炎的双重打击明显增加了病死率(52.9%和23.5%,χ2=6.227,P=0.013)(表2)。其他导致术后患者再入ICU的各类严重并发症的发生率和病死率统计见表3。
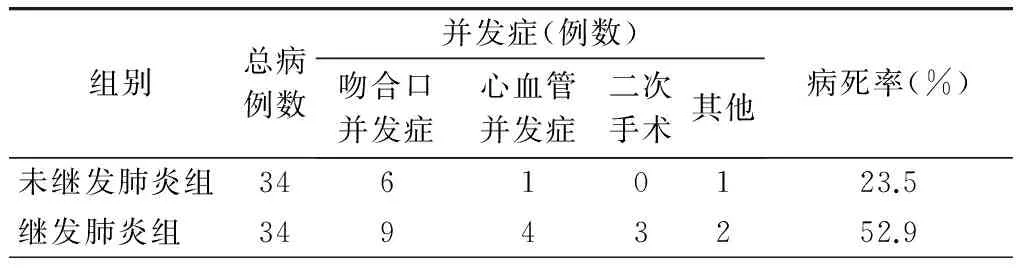
表2 68例非肺部并发症再入ICU后继发获得性肺炎患者死亡情况
注:两组间比较χ2=6.227,P=0.013。
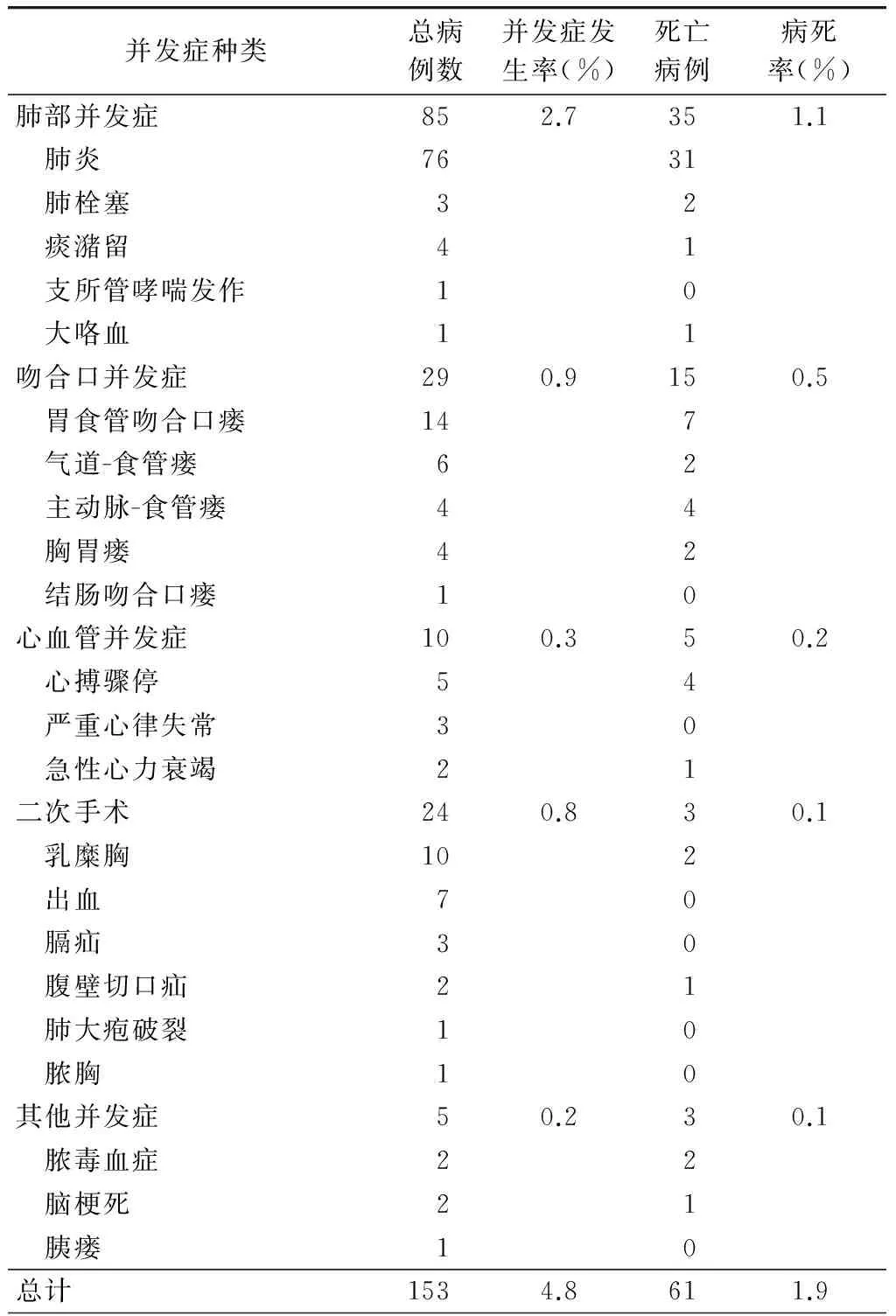
表3 153例食管癌术后再入ICU患者的原发并发症分类
三、 多因素Logistic回归分析结果
Logistic多因素回归显示,再入ICU时间是死亡相关的独立危险因素(P=0.044,OR=2.151,95%CI为1.022~4.528,表4)。在术后1周内转入ICU的患者病死率为33.7%(33/98),低于超过1周转入ICU患者的病死率(50.9%,28/55),两者差异具有统计学意义(χ2=4.365,P=0.037)。
四、 不同时段严重并发症构成的变化
本研究结果显示,肺部并发症、吻合口并发症和心血管并发症依次是前3位主要的食管癌术后严重并发症,是引起术后死亡的主要原因,可反映目前严重并发症的构成。我们检索了既往几十年食管癌术后并发症的文献报道,分析各类并发症的发生率、病死率以及变化趋势。根据并发症构成的主要分布特点,可大体分为3个特征性时段:1950年之前、1950至1980年间以及1980年后,上述3个时间段的食管癌术后主要严重并发症顺序在1950年前为休克和外科感染;1950至1980年间为吻合口瘘和肺部并发症;而1980年后顺序变为肺部并发症、吻合口并发症及心血管并发症。
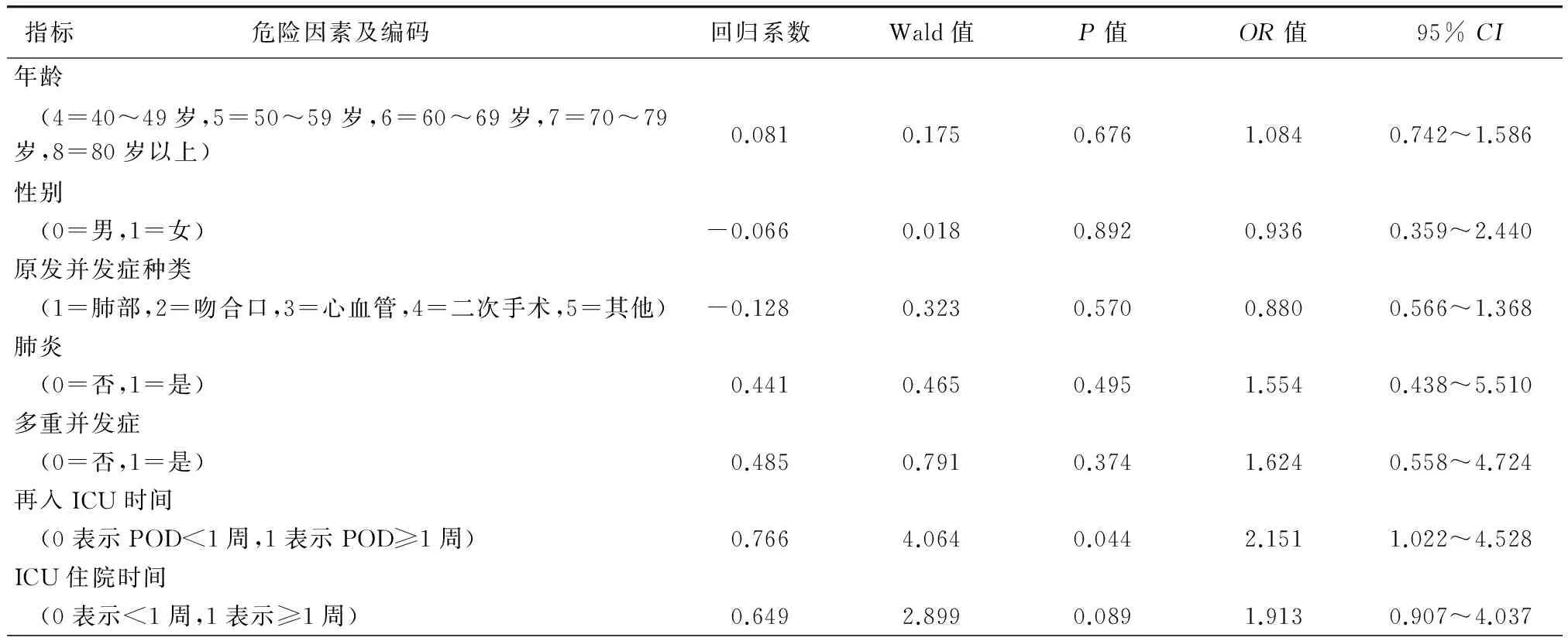
表4 食管癌术后患者再入ICU后死亡危险因素Logistic多因素回归分析
注:肺炎包括原发和继发获得性肺炎;POD表示术后天数。
讨 论
食管癌的治疗主要采取手术为主的根治性综合治疗。根治术后并发症和围术期死亡的防治一直是外科医师关注的重点。由于一般并发症的发生率明显高于严重并发症,且转归和预后亦大有不同。所以,严重并发症的防治成为降低术后病死率和改善患者预后的重中之重。虽然目前关于食管癌术后并发症及其危险因素的研究不少,但多数研究未就并发症的严重程度分类统计。整体而非差异性的报道将会弱化严重并发症作为主要致死因素的作用,降低对其的防治意识。即使部分研究将术后并发症进行分类,然而其分类标准大都带有主观性或标准不一,无法进行综合评价。因而,制定客观可靠又具有实际操作性的界定标准就成为食管外科领域的切实需求。
2004年,苏黎世大学医学院的研究者根据6 336例普通外科患者术后的资料[4],并结合以往分类标准,将腹部的术后并发症分为5级。该标准已经过10个国家144名外科医师的重复性检验,并被广泛接受,目前多应用于腹部手术、肝移植和泌尿系肿瘤术后并发症严重程度的评价。对比分析,我们发现此分级中的Ⅳ级并发症(威胁生命的并发症,需ICU处理)所对应的患者占术后死亡人数的绝大比例,而病房即可处理的并发症引起的术后死亡非常少。参照此分级系统,并结合食管癌术后并发症与死亡的关系,我们将术后再入ICU作为界定食管癌术后严重并发症的标准。
本研究中,共纳入了我科5年间3 171例食管癌切除手术病例,样本量大,能反映当前食管癌术后的并发症特点和构成。从再入ICU后并发症引起的死亡来看,病死率高达39.87%(61/153),也能反映界定严重并发症的危险程度和对患者术后生存的威胁。肺部并发症是导致再入ICU的主要原因,决定是否转入ICU的考虑主要是根据患者血气分析中PaO2和PaCO2等评估氧和指标,这组患者转入ICU的中位时间为术后4.0 d,提示了肺部并发症的高危时间段。D′Journo等[5]也报道了相近的数据,80%的肺部并发症发生于术后5 d内。35例患者死亡,病死率高达41.18%(35/85),死亡人数占总死亡数的57.38%(35/61),位居第一位。此外,ICU获得性肺炎亦增加了以非肺部并发症再入ICU患者的病死率,故针对此类患者,在治疗首发并发症的同时亦要重视对再发肺部并发症的防护。食管胃吻合口瘘的确诊是根据上消化道碘油造影和胃镜检查,在普通病房,通过彻底引流和有效的营养支持等保守治疗手段,大部分患者均能得以控制和愈合,但仍有小部分吻合口瘘的患者因为感染加重和状态恶化需要转入ICU进一步治疗。气道—食管瘘和食管主动脉瘘这一类严重并发症的患者保守治疗效果一般较差,病死率高。心动过速和心房颤动是食管癌术后常见的心血管并发症,大部分均能在病房治疗和控制,不需转入ICU,而极少数恶性心血管事件患者再次转入ICU的预后较差。
由于单因素判别分析方法无法控制混杂因素的影响,有可能削弱或增强观察指标对术后严重并发症发生的作用强度,甚至出现假阴性或假阳性。本研究应用多因素Logistic回归分析确定食管癌切除术后严重并发症发生死亡的独立危险因素,结果显示再入ICU时间对严重并发症的预后影响最大。
食管癌外科治疗迄今已有百年历史,自20世纪初食管癌外科手术逐渐发展起来,至1950年之前,手术本身具有极高的死亡风险,其术后并发症病死率甚至高达50%[6]。文献报道中,这个时间段缺乏大样本的手术量报道,这也是因为在世界范围内,开展食管癌手术的医学中心为数不多,多数文献仅限于病例报道,描述食管癌外科治疗的经验和总结。在麻醉技术、重症监护治疗、营养支持和外科技术尚未全面发展的年代,因为开胸手术导致的创伤性休克、外科感染是造成食管癌术后最主要的致死性严重并发症[7]。Steele[6]总结了最初开展食管癌手术时威胁患者的手术并发症,指出多数出现休克的患者在术后24~48 h即面临死亡,而能采取的有效挽救措施却很有限。文献报道,1930至1950年食管癌术后并发症的病死率仍高居35%~39%[8-12]。外科性休克与术后肺不张可直接引起血流动力学紊乱,而在麻醉技术和呼吸机应用尚不完善的时候更显严重。因此,从某种程度上讲,患者能坚持到手术结束,并能平稳度过术后阶段,是非常艰难的。另一方面,在1950年前,临床应用的抗生素种类非常有限,外科学还未建立起系统完善的外科感染理论,术后外科感染如脓胸、肺部感染、肺脓肿等感染性并发症对食管癌患者术后死亡造成了严重的负面影响[10]。这个阶段因为术后肺炎导致的死亡可占所有死亡患者的17.5%[8]。总体来讲,在1950年前,因为麻醉、术中监护、抗生素使用的瓶颈,制约了食管癌外科的发展,术后严重并发症直接体现以休克和外科感染为主,并导致极高的并发症病死率。
1950年后,新的抗生素被逐渐广泛应用于临床,特别是外科手术[10]。同时,麻醉呼吸机也逐步完善,并在1950年代开始广泛应用于胸外科手术。这个时间段应该是胸外科技术逐步走向系统化、科学化发展的阶段,随着患者术后并发症发生率和病死率的降低,逐渐开始有大样本量的文献报道。Earlam等[13]回顾了1960至1979年间,共122篇文献,综合计算出食管癌患者术后住院期间因并发症导致的病死率为13%。邵令方等[14]报道了1965至1985年间共6 123例食管癌切除术,术后病死率为3%。Huang等[15]进一步分析了1 874例食管癌切除术,1958至1969年间的病死率为4.9%,而1970至1982年间的病死率为3.7%。可见食管癌切除术的安全性在逐渐提高,术后并发症病死率在稳步下降。
早期对患者造成巨大威胁的术中、术后休克,在1950至1980年间发生率显著下降,主要原因在于术中监护、支持和麻醉技术的进步。以脓胸为代表的外科感染并发症也逐渐少见。这期间吻合口瘘,尤其是胸内吻合口瘘作为主要的并发症,取代休克成为导致术后死亡的主要因素。术后吻合口瘘发生率约为3.4%~20.6%,病死率高达11.1%[15-20]。因吻合口瘘引起的感染进行性加重和全身情况恶化进展是术后死亡的主要原因。在1980年之前,尚无设计成熟的吻合器械应用于临床,所有胃食管吻合均由外科医师手工完成,因此,吻合质量绝对依赖于外科医师的经验和手术技巧[17]。考虑到吻合口瘘的严重后果,其成为这个阶段经胸食管癌手术的主要威胁,而因吻合口瘘导致的死亡病例可占到所有食管癌术后并发症死亡病例的12.5%~63.6%[14-20]。同时,肺部并发症所占有的比例在此阶段逐渐显现,由于对肺部并发症定义和评价标准不统一,文献报道的发生率有较大的波动。常见的肺部并发症包括肺炎、肺不张、胸腔积液、气胸、呼吸功能衰竭等。我们发现因肺部并发症导致的死亡病例可占30%~54.2%[14-15,18-20]。根据Liu等[3]报道的20 796例食管癌切除术病例,这也是迄今为止国内外最大的单中心食管癌手术量总结报道,在1952至1978年间,主要的并发症依次为吻合口瘘、肺部并发症、脓胸、心血管并发症和乳糜胸,外科休克已不再是威胁患者术后康复的严重并发症。
1980年后,随着外科技术的进一步发展,食管癌术后的总体病死率继续下降,文献报道为2.5%~14%[21-24]。我们的数据显示,2009至2013年间的术后并发症病死率为1.9%。1981年华盛顿大学的West等[25]在国际上首次报道了他们使用胃食管环形吻合器的经验,31例采用环形吻合器完成胃食管吻合的患者,术后钡餐造影证实无一例吻合口瘘发生。吻合器的应用成为食管癌外科历史上的革命性事件,对降低吻合口瘘的发生产生了巨大的作用。Swisher等[26]比较了1970至1983年与1984至1993年两个时间段内的吻合口瘘发生率,由12%迅速下降到了3%,这与吻合器的使用密切相关。Li等[21]总结的1980至1994年间各类中文文献报道的吻合口瘘发生率为3.9%。同时,因为吻合口瘘造成的死亡病例在1980年后也已下降到8.9%以内[2,27-28],除了吻合口瘘本身发生率降低以外,吻合口瘘的治疗手段也有了显著进步,有效的肠内营养支持、食管覆膜金属支架的出现、抗生素的使用等都使外科医师有了更有力的治疗吻合口瘘的措施,从而降低了死亡风险[23,29]。随着吻合口瘘发生率的下降,肺部并发症逐渐成为首位严重并发症,Song等[30]分析了胸部肿瘤手术后因并发症再次返回ICU患者的资料,发现其主要原因为肺部并发症(占77.7%)和心血管并发症(占9.5%)。文献报道的食管癌术后肺部并发症发生率为5.7%~55.9%,导致的死亡病例占总死亡病例的27.3%~81.8%[2,22,28,31]。其中,年龄>65岁、患有慢性阻塞性肺部疾病(chronic obstructive pulmonary disease,COPD)、手术方式为三切口是肺部并发症的危险因素[32]。另一个肺部并发症的危险因素则为术后与院内感染相关的获得性肺炎问题。我们的研究中,在原有并发症基础上,二次罹患肺炎可显著增加患者在ICU的死亡风险(52.9%和23.5%,χ2=6.227,P=0.013),同时可延长在ICU的住院时间,增加医疗费用。我们的数据显示心血管并发症位居肺部和吻合口并发症之后,排第3位,其再入ICU后的病死率高达50%,尤其是心搏骤停的死亡威胁更为突出。根据文献报道,1980年后心血管并发症发生率为6.0%~25.9%,因此产生的死亡病例占11.4%~63.6%[2,22,28]。心血管并发症的总体病死率为1.3%~1.6%,相比1950至1980年的0.4%~0.9%稍有升高[2,14-15,18,28]。
除肺部并发症、吻合口并发症、心血管并发症外,在当前的严重并发症构成谱中,休克和脓胸已非常罕见,不再是严重威胁患者术后安全的主要并发症。另外,术后乳糜胸的发生率也处于较低的水平,在1970至1980年间,经裂孔食管癌切除术曾一度提升了乳糜胸的发生率(经裂孔为10.5%,经胸为0.2%),病死率可高达46.0%[33]。预防性胸导管结扎能有效预防术后乳糜胸发生,这也与我们的经验相吻合。需要注意的一个现象,作为过去极为罕见的气道-食管瘘并发症,本研究中再入ICU病例中出现了6例,之前本课题组也报道过关于气道-食管瘘的治疗体会,其近年来的发生可能与管状胃技术的普及和能量器械(如电刀与超声刀)的使用有关,具体的发生机制还需要进一步研究和证实[34]。
总之,食管癌手术治疗仍具有相当大的术后并发症风险,再入ICU可反映并发症的严重程度,具有较高的住院死亡风险。当前,肺部并发症已成为食管癌术后最主要的严重并发症,是造成术后患者住院死亡的第一位因素,其次为吻合口并发症和心血管并发症,这与1950年前以及1950至1980年间在严重并发症构成上存在差异。
1Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005,55(2):74-108.
2Whooley BP, Law S, Murthy SC, et al. Analysis of reduced death and complication rates after esophageal resection[J]. Ann Surg, 2001,233(3):338-344.
3Liu JF, Wang QZ, Ping YM, et al. Complications after esophagectomy for cancer: 53-year experience with 20,796 patients[J]. World J Surg, 2008,32(3):395-400.
4Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6 336 patients and results of a survey [J]. Ann Surg, 2004. 240:205-13.
5D′Journo XB, Michelet P, Avaro JP, et al. Respiratory complications after oesophagectomy for cancer[J]. Rev Mal Respir, 2008, 25(6):683-694.
6Steele GH. Experiences with transthoracic oesophagectomy and gastrectomy[J]. Br J Surg, 1945,33:162-166.
7Barbat JH. Thoracic esophagectomy: report of a case[J]. Cal State J Med,1913,11(6):225-227.
8Garlock JH, Klein SH. The surgical treatment of carcinoma of the esophagus and cardia: an analysis of 457 cases[J]. Ann Surg, 1954,139(1):19-34.
9Ibberson O, Mustard RA. Carcinoma of the esophagus; a review of 381 cases admitted to Toronto General Hospital, 1937-1953 inclusive[J]. Ann Surg, 1956, 144(6):927-940.
10 Boyd DP, Adams HD, Salzman FA. Carcinoma of the esophagus[J]. N Engl J Med, 1958,258(6):271-274.
11 Clifton CE. Large-scale production of penicillin[J]. Science, 1943,98(2533):69-70.
12 Frenckner P, Bjorkman S. Bronchospirometry and its clinical application, with a short account of bronchial catheterization: (section of laryngology)[J]. Proc R Soc Med,1937,30(4):477-492.
13 Earlam R, Cunha-Melo JR. Oesophageal squamous cell carcinoma: Ⅰ. A critical review of surgery[J]. Br J Surg, 1980,67(6):381-390.
14 Shao LF, Gao ZG, Yang NP, et al. Results of surgical treatment in 6,123 cases of carcinoma of the esophagus and gastric cardia[J]. J Surg Oncol, 1989,42(3):170-174.
15 Huang GJ, Wang LJ, Liu JS, et al. Surgery of esophageal carcinoma[J]. Semin Surg Oncol, 1985,1(2):74-83.
16 Inberg MV, Linna MI, Scheinin TM, et al. Anastomotic leakage after excision of esophageal and high gastric carcinoma[J]. Am J Surg, 1971,122(4):540-544.
17 Hermreck AS, Crawford DG. The esophageal anastomotic leak[J]. Am J Surg,1976,132(6):794-798.
18 Sugimachi K, Matsuzaki K, Matsuura H, et al. Evaluation of surgical treatment of carcinoma of the oesophagus in the elderly: 20 years′ experience[J]. Br J Surg, 1985,72(1):28-30.
19 Wang LS, Huang MH, Huang BS, et al. Gastric substitution for resectable carcinoma of the esophagus: an analysis of 368 cases[J]. Ann Thorac Surg, 1992,53(2):289-294.
20 Dunlop EE. Carcinoma of the oesophagus: reflections upon surgical treatment[J]. Ann R Coll Surg Engl, 1961,29(1):28-53.
21 Li H, Yao SC. Surgical treatment for carcinoma of the oesophagus in Chinese language publications[J]. Br J Surg, 1997,84(6):855-857.
22 Atkins BZ, Shah AS, Hutcheson KA, et al. Reducing hospital morbidity and mortality following esophagectomy[J]. Ann Thorac Surg, 2004,78(4):1170-1176.
23 Martin LW, Swisher SG, Hofstetter W, et al. Intrathoracic leaks following esophagectomy are no longer associated with increased mortality[J]. Ann Surg, 2005,242(3):392-399; discussion 399-402.
24 Ra J, Paulson EC, Kucharczuk J, et al. Postoperative mortality after esophagectomy for cancer: development of a preoperative risk prediction model[J]. Ann Surg Oncol, 2008,15(6):1577-1584.
25 West PN, Marbarger JP, Martz MN, et al. Esophagogastrostomy with the EEA stapler[J]. Ann Surg, 1981,193(1):76-81.
26 Swisher SG, Hunt KK, Holmes EC, et al. Changes in the surgical management of esophageal cancer from 1970 to 1993[J]. Am J Surg, 1995,169(6):609-614.
27 Paterson IM, Wong J. Anastomotic leakage: an avoidable complication of Lewis-Tanner oesophagectomy[J]. Br J Surg, 1989,76(2):127-129.
28 Ellis FH Jr, Heatley GJ, Krasna MJ, et al. Esophagogastrectomy for carcinoma of the esophagus and cardia: a comparison of findings and results after standard resection in three consecutive eight-year intervals with improved staging criteria[J]. J Thorac Cardiovasc Surg, 1997, 113(5):836-846; discussion 846-848.
29 Turkyilmaz A, Eroglu A, Aydin Y, et al. The management of esophagogastric anastomotic leak after esophagectomy for esophageal carcinoma[J]. Dis Esophagus, 2009,22(2):119-126.
30 Song SW, Lee HS, Kim JH, et al. Readmission to intensive care unit after initial recovery from major thoracic oncology surgery[J]. Ann Thorac Surg, 2007,84(6):1838-1846; discussion 1846.
31 Fan ST, Lau WY, Yip WC, et al. Prediction of postoperative pulmonary complications in oesophagogastric cancer surgery[J]. Br J Surg, 1987,74(5):408-410.
32 Jiao WJ, Wang TY, Gong M, et al. Pulmonary complications in patients with chronic obstructive pulmonary disease following transthoracic esophagectomy[J]. World J Gastroenterol, 2006,12(16):2505-2509.
33 Bolger C, Walsh TN, Tanner WA, et al. Chylothorax after oesophagectomy[J]. Br J Surg, 1991,78(5):587-588.
34 Shi H, Wang WP, Gao Q, et al. Single-stage surgical repair of airway gastric fistula after esophagectomy[J]. J Cardiothorac Surg, 2014,9(1):30.
