短穗鱼尾葵果实原花青素粗提物的树脂纯化
2014-02-06刘少娜黄思梅
张 镜,刘少娜,黄思梅
(嘉应学院 生命科学学院,广东 梅州 514015)
短穗鱼尾葵(Caryotamitis),又称丛生鱼尾葵、酒椰子,为棕榈科鱼尾葵属常绿小乔木,高5-8米.喜温暖,生长适宜温度为18℃-30℃,较耐寒,对光线适应性强,抗旱能力较强,中国南方种植数量大.目前,短穗鱼尾葵主要用于绿化、观赏及肉质茎的加工等[1].短穗鱼尾葵果实产量高,且几乎终年果实次第成熟.文献表明短穗鱼尾葵果实内总酚含量很高[2],原花青素的含量亦丰富,是开发天然活性产物难得的资源[3].迄今,国内外未见短穗鱼尾葵果实原花青素分离纯化的研究报道.
大孔吸附树脂具有稳定性高、选择性强、处理量大、再生方便等优点,在天然活性产物工业化提取分离中广泛应用[4~6].本研究以5种大孔吸附树脂供试,从中筛选出对短穗鱼尾葵果实原花青素吸附量大、解吸率高的树脂种类,研究其吸附量与解吸率的主要影响因子,获得短穗鱼尾葵果实原花青素大孔吸附树脂纯化的技术条件,为其原花青素资源开发奠定基础.
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
采摘果皮颜色褪绿及淡红色短穗鱼尾葵果实,剔除杂质和腐烂变质的果实,自来水洗净后晾干果面余水,冷冻干燥,粉碎,80目过筛粉末低温保存备用.
试验用乙醇、正丁醇、HCl、NaOH、FeNH4(SO4)2·12H2O等,均为分析纯.供试的DS401、AB-8、D101、DA201、DM301,均为天津树脂厂生产.
1.1.2 仪器与设备
BT2KXL 冻干机(美国Virtis公司);U-2800 紫外-可见分光光度计(日本日立公司); PHS-2C 酸度计(上海智光仪器表有限公司);FA2004 电子分析天平(上海精天电子仪器厂);JLL28-B 低速大容量多管离心机(上海安亭科学仪器厂).
1.2 供试样品的制备
1.2.1 原花青素粗提物
短穗鱼尾葵果实粉末与75%乙醇溶液(pH=2)以1:5的料液比混合,室温浸提2.5h,4500r/min离心20min,上清液冷冻干燥得棕红色粉末状原花青素粗提物.
1.2.2 原花青素的含量测定
以铁盐催化法进行原花青素显色及测定含量[7].取1 mL原花青素粗提物溶液于比色管中,依次加入6 mL正丁醇-盐酸溶液(95:5,V/V)及0. 2mL 2%硫酸铁铵溶液,沸水浴40min后迅速冷却,以蒸馏水代替样液为参比,测定处理液A546nm值,按公式(1)与(2)计算原花青素的含量(%)及原花青素的质量(mg)
(1)
(2)
注:y—原花青素含量/%;x—原花青素质量/mg; A 546nm吸光度;V—稀释倍数;
W—样品质量(mg);0. 366—A1%1 cm在546 nm处原花青素的吸光度.
按上述方法测定供试粗提物样品原花青素的含量为10.446%
1.3 大孔吸附树脂的筛选
1.3.1 供试树脂的静态吸附
准确称取树脂湿基2.0g装入150mL三角瓶中,加入2.0%原花青素粗提物(原花青素含量为0.209%)样液50mL,25℃、120r/min振荡12h,充分吸附后测定溶液吸光值,按公式(3)及(4)计算树脂吸附量与吸附率.
Qe=(C0-C1)V/W,
(3)
Ee(%)=(C0-C1)/C0×100.
(4)
注:Qe-树脂吸附量(mg/g);C0-吸附前溶液中原花青素的质量浓度(mg/mL);C1-吸附后溶液中原花青素的质量浓度(mg/mL);V-溶液体积(mL);W-树脂湿重(g);Ee-吸附率.
1.3.2 吸附原花青素的解吸试验
取1.0g原花青素吸附饱和树脂于150mL三角瓶中,各加入70%乙醇溶液50mL,保鲜膜封口,25℃、120r/min振荡12h,取样测定溶液的吸光值,按公式(4)及(5)计算树脂的解吸量与解吸率.
(5)
Ed(%)=Qe/Qd×100.
(6)
注:Qd-树脂解吸量(mg/g);C2-解吸液中原花青素的质量浓度(mg/mL);V-溶液体积(mL);Ed-解吸率.
1.4 树脂吸附性能的主要影响因素
1.4.1 温度与吸附量的关系
准确称取树脂湿基2.0g装入150mL三角瓶中,加入1.0%原花青素粗提物样液50mL,分别置于温度设置为15℃、20℃、25℃、30℃、35℃、40℃、45℃和50℃振荡器,振荡120r/min,每30min取样,正丁醇-盐酸显色后测定处理液A546nm值.
1.4.2 温度与吸附平衡时间的关系
准确称取树脂湿基1.0g装入150mL三角瓶中,加入1.0%原花青素粗提物样液50mL,分别置于温度设置为15℃、20℃、25℃、30℃、35℃、40℃、45℃和50℃振荡器,振荡120r/min,每30min取样,正丁醇-盐酸显色后测定处理液A546nm值.
输变电工程时间长,假如没有提前对其成本实施管理,那么就可能会使得部分居心不良的人钻了空子,对施工成本进行虚报,大发不义之财,因此,我们必须改变传统的成本管理理念,创新管理方式,开源节流,减少施工成本。遵循成本控制原则,对于施工的每一个阶段,都要有专人负责监督和记录,以防出现内部亏空,对整个工程进度产生不良影响。要规范财务管理流程,财务部门应该实现标准化管理,并不断对管理与控制体系进行优化。
1.4.3 pH与树脂吸附量的关系
准确称取树脂湿基1.0g装入150mL三角瓶中,分别加入pH =1、2、3、4、5、6、7、8和9的1.0%原花青素粗提物溶液50mL,置于振荡器内25℃、120r/min振荡6h,正丁醇-盐酸显色后测定处理液A546nm值,计算吸附量.
1.5 树脂吸附原花青素的解吸
1.5.1 乙醇浓度与解吸效果的关系
准确称取1.0g已吸附原花青素的树脂湿基装入150mL三角瓶中,分别加入不同体积分数的乙醇溶液50mL,25℃、120r/min振荡12h,测定处理液A546nm值.
1.5.2 温度对解吸性能的影响
准确称取1.0g已吸附原花青素的树脂湿基装入150mL三角瓶中,加入90%乙醇溶液50mL,于设定温度下120r/min振荡12h,取样正丁醇-盐酸显色后测定处理液A546nm值.
1.5.3 pH对解吸性能的影响
准确称取1.0g已吸附原花青素的树脂湿基装入150mL三角瓶中,分别加入不同pH 值的90%乙醇溶液50mL,25℃、120r/min振荡12h,正丁醇-盐酸显色后测定处理液A546nm值.
1.5. 4 解吸正交试验
分别称取已吸附原花青素的树脂湿基1.0g,以解吸温度、乙醇浓度及溶液的pH值进行3因素、3水平正交试验,正交试验设计如下:

表1 正交试验设计
注:A.温度/℃,B.乙醇浓度/%,C.pH值
1.6 吸附原花青素的动态解吸试验
树脂与10%原花青素粗提物溶液按1:10比例混合,25℃吸附6h后取出,以2倍体积的蒸馏水漂洗60s,准确称取20g吸附饱和的树脂装入2cm×10cm的层析柱,分别以0.50、0.75、1.00、1.25及1.50倍柱床体积流速洗脱,以10mL为1流份收集洗脱液,共收集15流份,洗脱液正丁醇-盐酸显色后测定处理液A546nm值.
1.7 处理重复及数据分析
各处理重复3次,以SPSS 11.0进行数据处理,3次重复数据平均值以excel作图,以Duncans'法进行差异显著性分析,P<0.0 5 表示差异显著,P<0.0 1表示差异极显著.
2 结果与分析
2.1 供试树脂的吸附量与解吸率
5种树脂对短穗鱼尾葵果实原花青素均具有一定的吸附能力,其中AB-8与DS401的吸附能力与解吸能力较好,2种树脂的吸附量45.29、45.42 mg/g,差异不显著.其次是D101,吸附量42.24mg/g,与上述2树脂差异显著.树脂DA201及DM301的吸附量更低.AB-8与DS401树脂上的短穗鱼尾葵果实原花青素的解吸率高,分别为87.89%及89.91%,两者无显著差异.而D101、DA201及DM301树脂上的原花青素的解吸率均较低(表2).表明弱极性的大孔吸附树脂AB-8与DS401都较适合短穗鱼尾葵果实原花青素的纯化,其中DS401树脂上原花青素的解吸率更高,故以DS401树脂纯化短穗鱼尾葵果实原花青更佳.
虽然DS401与AB-8在25℃下对短穗鱼尾葵果实原花青素的饱和吸附量相当,但AB-825℃下对山竹壳原花青素的静态饱和吸附达76.40mg/g[8],高于对短穗鱼尾葵果实原花青素吸附量,表明短穗鱼尾葵果实原花青素与山竹壳原花青素为结构不同的原花青素.
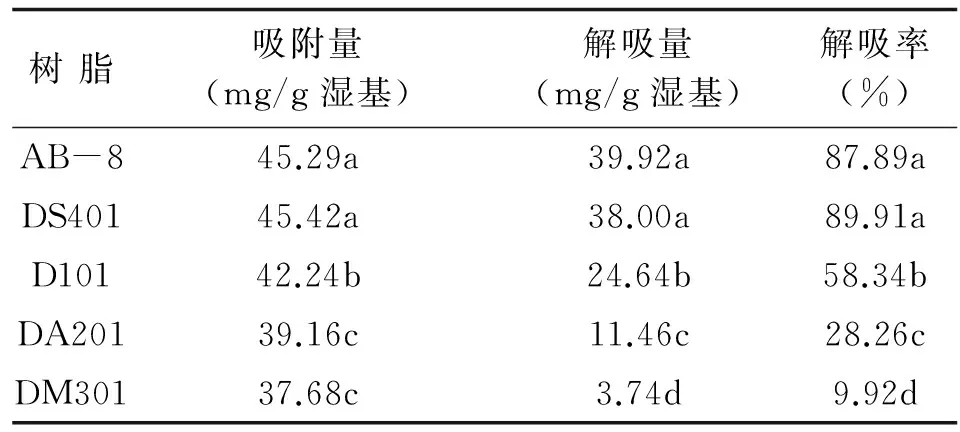
表2 供试树脂静态吸附与解吸效果
2.3 温度与原花青素吸附量与吸附平衡时间的关系
2.3.1 温度对原花青素吸附量
图1表明在15℃~50℃内DS401树脂对原花青素的吸附量随温度的升高而增大,45℃的吸附量为65.637mg/g、50℃的吸附量67.791为mg/g,其吸附分别为25℃吸附量的133.937%及138.332%,两者差异不显著.但50℃吸附量较35℃吸附量的差异显著、较30℃以下的差异极显著.试验结果与张泽生等的研究结果相近[9],而DS401对短穗鱼尾葵原花青素的吸附量低于AB-8对山楂果中原花青素的吸附量[6].而LS300大孔吸附树脂树脂对月柿原花青素的吸附50℃的吸附量几乎较30℃的吸附量高1倍[10],两者差异远大于本实验的结果,表明短穗鱼尾葵原花青素的结构和性质不同于上述2类原花青素.

图1温度与吸附量的关系
结果表明吸附体系的温度对原花青素在固相与液相的分配影响极大,提高吸附体系的温度可明显提高树脂对原花青素的吸附量,降低吸附后液中原花青素的残留量,有利于提高穗鱼尾葵原花青素的得率.
2.3.2 温度对原花青素吸附平衡时间的关系
DS401树脂1g湿基与1%短穗鱼尾葵原花青素粗提取物50mL混合,不同温度下进行静态吸附结果如图2所示.由图2 看出温度与吸附平衡时间的关系是在15~30℃内,温度越低吸附平衡时间越长,当温度升为30℃时吸附平衡时间由15℃的7h缩短为4.5h,但在35~50℃吸附温度对吸附平衡时间无明显的影响,吸附平衡时间与30℃无明显差异.表明吸附体系的温度30℃以上时,吸附平衡时间为4.5h.

图2温度与吸附平衡时间的关系
2.4 pH对吸附性能的影响
由图3可知,当原花青素粗提物溶液的pH在1~5时,树脂对原花青素的吸附量随pH值增大而提高,pH5时对原花青素的吸附量为56.52mg/g,但当pH值继续上升时,吸附量先下降后在pH8时又开始上升,pH9时的吸附率52.04mg/g,且与pH7的吸附量差异显著(p > 0.05).这与大多数文献报道的植物活性物质要达到较好的吸附效果一般是在酸性条件下被吸附具明显差异[11~12].有文献报道原花青素的稳定性受pH影响,在碱性条件下不稳定,随着pH的升高易发生分解[13],使吸附后液的吸光值降低,从而造成计算所得的吸附量增加,而DS401树脂对短穗鱼尾葵原花青素的吸附量在pH9时大于pH7的吸附量,显然不是由于碱性条件下原花青素的分解,而应该与原花青素的性质有关.

图3不同pH对吸附效果的影响系
2.5 温度对原花青素解吸的影响
吸附原花青素的DS401树脂不同温度解吸试验的结果如图4所示,在15℃~45℃温度范围内,随着温度的上升解吸液的吸光值升高,45℃解吸解吸液的吸光度为0.981,50℃解吸解吸液的吸光度值为0.846,较前者低13.761%.45℃解吸解吸液的吸光度较40℃与50℃解吸解吸液的差异均极显著(p > 0.01).
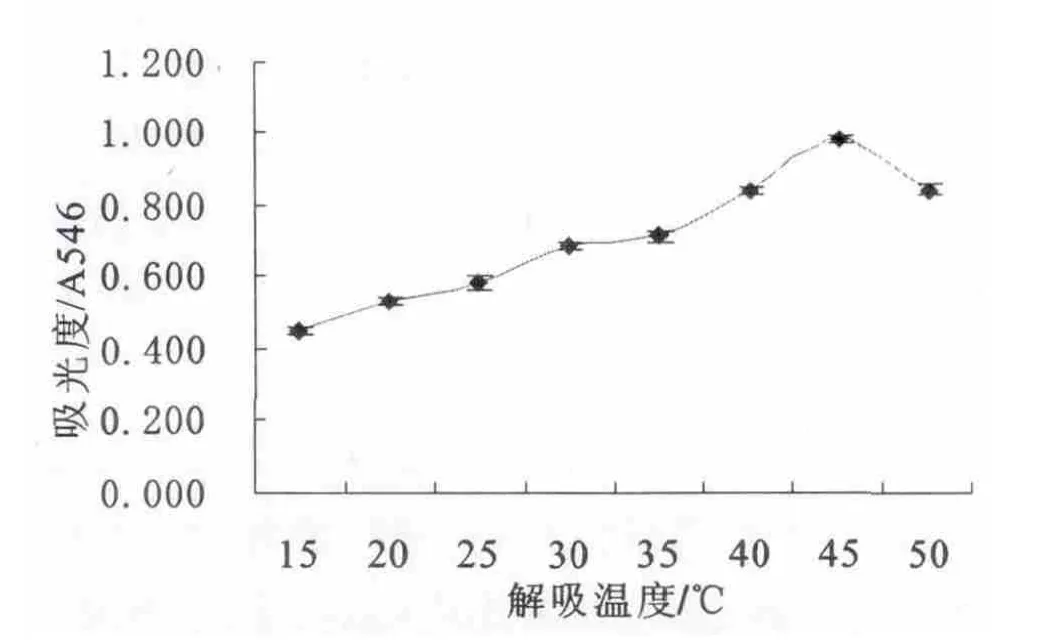
图4不同温度对解析效果的影响系
2.6 pH对解吸的影响
pH7时解吸液静态解吸DS401吸附的原花青素,溶液的吸光值1.171,为各处理间的最大吸光度,与其余处理吸光度的差异极显著,结果表明中性条件有利于DS401吸附的短穗鱼尾葵果实原花青素的解吸,与文献报道原花青素以洗脱液pH=6.3为适宜洗脱条件的结果相似[14].

图5不同pH值对解析效果的影响系
2.7 乙醇浓度对解吸的影响
从图6看出,乙醇体积分数在30%~70%范围内,解吸液吸光值变化明显,各处理的吸光值差异显著(p > 0.05),而乙醇体积分数在70%~90%后吸光值增加不明显,结果表明乙醇体积分数70%解吸原花青素的效果最佳.
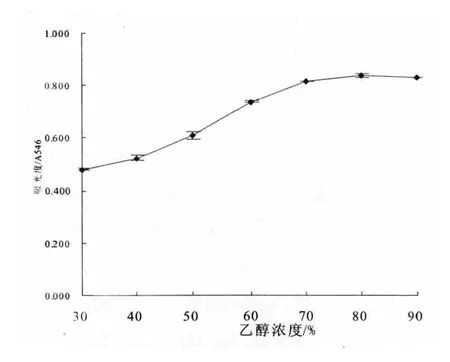
图6不同浓度洗脱液的解析效果
2.8 静态解吸正交试验结果
根据单因子试验结果,以解吸温度、乙醇浓度及解吸液 pH值进行3因素3水平正交试验.结果表明极差最大的是解吸液乙醇的浓度,即是不同浓度乙醇解吸效果差异最大,其次是解吸的温度.试验结果显示,静态解析最优条件组合为A3B2C2,即在乙醇浓度为80%、温度45℃及洗脱液pH=8(表3).虽此解吸条件的解吸效果为佳,但若解吸液直接干燥,因除去溶剂后NaOH仍存留于干燥物内,干燥物将为强碱性对提取的原花青的稳定性极为不利,因而干燥前解吸液的pH应先以HCl调为中性.
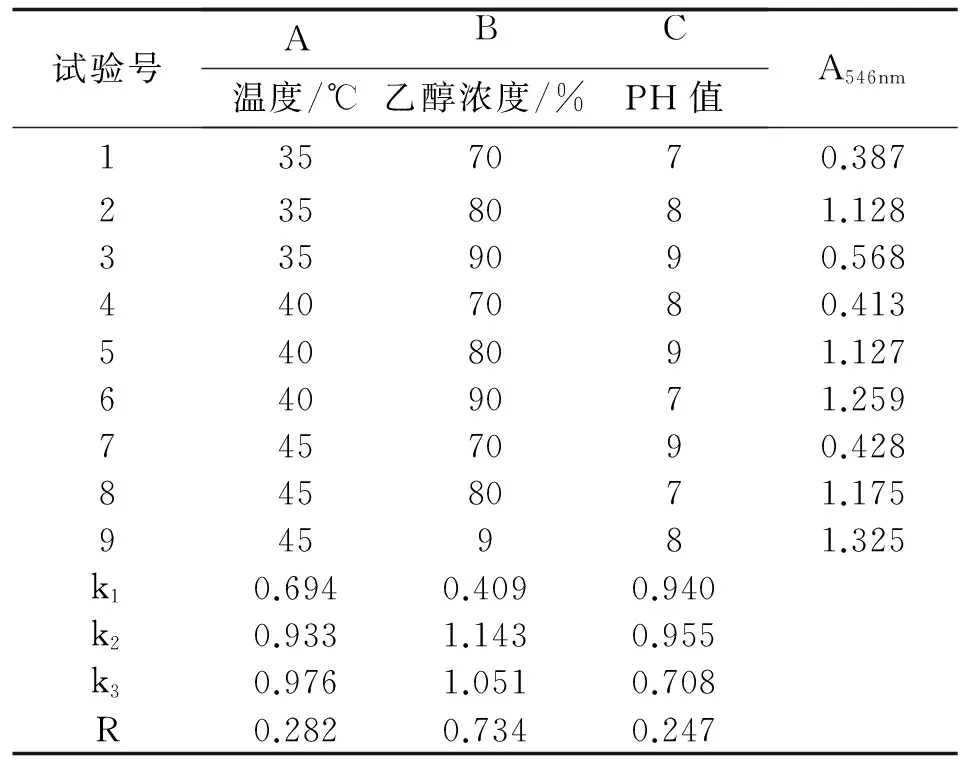
表3 原花青素解吸正交试验结果
2.9 动态解吸试验结果
吸附原花青素的树脂装入层析柱内,洗脱液流速与原花青素的解吸效果如图7所示.洗脱速率越小原花青素的洗脱峰越窄,洗脱效果越好.以0.5倍柱床体积流速洗脱中第7~10流份的流出液中原花青素的共842.61mg,占15流份原花青素总936.30 mg的89.99%,且洗脱峰无明显拖尾,主峰洗脱总体积约为柱床体积的2倍,至第10流份洗脱液收集结束的洗脱耗时5h.而0.75BV/h积流速洗脱中第5~9流份的洗脱液原花青素的共879.24mg,占15流份原花青素总936.31mg的93.90%,主峰洗脱总体积为柱床体积的2.5倍,至第9流份洗脱液收集结束的洗脱耗时4.5h,其原花青素的洗脱峰形亦较好,仅稍有拖尾.而1BV/h、1.25 BV/h及1.5BV/h洗脱的都拖尾明显.流速0.75BV/h的洗脱峰形虽较0.5BV/h的宽,但解吸的时间较短,且原花青素的回收率较高,因而解吸流速以0.75BV/h较为理想.
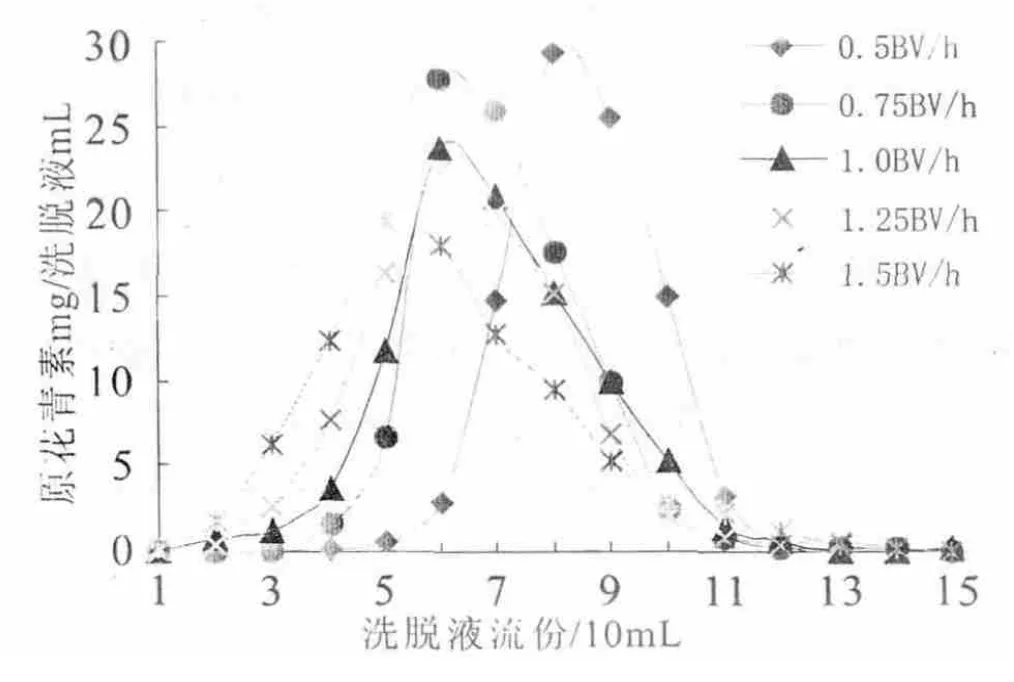
图7不同流速对解析效果的影响
3 讨论与结论
3.1 短穗鱼尾葵原花青素纯化静态吸附为宜
以乙醇浸提短穗鱼尾葵果实原花青素,当除去提取液有机溶剂后具较多的溶性沉淀.若提取液以大孔吸附树脂动态吸附分离原花青素,需要在回收溶剂后先离心、或过滤进行固液分离,然后才能将液体上柱.以静态吸附法分离原花青素不仅可在溶剂回收后的提取液直接加入树脂进行吸附,而且更容易控制吸附体系的温度,提高树脂原花青素的吸附量.所以,短穗鱼尾葵果实原花青素提取液原花青素的分离纯化以树脂静态吸附的工艺更适.
3.2 短穗鱼尾葵原花青素树脂纯化参数
研究表明DS401弱极性大孔吸附树脂对短穗鱼尾葵果实原花青素的吸附量最高、解吸效果最佳,是短穗鱼尾葵果实原花青树脂纯化的适宜树脂.DS401树脂静态吸附短穗鱼尾葵原花青素在45℃、pH=5下吸附4.5h时的吸附饱和.树脂吸附的原花青素以80%乙醇、pH=8、温度45℃、0.75VB/h解吸效果最好,从流出解吸液体积达柱床体积2.5~4.5倍内的洗脱液,原花青素的回收率为93.90%.
3.3 短穗鱼尾葵原花青素性质的特殊性
DS401大孔吸附树脂在25℃下对短穗鱼尾葵原花青素的饱和吸附量,较AB-8相同温度对山竹壳原花青素的态饱和吸附量低40.72%[8];大多数文献报道的植物活性物质要吸附效果以较低的pH下更好[11、12],DS401树脂吸附短穗鱼尾葵原花青素在吸附液pH=5时量最大,而且pH=9的吸附量pH=5时吸附量仅低7.93%,而高于pH值为6~8内的吸附.原花青素的稳定性受pH影响,在碱性条件下不稳定,随着pH的升高易发生分解[13],而DS401树脂对短穗鱼尾葵原花青素的吸附量在pH=9时大于pH=7的吸附量.以上结果表明短穗鱼尾葵原花青素可能其性质与常见报道的其它原花青的性质与结构有较大的差别.
[1] 金智慧.短穗鱼尾葵与鱼尾椰子[J].园林,2006(5):43.
[2] LI FU, BO-TAO XU, XING-RONG, et al. Antioxidant Capacities and Total Phenolic Contents of 56 Wild Fruits from South China [J]. Molecules, 2010, 15(12): 8602-8617.
[3] 黄思梅,张镜,范玉琴,等.短穗鱼尾葵果实原花青素的提取工艺[J].食品科学,2012,33(20):04-108.
[4] 陈青, 熊春华,姚彩萍,等.大孔吸附树脂吸附染料木黄酮的研究[J].食品科技,2011,36(5):199-202.
[5] 董玲燕,李琳,赵雷,等.酱油渣中大豆异黄酮的提取及纯化工艺[J].食品科学,2012,33(14):30-35.
[6] 姜绍通,侯晨晔.基于膜分离的茶多酚绿色制备方法研究[J].食品科技,2013,38(5):227-231·
[7] PENG Z, HAYASAKA Y, BAND P G, et al. Quantitative analysis of polymeric procyanidins ( tannins ) from grape ( Vitis vinifera ) seeds by reverse phase high- performance liquid chromatography[J]. J Agric Food Chem, 2001, 49(1): 26- 31.
[8] 杨青,何传波,魏好程,等.大孔树脂纯化山竹壳原花青素的研究[J].热带作物学报,2013,34(3):569-573.
[9] 张泽生,赵春艳,曹力心,等.大孔吸附树脂分离纯化山楂果中原花青素的研究[J].现代食品科技,2006,2(16):16-19.
[10] 李仁杰,陈锦屏,张娜,等.超声波辅助提取月柿原花青素及其纯化[J].食品与发酵工业,2011,37(3): 225-229.
[11] 张蕊红,齐永琴,邓天昇,等.脱脂沙棘籽渣中原花青素的提纯与稳定性研究[J].食品工业科技,2011,32(8):310-313.
[12] 冯进,李敏,曾晓雄,等.大孔树脂纯化蓝莓叶多酚及其组成分析[J].食品科学,2013, 34(10): 86-91.
[13] 蒋其忠.茶籽壳原花青素的分离纯化、稳定性及抗氧化活性研究[D].合肥:安徽农业大学,2010.
[14] 崔莹,朱清华,杨义听,等.树脂法分离纯化苦荞麦壳中原花青素的研究[J].中国粮油学报,2009,24(4):46-49.
