CGF联合骨代用品在促进骨缺损愈合的实验研究
2014-02-06张晓鹏邹高峰柳宏志张丽霞
张晓鹏,邹高峰,李 超,柳宏志,张丽霞,魏 丽
(1.佳木斯大学口腔医学院,黑龙江 佳木斯 154002;2.秦皇岛市海港医院口腔科,河北 秦皇岛 066000;3.大庆油田总医院口腔科,黑龙江 大庆 163001)
拔牙是口腔颌面外科基本临床操作之一,术后牙槽窝中骨愈合时间的长短,通常仅仅依靠患者自身的骨愈合能力,大体上骨愈合时间为3~6个月[1],而当细菌及食物残渣进入,血凝块形成不良等情况发生时,又无法避免地延迟了术后牙槽窝骨缺损愈合时间,导致牙槽骨形态愈合不良、干槽症等并发症的发生。术后牙槽窝内单独植入羟基磷灰石生物陶瓷仅仅在牙槽窝的丰满度、牙槽窝的骨愈合时间上有所改善,但远远无法达到临床要求及临床医生的满意度。本研究旨在通过术后牙槽窝内植入浓缩生长因子(Concentrate growth factors CGF)+羟基磷灰石生物陶瓷与单独植入羟基磷灰石生物陶瓷的比较,浓缩生长因子(Concentrate growth factors CGF)在提高骨缺损愈合方面的能力。
1 材料和方法
1.1 材料
1.1.1 实验动物:健康一岁龄雄性杂种犬12只,体质量20~22kg(大庆油田总医院动物实验中心提供)。
1.1.2 试剂和材料:速眠新II注射液(军事医学科学院军事兽医研究所提供)。
1.1.3 设备:Medifuge(Silfradent 意大利)离心加速机;特定离心管。X光牙片机:ODS-I口腔数字成像系统(大庆油田总医院放射科提供)。
1.2 方法
1.2.1 CGF的制备[1~2]
抽取实验动物自身血液注入10mL的试管(Medifuge离心加速机特殊匹配试管,真空负压,不含抗凝剂等任何添加剂)中,注满后勿摇动,共注入两支,立即放入Medifuge离心加速机的转筒中,按预定程序制备出CGF。第一支CGF切割成1~2mm的颗粒,与骨代材料进行混合,并放入搅拌机(Silfradent 意大利)旋转6s,混合均匀后嵌入骨缺损处。第二支CGF模具压制,获得CGF薄膜。
1.2.2 拔牙
术前禁食水12h,麻醉前15min皮下注射阿托品(0.04mg/kg)以减少唾液的分泌,速眠新(100U/mL,0.1~0.2mL/kg),氯胺酮(5~10mg/kg)肌肉注射麻醉。(戊巴比妥钠(30mg/kg)后肢外侧隐静脉滴注维持全麻)拔除双侧下颌第一前磨牙,压迫止血。
1.2.3 CGF的植入
彻底搔刮牙槽窝后,将CGF-羟基磷灰石陶瓷糊状粘结剂和羟基磷灰石生物陶瓷,按照实验设计分别嵌入牙槽窝骨缺损处。潜行分离颊舌侧的粘骨膜瓣,严密缝合创口。术后3d,每日肌注青霉素针40万单位,预防感染。术后单笼专人饲养。
1.2.4 制取标本
术后4w、8w、12w分别处死动物,取材进行X线片及组织学观察,并进行骨密度测量分析。
1.3 统计学处理
采用SPSS11.5软件处理,根据Lane-Sandhu[3]X线和组织学评分标准进行评分,两组间评分结果采用配对资料t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大体观察结果
12只实验犬均健康,手术创口均一期愈合,术区黏膜色温正常,周围无感染迹象,牙槽窝丰满。
2.2 组织学观察结果
术后4w,实验组:新生骨组织内可见大量的前成骨细胞、成骨细胞,少量骨组织形成,成骨细胞有向拔牙窝内骨缺损处生长的趋势,类骨质形成,形成骨陷窝;对照组:新生组织内前成骨细胞、成骨细胞数量较实验组少,纤维组织较多;术后8w,实验组:新生骨组织较成熟,有大量前成骨细胞、骨细胞、破骨细胞、成骨细胞及形成骨小梁,并可见成骨细胞呈板层状排列,形成连续的骨小梁;对照组:新生骨组织欠成熟,骨小梁结构细小、散乱;术后12w,实验组:成熟的骨组织形成,与周组织未见明显的界限;对照组:新骨形成,呈板层状结构,纤维组织含量少。

图1 a.实验组术后4w,可看到大量成骨细胞;b.对照组术后4w,新生组织内骨细胞数量少

图2 a.实验组术后12w,成熟的骨组织形成;b.对照组术后12w,板层状结构
2.3 X线观察结果
实验组:术后4w,术区骨密度增加,但周围有透射区,术后8周,X线透射区基本消失,见图1,术后12w,X线下可见透射区完全消失;对照组:术后8w,术区有较明显的透射影像,见图2,直到12w时才基本消失。在整个愈合过程中,实验组的骨愈合程度均优于对照组,并表现出明显差异。

图3 a.实验组术后8w,透射区基本消失,形成的骨小梁较连续;b.对照组术后8w,仍有较明显的透射影像
2.4 骨密度测量
见表1。
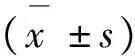
表1 各时间段实验组和对照组骨密度值
3 讨论
浓缩生长因子(Concentrate growth factors CGF)[2]中含有大量的生长因子,如表皮生长因子(epidermal growth factor EGF),血小板源生长因子(platelet-derived growth factor PDGF),转移生长因子-β(transforming growth factor TGF-β),血管内皮生长因子(Vascular endothelial growth factor VEGF),类胰岛素生长因子(Insulin-like growth factor IGF-1),骨形成蛋白(BMP)[4,5]和成纤维细胞生长因子(fibroblast growth factor FGF)。PDGF[6]促进细胞趋化、增殖,并且可增加胶原蛋白的合成能力;VEGF[7]加速损伤组织进行再血管化;FGF诱导骨再生;EGF和IGF-1调节细胞的生长、发育和代谢,加强局部的成纤维细胞、间叶细胞等相关细胞进行迁移和趋化;TGF-β作为趋化因子能将骨母细胞吸附到骨缺损区,刺激前成骨细胞进行有丝分裂,加强胶原蛋白、非胶原蛋白和蛋白质聚糖的合成能力,增大骨细胞在缺损区的密度,促进骨基质的沉淀。骨形成蛋白( BMP)[4,5]能诱导未分化的间充质细胞转化为成骨细胞或成软骨细胞,并促进骨生长。各种生长因子相互协同,相互作用,相互促进,达到最佳的治疗效果。
本组实验分为实验组(植入CGF+羟基磷灰石生物陶瓷)和对照组(植入羟基磷灰石生物陶瓷),CGF联合骨代材料的混合物对拔牙窝骨缺损的修复再生表现为:①组织学观察:实验组的新骨形成时间短于对照组,且同期形成的新骨更为成熟;②X线观察:CGF缩短了骨愈合的时间,实验组在8w时X线透射区已基本消失,而对照组直至12w才达到相近似的程度;③骨密度值分析:从实验的不同时期的同期比较来看,实验组的骨密度值均高于对照组。
在4~12w的整个愈合过程中,无论从大体观察、组织学观察、X线观察方面实验组均优于对照组,同一时期新生骨组织均相对成熟。分析原因可能是:(1)实验中的浓缩生长因子(Concentrate growth factors CGF)富含多种高浓度基本生长因子,在最大程度上满足机体早期组织愈合需要,起到了充分的骨诱导作用,同时也能够缩短术区牙槽黏膜愈合时间及肉芽组织形成时间。(2)浓缩生长因子(Concentrate growth factors CGF)自身具有独特的三维网状结构,微观上起到了一种细胞支架(缓释载体)的作用,使血小板、成骨细胞、骨细胞及前成骨细胞更易于附着于表面,进行分裂、增殖。(3)浓缩生长因子(Concentrate growth factors CGF)和骨代用品(羟基磷灰石生物陶瓷)混合搅拌后形成了更为黏稠和稳定的状态,有利于骨代材料支架作用的发挥。(4)浓缩生长因子(Concentrate growth factors CGF)和骨代用品(羟基磷灰石生物陶瓷)兼具有骨诱导和骨引导作用,能够诱导未分化的间充质细胞转化为成骨细胞或成软骨细胞,并促进骨生长,并提供支架引导新骨向内生长或沉积。以上结果充分说明浓缩生长因子(Concentrate growth factors CGF)联合骨代用品在缩短缺损区骨组织愈合时间、提高缺损区骨愈合质量上起着重要作用,值得临床上广泛应用。
[1]柳宏志,李超,王天祥,等.CGF联合骨代用品在即刻种植中修复种植体周围骨缺损的实验研究[J].口腔颌面外科杂志, 2012,08:28
[2]Dong Seak Sohn.The effect of concentrated growth factors on ridge augmentation[J].Dentalinc, 2009,10:34-40
[3]Joos U,Kleinheinz J.Reconstruction of the severely resorbed(class VI)jaws:routine or exception[J].J Craniomaxillofac Surg,2000,28(1):1-4
[4]Urist MR, Ddlange RJ, Finerman GA.Bone cell different iation and growth factors[J].Science, 1983, 220(4598):680-686
[5]Y am aguchi A.Application of BMP to bone repair[J].Clin Calcium.2007,17(2):263-369
[6]Eppley BL, Woodell JE, Hiqqins J.Platelet quantification and grow the factor analys is from platelet-rich plasma: implications for wound healing[J].Plast Reconstr Surq, 2004,114(6):1502-1508
[7]王琳琳,朱炎.血管内皮生长因子在口腔恶性肿瘤研究中的进展[J].口腔颌面外科杂志, 2006,16(1):87-90
