松辽流域沉积物和黑炭对萘的吸附
2014-02-05张景环
张景环
(1 青岛科技大学环境与安全工程学院,山东 青岛,266042;2北京师范大学环境模拟与污染控制国家重点联合实验室)
多环芳烃在沉积物中的吸附作用强烈影响其在天然环境中的分布、迁移和最终归宿。这种吸附作用主要取决于沉积物有机质的性质。沉积物有机质包括2个区域:橡胶态或无定型态有机质(软碳)和玻璃态或凝聚态有机质(硬碳)。软碳包括富里酸和橡胶态的胡敏酸,硬碳包括玻璃态胡敏酸、干酪根和黑炭。软碳对有机污染物的吸附主要是分配作用,表现为线性吸附;而硬碳对有机污染物的吸附包括分配作用和表面吸附作用,表现为非线性吸附[1]。随着人类活动和工业污染的加剧,越来越多的由燃烧和高温加热产生的黑炭进入天然环境中。环境中的黑炭主要是由生物物质燃烧(森林火灾和居民木材燃烧)和化石燃料燃烧(煤、石油、交通和工业)形成的,包括烟灰型黑炭和木炭型黑炭两种[2,3]。黑炭具有很大的比表面积,是疏水性有机污染物的超强吸附剂[4,5]。研究显示,中国典型水系沉积物中黑炭对多环芳烃的吸附能力远远大于胡敏酸和胡敏素[5]。同时,有文献报道,黑炭对多环芳烃的这种超强吸附能力也受到共存污染物,如表面活性剂和溶解性有机质的影响[6,7]。
东北地区属于我国的老工业基地,辽河与松花江是东北地区仅有的两大江河,也是我国七大江河中两条重要水系。但是随着东北地区工业的迅速发展,这两大江河的污染日益严重,尤其是有机污染更为严重,这不仅破坏了生态平衡,而且严重威胁松辽流域人民的健康,影响东北工业的发展[8]。由于长期的工业污染,使得松辽流域沉积物有机质中黑炭质量分数可能较其他水系高。针对松辽流域的污染特点,研究该地区沉积物中黑炭对多环芳烃的吸附作用对评价该区域有机污染具有重要意义。萘作为一种典型的多环芳烃的代表性污染物已经引起越来越多的环境学者的关注,萘在水中的溶解度小,易溶于有机溶剂,并可以在人体内累积,对人类健康和环境都具有极大的危害。通过以毒性最低的萘为典型多环芳烃进行研究所获得的数据对其他多环芳烃的吸附行为也具有重要的指导意义和借鉴价值。
鉴于此,本研究从东北地区松辽流域选取6种沉积物样品:浑河北杂木、浑河大桥、大辽河营口渡口、太子河下王家、松花江肇源和松花江大桥沉积物,首先通过375 °C热氧化方法对沉积物中的黑炭进行分离定量,并对原始沉积物和黑炭的主要理化性质进行分析,同时测定沉积物和黑炭对萘的吸附等温线,本研究为预测多环芳烃在沉积物环境中的迁移转化和最终归趋提供了理论依据。
1 试验材料与方法
1.1 药品和试剂
萘标准品的纯度为99.5%,Fluka公司生产(美国)经百灵威公司购买,萘的分子量MW为128.2 g·mol-1,25 ℃时在水中的溶解度Sw为31.7 mg·L-1,辛醇/水分配系数LogKow为3.37[9]。色谱纯甲醇购自美国Fisher公司,叠氮化钠购自美国Sigma公司,盐酸、氢氟酸、无水氯化钙等其他试剂均为分析纯,购自北京化学试剂公司。用甲醇作溶剂配制萘的标准溶液,为了防止共溶剂效应,溶液中甲醇的体积分数小于0.002[10]。
1.2 沉积物样品的采集与分析
6种表层沉积物样品(0~20 cm)采自中国松辽流域,分别为:浑河北杂木(41°59.637′N, 124°27.621′E)、浑河大桥(41°42.658′N, 123°18.281′E)、大辽河营口渡口(40°40.987′N, 122°12.201′E)、太子河下王家(41°20.559′N, 123°08.412' E)、松花江肇源(45°29.439′N, 124°59.510′E)和松花江大桥(45°45.430′N, 126°35.035′E)。样品冷冻干燥,研磨过0.02 mm筛后备用。采用Vario EL型TOC分析仪(德国)对样品进行C,H,N,O元素分析,燃烧管温度为950 °C,还原管温度为550 °C,载气为氦气,流速为200 mL/min。用ASAP-2010型比表面积测定仪测定样品的比表面积SSA。
1.3 沉积物中黑炭样品的分离提取
采用375 ℃热氧化方法对沉积物中的黑炭进行分离定量[11]:称取25 g沉积物样品放入500 mL塑料瓶中,首先加入浓度为0.1 mol·L-1的盐酸200 mL,去除沉积物中的碳酸盐矿物。然后加入1 mol·L-1盐酸和体积分数为0.1的氢氟酸混合溶液200 mL,室温避光振荡5 d,以4 000 r·min-1离心分离,去除沉积物中的硅酸盐矿物,这个过程重复4次。将塑料瓶中剩余的残余物放入马弗炉中,在375 ℃下灼烧24 h,即可得到黑炭样品,过程中要保证空气流通,空气流速为200 mL·min-1。黑炭样品用去离子水清洗至中性,研磨过0.02 mm筛后备用。
1.4 沉积物和黑炭对萘吸附实验
称取20 mg沉积物或黑炭样品加入50 mL玻璃离心管(带Teflon盖子)中,然后加入一系列不同质量浓度的萘溶液(0.05~10.00 mg·L-1),加入0.001 mol·L-1的CaCl2溶液调节溶液的离子强度,加入100 mg·L-1的 NaN3抑制微生物的生长[12],密封后置于HZQ-F160型恒温振荡培养箱中,恒温(25 ℃)避光振荡7 d,以4 000 r·min-1转速离心分离30 min,取上清液用0.45 μm尼龙滤膜过滤,测定萘的浓度。每组实验做2组平行实验,并做不加吸附剂的空白对照实验,测定萘的回收率。预实验表明,添加不同质量浓度的萘,测得萘的回收率均在95 %以上,所以本研究可以忽略由于挥发和容器壁吸附造成的损失。萘的吸附量用溶液的初始浓度与平衡后水相浓度的差计算求得。
1.5 萘的分析检测
萘的测定采用高效液相色谱法。仪器为美国Waters 1525,检测器为Waters 474荧光检测器,色谱柱为C18反相色谱柱(4.6 mm×250 mm),流动相为V甲醇∶V水=90∶10,流动相流速为1 mL·min-1,激发波长和发射波长分别为250 nm和364 nm,进样量20 μL,标准曲线法定量。
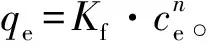
2 结果与讨论
2.1 沉积物和黑炭的理化性质分析
6种沉积物的总有机碳和黑炭的质量分数变化范围较大,分别为0.000 93~0.043 90和0.000 55~0.004 01(表1),其中最高的是浑河北杂木沉积物,最低的是松花江大桥沉积物。除松花江大桥样品外,其他沉积物样品中黑炭占总有机碳的质量分数为0.091 3~0.374 0,其平均值为0.205 0,这个数值与前人的研究结果接近。文献报道,新英格兰港口沉积物和法国湖泊沉积物中黑炭占总有机碳的质量分数为0.03~0.13和0.05~0.39[14,15]。海洋沉积物中黑炭占总有机碳的质量分数为0.15~0.30[16],中国土壤/沉积物中黑炭占总有机碳的质量分数为0.183~0.410[17]。然而,松花江大桥沉积物样品中黑炭占总有机碳的质量分数为0.595,远远大于文献中报道的数值。这主要是因为松花江大桥样品位于松花江下游,位于上游的重油加工厂排放的含碳污水排放入松花江中,从而导致沉积物中黑炭含量增加。沉积物样品的总有机碳和总有机氮质量比为15.4~23.5。黑炭样品的C/N原子比变化范围较大,为10.3~34.6,这与前人报道的数值接近[18~20],但是远小于标准柴油烟灰样品的C/N值(接近60)[7]。
沉积物和黑炭样品的比表面积分别为(1.21~9.49)m2·g-1和(7.12~28.6)m2·g-1,沉积物样品在375 °C下灼烧去除有机质后,得到的黑炭样品的比表面积较沉积物增加了(5.91~24.0) m2·g-1。也有文献报道去除沉积物中有机质会引起比表面积的增大[20]。6种不同沉积物中总多环芳烃的质量分数差别较大,为43.41~1 417 ng·g-1[13]。沉积物中总多环芳烃的质量分数与黑炭质量分数具有很好的正相关关系(R2=0.851,p<0.01),而与总碳的质量分数相关性不明显(R2=0.442,p>0.1)(图1,图2)。这表明沉积物中多环芳烃的分布主要取决于沉积物中黑炭而不是总碳的质量分数,同时也说明黑炭在沉积物对多环芳烃的吸附过程中起着非常重要的作用。
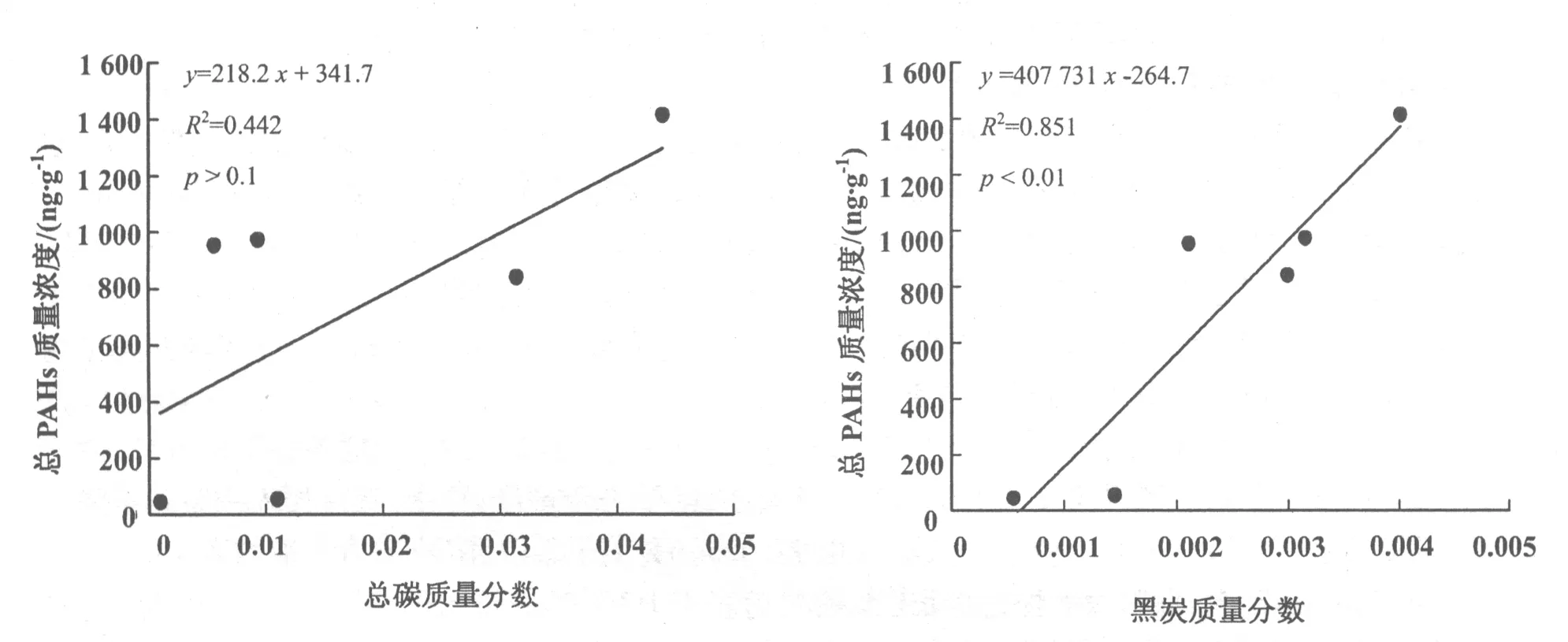
图1 沉积物中总PAHs质量浓度与总碳质量分数的关系 图2 沉积物中总PAHs质量浓度与黑炭质量分数的关系
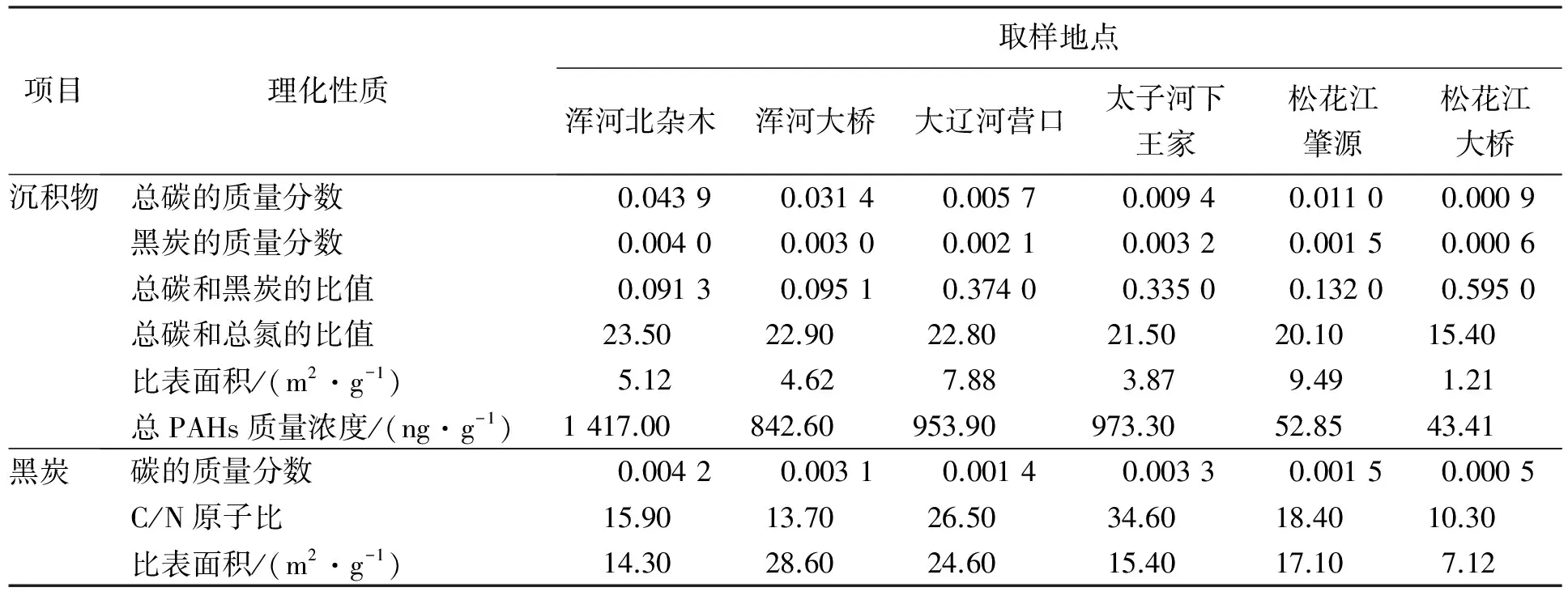
表1 松辽流域沉积物和黑炭的理化性质
2.2 沉积物和黑炭对萘的吸附
松辽流域6种沉积物和黑炭对萘的吸附等温线如图3和图4所示。所有沉积物和黑炭对萘的吸附等温线均表现为非线性,Freundlich模型对吸附数据的拟合参数见表2。6种不同来源沉积物样品对萘的吸附非线性因子n值在0.871~0.954之间,其中浑河北杂木沉积物对萘的吸附非线性程度最高。这个数值大于已有文献中报道的数据[21,22]。与原始沉积物相比,黑炭表现出更强的非线性吸附,对萘的吸附参数n值在0.629~0.827之间。其中,浑河大桥沉积物中黑炭对萘的吸附表现出最强的非线性,而太子河下王家沉积物中黑炭的线性吸附最强。非线性吸附参数n值与表面吸附位能分布和天然有机质的非均质性和成熟度密切相关[1]。n值越小,说明有机质的非均质性和成熟度越高。所以,黑炭比原始沉积物样品含有更多非均质性的吸附位。
表2表明,原始沉积物对萘的吸附能力参数Kf值和LogKfoc值分别在5.63~63.7 (mg·kg-1)/(mg·L-1)n和3.158~3.782之间。与原始沉积物相比,黑炭对萘的Kf值和LogKfoc值要高,为135~874 (mg·kg-1)/(mg·L-1)n和5.000~5.488,说明黑炭对萘的吸附能力更强。黑炭对萘的吸附能力主要受吸附亲和力(与黑炭的芳香性有关)和吸附位能(与黑炭的比表面积及吸附质有关)的影响,沉积物经375 ℃灼烧后,黑炭的吸附位发生了明显的改变,有机质及原始的吸附质被分解或解吸。

图3 不同来源沉积物对萘的吸附等温线 图4 不同来源黑炭对萘的吸附等温线

表2 不同来源沉积物和黑炭对萘的Freundlich拟合参数

n值的差异导致Kfoc的单位不同,因此不能仅仅从比较Kfoc值来比较沉积物和黑炭对萘的吸附能力,因此表2给出了在单一浓度下的有机碳标化的吸附能力参数Koc的值。对于单一吸附剂-吸附质体系,给定浓度下的有机碳标化吸附系数Koc值随着萘的浓度Ce的增大而减小,这是由吸附等温线的非线性造成的。在Ce= 0.05 mg/L下,6种不同来源沉积物的Koc值在1 670~7 289 mL/g之间,黑炭的Koc值在167 910~642 501 mL/g之间,是原始沉积物Koc值的60~352倍,说明黑炭的吸附能力远大于原始沉积物对萘的吸附能力。而在Ce=0.5 mg/L下,6种沉积物的Koc值降至1 488~6 319 mL/g之间,黑炭的Koc值降至112 740~364 648 mL/g之间,是原始沉积物Koc值的49~168倍。沉积物样品中,松花江大桥沉积物对萘的吸附能力最强,而黑炭样品中,松花江肇源沉积物中的黑炭对萘表现出最强的吸附能力。Koc值的差异说明不同来源沉积物的结构和理化性质将会影响其对萘的吸附非线性和吸附能力,同时其形成的黑炭结构和性质也不同,导致对萘的吸附能力不同。沉积物对萘的吸附能力参数Kf值与总碳质量分数的关系如图5所示。随着沉积物中总碳的质量分数从0.009 30增加到0.043 91,萘的Kf值从5.63(mg·kg-1)/(mg·L-1)升高到63.70(mg·kg-1)/(mg·L-1),并且Kf值与总碳质量分数存在很好的正相关关系(R2=0.990,p<0.001),揭示了沉积物有机碳含量在萘吸附能力中的重要性。
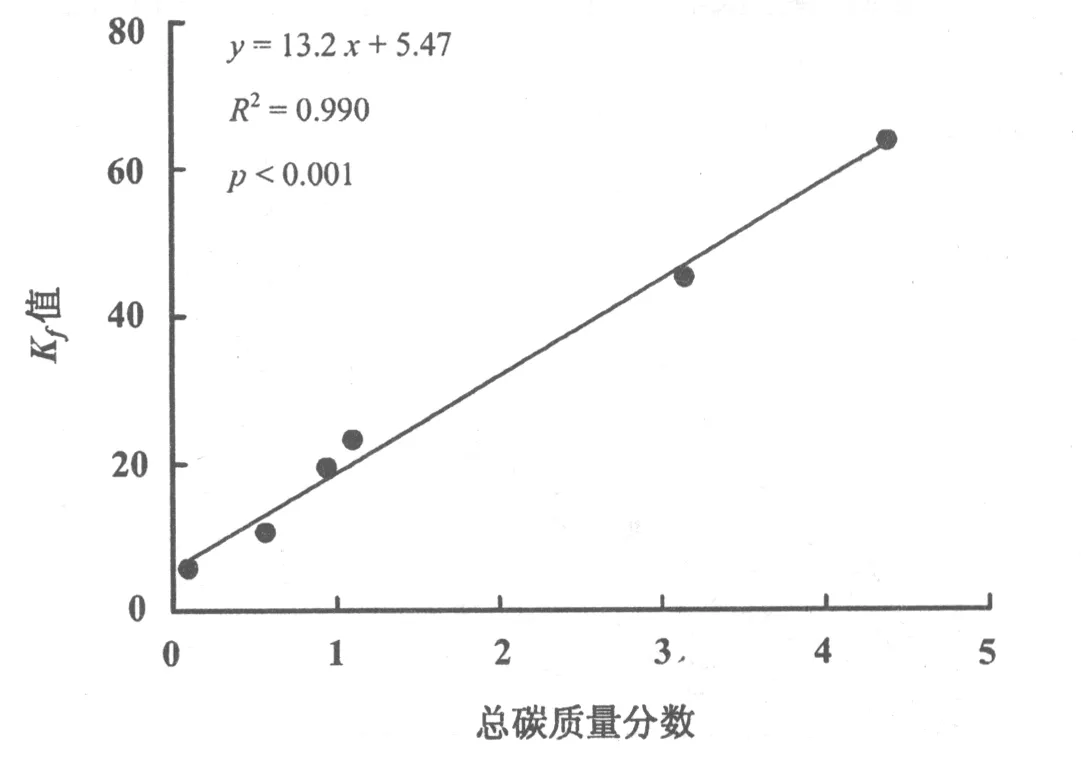
图5 萘的Kf值与沉积物总碳质量分数的关系
3 结 论
(1) 松辽流域6种沉积物样品中,松花江大桥沉积物中黑炭占总碳的质量分数为0.595。其他沉积物中黑炭占总碳的质量分数为0.091 3~0.374 0,其平均值为0.205 0。沉积物样品在375 °C下灼烧去除有机质后,得到的黑炭样品的比表面积较原始沉积物增加了5.91~24.00 m2·g-1。
(2) 与原始沉积物相比,黑炭对萘的吸附非线性和吸附能力更强。在6种不同来源黑炭样品中,浑河大桥沉积物中黑炭对萘的吸附表现出最强的非线性,而松花江肇源沉积物中黑炭对萘的吸附能力最强。萘的Kf值与沉积物的总碳质量分数显著正相关,说明沉积物有机碳含量在萘吸附能力中的重要性。
[1] Weber Jr W J,Mcginley P M,Katz L E. A distributed reactivity model for sorption by soils and sediments: 1. Conceptual basis and equilibrium assessments[J].Environmental Science & Technology, 1992, 26: 1955-1962.
[2] Benner Jr B A.Distinguishing the contributions of residential wood combustion and mobile source emissions using relative concentrations of dimethylphenanthrene isomers[J].Environmental Science & Technology, 1995, 29: 2 382-2 389.
[3] Reddy C M,Pearson A,Xu L,et al. Radiocarbon as a tool to apportion the sources of polycyclic aromatic hydrocarbons and black carbon in environmental samples[J].Environmental Science & Technology,2002,36: 1 774-1 782.
[4] Gustafsson O,Haghseta F, Chan C,et al.Quantification of the dilute sedimentary soot phase: implications for PAH speciation and bioavailability [J].Environmental Science & Technology,1997,24:1 687-1 693.
[5] Zhang J,He M,Lin C,et al.Phenanthrene sorption to humic acids,humin and black carbon in sediments from typical water systems in China[J].Environmental Monitoring and Assessment,2010,166:445-459.
[6] Zhang J,He M.Effect of surfactants on sorption and desorption of phenanthrene onto black carbon[J].Water Environment Research,2011,83(1):15-22.
[7] Zhang J,He M.Effect of dissolved organic matter on sorption and desorption of phenanthrene onto black carbon[J].Journal of Environmental Science,2013,25(12): 2 378-2 383.
[8] 许士奋,蒋新,王连生,等.长江和辽河沉积物中的多环芳烃类污染物[J].中国环境科学,2000,20 (2):128-131.
[9] Mackay D,Shiu W Y,Ma K C.Illustrated Handbook of Physical-Chemical Properties and Environmental Fate for Organic Chemicals[M].Chelsea: Lewis Publishers,1992.
[10] Wauchope R D,Koskinen W C.Adsorption-Desorption Equilibria of Herbicides in Soil: A Thermodynamic Perspective [J].Weed Science,1983,31: 504-512.
[11] Gelinas Y,Prentice K M,Baldock J A,et al.An improved thermal oxidation method for the quantification of soot/graphitic black carbon in sediments and soils[J].Environmental Science & Technology,2001,31:3 519-3 525.
[12] Wen B,Zhang J,Zhang S,et al. Phenanthrene sorption to soil humic acid and different humin fractions [J].Environmental Science & Technology,2007,41:3 165-3 171.
[13]. Guo W,He M,Yang Z,et al.Comparison of polycyclic aromatic hydrocarbons in sediments from the Songhuajiang River (China) during different sampling seasons[J].Journal of Environmental Science and Health Part A: Toxic/Hazardous Substances and Environmental Engineering,2007,42:119-127.
[14] Gustafsson O,Gschwend P M.The flux of black carbon to surface sediments on the New England continental shelf [J]. Geochimica Cosmochimica Acta,1998,62:465-472.
[15] Lim B,Cachier H.Determination of black carbon by chemical oxidation and thermal treatment in recent marine and lake sediments and Cretaceous-Tertiary clays[J].Chemical Geology,1996,131:143-154.
[16] Middelburg J J,Nieuwenhuize J,Van Breugel P. Black carbon in marine sediments[J].Marine Chemistry,1999,65: 245-252.
[17] Song J,Peng P,Huang W.Black carbon and kerogen in soils and sediments: 1. Quantification and characterization[J].Environmental Science & Technology,2002,36:3 960-3 967.
[18] Kilduff J E,Wigton A.Sorption of TCE by humic-preloaded activated carbon: Incorporating size- exclusion and pore blockage phenomena in a competitive adsorption model[J].Environmental Science & Technology,1999,33:250-256.
[19] Karapanagioti H K,Kleineidam S,Sabatini D A,et al.Impacts of heterogeneous organic matter on phenanthrene sorption: Equilibrium and kinetic studies with aquifer material[J].Environmental Science & Technology,2002,34: 406-414.
[20] Mayer L M.Surface area control of organic carbon accumulation in continental shelf sediments[J].Geochimica Cosmochimica Acta,1994,58:1 271-1 284.
[21] Xiao B,Yu Z,Huang W,et al.Black carbon and kerogen in soils and sediments.2.Their roles in equilibrium sorption of less-polar organic pollutants[J].Environmental Science & Technology,2004,38(22):5 842-5 852.
[22] Chen D,Xing B,Xie W.Sorption of phenanthrene,naphthalene and o-xylene by soil organic matter fractions[J].Geoderma,2007,139(3):329-335.
