OPN 影响小鼠MSCs 迁移及其相关分子机制研究*
2014-02-03王文平王珍祥李世荣
李 薇,王文平,陈 亮,王珍祥,李世荣
(第三军医大学附属西南医院整形外科,重庆 400038)
骨髓间充质干细胞(MSCs)向受损组织的定向迁移已经成为 MSCs 研究的关键问题,但相应的机制仍不十分清楚[1-3]。同时,机体受损部位MSCs被募集时,骨桥蛋白(osteopontin,OPN)表达上调,有可能通过诱导MSCs 定向迁移参与组织修复[4-6]。但迄今为止,OPN 与 MSCs 迁移方面的研究甚少[7],因此本研究拟通过应用外源OPN,观察其对 MSCs 迁移能力的影响,探索 OPN 不同受体在 MSCs 迁移过程中的作用,阐明 OPN 影响 MSCs 迁移行为的机制,为促进创伤愈合寻求新的途径。
1 材料与方法
1.1材料 重组小鼠OPN,美国Gibco公司;标准胎牛血清(FBS),兰州明海公司;Transwell系统,孔径为8 μm、膜直径为6.4 mm,美国BD公司;改良伊格尔(DMEM/F-12)培养液,美国HyClone公司;鼠抗OPN单克隆抗体、鼠抗CD44 单克隆抗体,美国Santa Cruze公司;鼠抗Integrin β1 单克隆抗体,Cell Signaling Technolog;GHPDH蛋白 Marker,北京中衫公司;琼脂糖凝胶电泳系统,美国Bio-Rad公司;PE标记小鼠抗大鼠 CD34、CD105抗体,美国Santa Cruze公司。
1.2方法
1.2.1实验动物与分组 OPN-/-小鼠来自美国Jackson实验室;野生型C57小鼠来自第三军医大学大坪医院SPF级动物室。细胞体外实验分为4组:(1)无细胞培养液为空白对照组;(2)OPN-/-小鼠MSCs为蛋白表达阴性组;(3)OPN治疗组,在OPN-/-小鼠MSCs加入重组OPN,达到0.5 μg/mL的浓度培养MSCs;(4)野生型C57小鼠MSCs为OPN阳性组。以上实验每组设 3个样本,每个实验重复3次。
1.2.2胎鼠原代MSCs培养 取孕19 d雌鼠,颈椎脱臼处死,75%乙醇浸泡10 min。无菌镊子及剪刀配合取出胎鼠,置于装有冷磷酸盐缓冲液(PBS)的玻璃皿内。剪下胎鼠四肢,轻柔仔细取出胎鼠长骨周围软组织,剃出长骨至新的培养皿中,尽量剪碎骨组织加入装有培养液DMEM/F-12+10% FBS的玻璃平皿内,吸管吹散,经300目滤网过滤后,滤液转移至离心管内,1 000 r/min离心10 min,弃上清液。DMEM/F-12+10% FBS培养基重悬细胞。于37 ℃,5% CO2培养箱内培养。培养24 h后可见细胞贴壁,进行换液。细胞融合至80%视野时进行传代。
1.2.3流式细胞仪分选培养细胞 胎鼠MSCs经传代后镜下见杂细胞逐渐增多,传至P3,行流式分选以纯化。方法如下:所有胎鼠MSCs用PBS洗两遍,胰酶消化,镜下控制反应时间,待细胞变圆从瓶壁脱落终止消化,转移至离心管内1 000 r/min离心 10 min,弃上清液。PBS重悬细胞,1 000 r/min离心 10 min,弃上清液。PBS重悬,计数板计数,得细胞数4×105个,分A、B、C、D 4个EP管,每管1×105。A管内不加抗体,B管内加入2.5 μL CD105 PE抗体,C管内加入2.0 μL CD34 FITC抗体,D管内加入2.5 μL CD105 PE及2.0 μL CD34 FITC抗体。4 ℃孵育1 h,不时混匀,1 000 r/min离心 10 min。于冰盒内送至西南医院癌症中心进行流式分选。
1.2.4Transwell 检测细胞迁移 取P3的MSCs,处理 24 h以后,酶消化并计数。细胞悬液离心,去除完全培养基,PBS清洗2次。加入培养基,使细胞密度为2×103μL-1。 将2×105细胞悬液加入Transwell小室的上室中, 在下室中加入600 μL的F12-DMEM培养基和OPN混合均匀,使OPN终浓度为0.5 μg/mL,静置6 h; 其后在孵育12、24、36 h,取出Transwell小室,擦去小室膜上面的未迁移的细胞,倒置风干;再在每孔中加入500 μL 0.1%结晶紫溶液,将小室置于其中,同时使膜完全浸没在结晶紫溶液中。室温 30 min 后将小室取出,PBS 清洗,风干; 最后将小室的膜面正置于载玻片上,倒置显微镜下观察。选取4个视野计数,得到迁移细胞数的平均值。
1.2.5蛋白免疫印迹法(Western blot)检测 参考文献[7],取第3代MSCs,加入F12-DMEM培养基和相应的外源重组OPN,使得细胞融合度达到70%~80%终止培养,收获细胞,RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度。10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,上样量40 μg,电转至PVDF膜,5%脱脂奶粉封闭2 h,分别加入一抗OPN(1∶500)、CD44(1∶800)、 Integrin β1(1∶1 000) ,4 ℃孵育过夜。洗膜,分别加HRP 标记的羊抗兔、羊抗鼠二抗(1∶5 000),继续孵育2 h,加ECL发光液,X射线曝光显影。GAPDH为内参照,数据用SensiAnsys 软件分析。

2 结 果
2.1MSCs 的形态学观察 刚转移的细胞呈圆形,不均匀悬浮于培养液中。24 h 后细胞可见贴壁,大部分呈圆形。72 h后,细胞开始呈短梭形纤维状、三角形或星形。未贴壁的杂细胞容易被除去。6 d左右,细胞集落放射状排列,并在14 d左右时细胞达到 85%融合。传代后细胞24 h内呈纤维状完全伸展。 传代细胞4~6 d超过80%融合,呈现更强的增殖能力,形成细胞形态趋于一致的漩涡样单层。
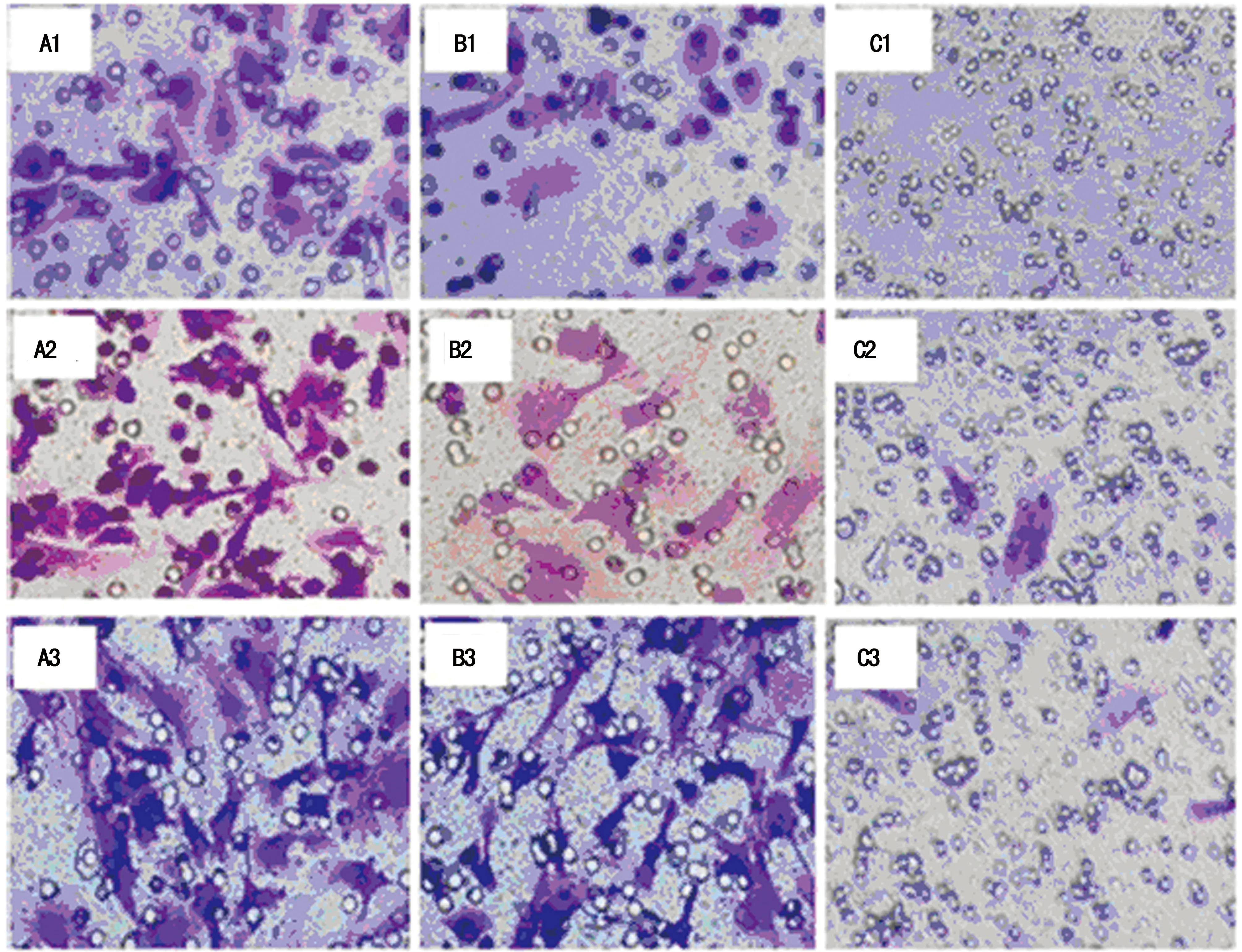
A:小鼠MSCs迁移数量最多;B:0.5 μg/mL的OPN能显著增加OPN-/-MSCs的迁移细胞数;C:OPN-/-MSCs迁移极少;组标1、2、3:观察时间12、24、36 h。
图1 OPN影响MSCs迁移
2.2流式细胞仪分选培养MSCs 结果 MSCs 对CD90、CD105、CD29、CD44等表面标记抗原呈阳性,而对CD34、CD35 CD14等造血干细胞表面标记抗原呈阴性反应。本实验结果表明,CD34 呈阴性(1.02%),CD44呈阳性(96.10%),CD105 呈阳性(95.30%),细胞纯化度较高。分离得到的细胞表达 CD44 和 CD105,但不表达 CD34,符合 MSCs 表面标记抗原的一般规律。
2.3OPN 促MSCs 定向迁移 与空白对照组相比,OPN治疗组能增加体外MSCs的细胞迁移,而OPN阳性组MSCs迁移为最多。同时,这一趋势与OPN作用时间正相关,培养36 h细胞迁移数多于24 h,而24 h又多于12 h(图1)。 进一步,以OPN作用时间36 h细胞迁移数作统计分析,OPN阳性组能使MSCs 的迁移细胞数增加 2倍以上(图2),而OPN治疗组能显著增加MSCs的迁移细胞数,也超过了1倍,与OPN阴性组相比,差异均有统计学意义(P<0.05),见图2。再以MTT 法检测在迁移过程中活细胞的数目,结果表明不同浓度的 OPN 均不会使MSCs细胞数明显改变。
2.4外源性重组OPN 可以促进MSCs细胞中OPN蛋白表达 将OPN-/-小鼠MSCs加入重组OPN(达到0.5 μg/mL的浓度),孵育36 h通过Western blot检测OPN-/-与野生型C57小鼠MSCs OPN表达发现,若以OPN阴性组为基数100,OPN治疗组蛋白量明显增加,但仍低于OPN阳性组,差异有统计学意义(P<0.01),见图3。
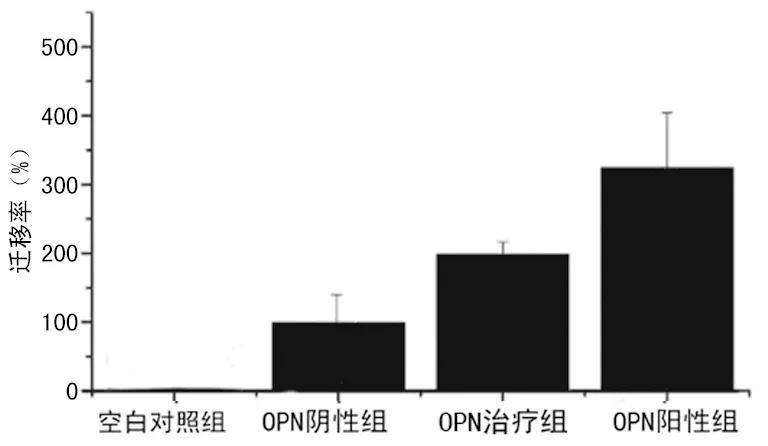
图2 OPN影响MSCs迁移比率变化比较

图3 Western blot检测加入外源性OPN后MSCs中OPN蛋白表达变化

图4 Western blot检测OPN影响MSCs相关蛋白表达变化的比较
2.5OPN促进MSCs细胞中Integrin β1 和 CD44蛋白表达 在孵育36 h通过Western blot检测各组MSCs OPN表达发现,若以OPN阴性组为基数100,OPN治疗组CD44蛋白表达增多,定量分析增加明显,但OPN阳性组细胞CD44蛋白表达进一步增多,定量分析增加,差异均有统计学意义(P<0.01)。同样的结果,若以OPN阴性组为基数100,OPN治疗组Integrin β1蛋白表达增多,差异明显,而OPN阳性组细胞Integrin β1蛋白表达最多,差异均有统计学意义(P<0.01),见图4。
3 讨 论
MSCs 具有很强的体外增殖能力,并同时保持多向分化潜能,因此可作为组织修复的种子细胞,也是多种修复细胞的来源,在损伤愈合中具有重要而关键的作用,但许多有关MSCs的作用环节仍然不甚清楚,需要进一步研究[8-9]。本实验中,骨髓提取细胞增殖能力强,细胞形态与MSCs一致。流式细胞仪检测表明CD34 呈阴性,CD44、CD105 呈阳性,细胞纯化度超过90%。因此,使用适量的骨髓便可获得足量的 MSCs。
OPN 可以介导多种细胞的黏附与迁移[10]。OPN 的缺失降低机体损伤修复功能。缺氧条件下,受损部位 OPN 表达上升,同时诱导MSCs迁移至受损部位,参与组织修复[7]。但OPN 在 MSCs定向迁移过程中的作用与调节机制仍未引起重视。 本研究将OPN-/-小鼠MSCs加入重组OPN(达到0.5 μg/mL),孵育36 h通过Western blot检测OPN-/-小鼠与野生型C57小鼠MSC细胞OPN表达发现,在OPN-/-小鼠加入重组OPN,细胞OPN蛋白表达量明显增加,但仍低于野生型C57小鼠。分析结果证实,OPN 能够诱导MSCs 定向迁移。0.5 μg/mL的OPN能增加体外MSCs的细胞迁移,而野生型C57小鼠MSC细胞迁移为最多。同时,这一趋势与OPN作用时间呈正相关,与OPN-/-小鼠相比,差异均有统计学意义(P<0.05)。OPN 促进MSCs 定向迁移的分子机制还有待进一步探索。
CD44是另一种 OPN 细胞表面受体,可以介导 OPN 促细胞迁移,阻断 CD44 能够抑制OPN 促MSCs迁移[11]。本研究发现, 0.5 μg/mL重组OPN促进CD44蛋白表达增多,定量分析增加非常明显,但野生型C57小鼠细胞CD44蛋白表达进一步增多,相互比较CD44蛋白增加最为显著。结果表明,OPN 能够增加MSCs 中CD44的表达,同时通过结合细胞表面Integrin β1 受体,促进MSCs 定向迁移。
Integrin β1 直接参与调节细胞迁移和组织重构。而OPN 促MSCs 迁移的同时,是否改变了Integrin β1 的表达情况值得研究[12]。本研究也发现,OPN 可以增加Integrin β1 的表达量。OPN作用与时间呈正相关,OPN-/-小鼠MSCs加入重组OPN孵育时间越长,Integrin β1 的蛋白就越高。 MSCs 可能通过Integrin β1,从而定向迁移至缺血性心肌组织中[13]。一旦阻断Integrin β1 后,OPN 促MSCs 迁移过程受到抑制,表明Integrin β1参与 OPN促MSCs定向迁移。
综上所述,OPN 具有促MSCs 定向迁移的能力,且其作用与 OPN 浓度以及作用时间有关。同时,OPN 提高CD44、Integrin β1 受体的蛋白表达水平, 如果阻断后两者受体,OPN 促MSCs 定向迁移的能力受到抑制。因此, OPN可能通过上调MSCs 中CD44、Integrin β1 受体的表达,促进MSCs迁移。
[1]BiebackK,KluterH.Mesenchymaland
stromal cells from umbilical cord blood[J].Curr Stem Cell Res Ther,2007,2(3):310.
[2]Bi Y,Ehirchiou D,Kilts TM,et al.Identification of tendon stem/progenitor cells and the role of the extracellular matrix in their niche[J].Nat Med,2007,13(10):1219-1227.
[3]Conrad C,Niess H,Huss R,et al.Multipotent mesenchymal stem cells acquire a lymphendothelial phenotype and enhance lymphatic regeneration in vivo[J].Circulation,2009,119(2):281-292.
[4]Wang KX,Denhardt DT.Osteopontin:role in immune regulation and stress responses[J].Cytokine Growth Factor Rev,2008,19(4):333-345.
[5]Nilsson SK,Johnston HM,Whitty GA,et al.Osteopontin,a key omponent of the hematopoietic stem cell niche and regulator of primitive hematopoietic progenitor cells[J].Blood,2005,106(1):123-131.
[6]Schauwer CD,Meyer E,Walle GR,et al.Markers of stemness in equine mesenchymal stem cells:a plea for uniformity[J].Theriogenology,2011,75(8):1431-1443.
[7]Zou C,Song G,Luo Q,et al.Mesenchymal stem cells require integrin β1 for directed migration induced by osteopontin in vitro[J].In Vitro Cell Dev Biol Anm,2011,47(2):241-249.
[8]Shi Y,Hu G,Su J,et al.Mesenchymal stem cells:a new strategy for immunosuppression and tissue repair[J].Cell Res,2010,20(4):510-518.
[9]Bourzac C,Smith LC,Vincent P,et al.Isolation of equine bone marrow-derived mesenchymal stem cells:a comparison between three protocols[J].Equine Vet J,2010,42(6):519-532.
[10]Ceradini DJ,Kulkarni AR,Callaghan MJ,et al.Progenitor cell trafficking is regulated by hypoxic gradients through HIF-1 induction of SDF-1[J].Nat Med,2004,10(8):858-864.
[11]Khan SA,Cook AC,Kappil M,et al.Enhanced cell surface CD44 variant(v6,v9) expression by osteopontin in breast cancer epithelial cells facilitates tumor cell migration:novel post-transcriptional,post-translational regulation[J].Clin Exp Metastasis,2005,22(7):663-671.
[12]Brakebusch C,Fassler R.Beta 1 integrin function in vivo:adhesion,migration and more[J].Cancer Metastasis Rev,2005,24(5):403-412.
[13]Suzuki Y,Yanagisawa M,Yagi H,et al.Involvement of beta1-integrin up-regulation in basic fibroblast growth factor- and epidermal growth factor-induced proliferation of mouseneuroepithelial cells[J].J Biol Chem,2010,285(24):1843-1851.
