串珠素在大鼠牙髓损伤修复过程中表达变化的实验研究
2014-02-02刘传通潘乙怀
李 桥,刘传通,潘乙怀
(温州医科大学附属口腔医院,浙江温州 325027)
串珠素在大鼠牙髓损伤修复过程中表达变化的实验研究
李 桥,刘传通,潘乙怀
(温州医科大学附属口腔医院,浙江温州 325027)
目的:探讨串珠素在牙髓损伤修复过程中的表达变化及其可能的作用。方法:取雄性SD大鼠48只,随机分为4组(n=12)。建立大鼠一侧上颌第一磨牙牙髓损伤模型,另一侧同名牙作为正常对照组;分别于损伤后1、3、5、7d各取1组目标牙样本,采用免疫组化染色和Real-time PCR观察检测各组牙髓组织中串珠素的表达变化,并采用单因素方差分析比较各组间的差异。结果:免疫组化染色显示,牙髓损伤后,牙髓组织中串珠素染色强度增加,各实验组的平均光密度均明显高于正常对照组(P<0.05),并以1d组升高最为明显;RT-PCR检测显示,与正常对照组相比,串珠素mRNA的相对表达量在牙髓损伤后1d明显下降,此后随时间延长逐渐回升,损伤后7d时回升最明显,但仍明显低于对照组(P<0.05)。结论:串珠素在牙髓组织损伤后的防御机制中起一定的作用,但其表达的增加并不是由其生物合成增加所致。
串珠素;免疫组化;大鼠;牙髓损伤
[牙体牙髓牙周病学杂志,2014,24(1):17]
[Chinese Journal of Conservativedentistry,2014,24(1):17]
牙源性的细胞外基质(extracellular matrix,ECM)在牙髓组织损伤修复过程中发挥着重要功能,具有抑菌作用[1]、促矿化作用[2],并能影响牙髓细胞的迁移[3]而参与牙本质牙髓复合体的修复和再生过程。串珠素(perlecan)是一种广泛存在于ECM中的蛋白质,在调节多种组织的损伤修复中均具有重要作用[4];但其在牙髓损伤修复过程中的表达及作用尚未见报道。本实验从蛋白和基因水平观察串珠素在大鼠牙髓组织损伤前后的表达变化,探讨串珠素在牙髓损伤修复过程中的可能的作用。
1 材料和方法
1.1 牙髓损伤动物模型的制备
取体质量180~220g雄性SD大鼠 (温州医科大学实验动物中心)48只,以100g/L水合氯醛腹腔注射(3 mL/kg体质量)麻醉后,仰卧固定,常规口内外消毒。然后用牙科高速涡轮机配以G1球钻分别在每只大鼠的一侧上颌第一磨牙牙合面备洞,当出现一小的穿髓点时立即停止,生理盐水充分冲洗,无菌棉球轻压止血,保持窝洞开放状态下常规饲养。每只大鼠的另一侧上颌同名牙不做任何处理,用于正常对照。
1.2 分组和取材
将建模后的48只大鼠随机分为4组(每组12只);分别于建模后1、3、5、7d各取1组大鼠,其中6只用40g/L多聚甲醛液心内灌注处死后分离双侧上颌骨。然后将各组颌骨标本浸泡于新配制的40g/L多聚甲醛溶液内固定48 h;100g/L EDTA溶液中脱钙4周;常规脱水、置换、石蜡包埋,沿牙体长轴作近远中向连续切片(片厚4 μm),用于免疫组化染色。
各组另外6只大鼠分别于麻醉后直接分离上颌双侧第一磨牙,置于液氮中冷冻保存,用于PCR检测。
1.3 免疫组化染色观察各组牙髓中串珠素的表达
1.3.1 免疫组化染色及结果判定
选取各组通过穿髓孔的切片,常规脱蜡至水,并按照免疫组化试剂盒说明进行免疫组化染色,镜下观察。以细胞质、细胞膜或细胞外间质中出现棕黄色染色者为阳性结果,其中浅黄色为弱阳性表达;棕黄色为阳性表达;棕褐色为强阳性表达。
1.3.2 平均光密度分析
各组每个标本选取3张切片,高倍镜视野下(×200)下选取牙髓未腐败坏死部分,在相同拍摄条件下运用显微图像系统拍摄图片,并用Image-Pro Plus 5.0图像分析软件计算每个视野阳性表达的平均光密度值(average opticaldensity,AOD)。计算公式为:平均光密度值=所选视野阳性表达的积分光密度值(integral opticaldensity,IOD)/所选视野的总面积。
1.4 各组牙髓中串珠素mRN表达水平的检测
取液氮冷冻的各组双侧上颌第一磨牙,低温下劈开并取出牙髓组织,按照Trizol试剂盒说明书提取总RNA;经OD260/280值检测确定其纯度和完整性良好后,用逆转录试剂盒合成cDMA。然后以cDNA 为模板,β-actin为内参照,在 Real-timeRCR仪进行PCR扩增。反应体系20 μL,分别为:cDNA 2 μL、上下游引物各 1 μL、双蒸水 6 μL、SYBRgreen Mix 10 μL。扩增条件:95℃变性5 s;60℃退火20 s,72℃延伸30 s,共45个循环。最后根据各样本目的基因和内参基因的反应CT值,采用2-ΔΔCT法计算各样品串珠素mRNA的相对表达量。实验重复3次,所用引物由上海基康生物技术有限公司合成,具体序列见表1。
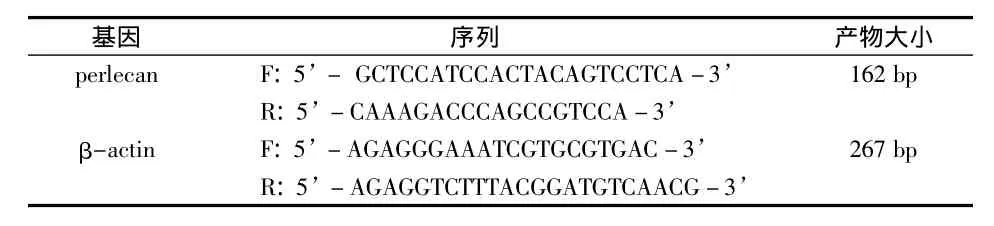
表1 引物序列
1.5 统计学分析
2 结果
2.1 免疫组化染色结果
正常对照组中,串珠素在成牙本质细胞层呈阴性表达;在牙髓组织的多细胞层以及固有牙髓、前期牙本质中呈弥散性弱阳性表达(图1a)。牙髓损伤后1d组中,串珠素在穿髓孔附近炎症细胞浸润区及其下方的牙髓组织中呈阳性表达(图1b)。3d组和5d组中,串珠素在炎症细胞浸润区呈散在强阳性表达,其下方牙髓组织中呈弱阳性表达,(图1c、d)。7d组中,串珠素在炎细胞浸润区与坏死组织交界处的纤维组织中呈阳性表达;炎细胞浸润区以及根髓中呈弱阳性表达(图1e)。PBS代替一抗的空白对照组均未见阳性表达。
光密度分析显示,牙髓损伤后1~7d各实验组中串珠素染色阳性区的平均光密度值均明显高于正常对照组(P<0.05);各实验中以损伤1d组的光密度值最高,此后随着损伤时间延长逐渐下降;各实验组两两相比,除1d与7d组相比有统计学差异(P<0.05)外,其余各组间差异均无统计学意义(P >0.05)(表2)。
表2 各组串珠素染色阳性光密度值比较(±s)
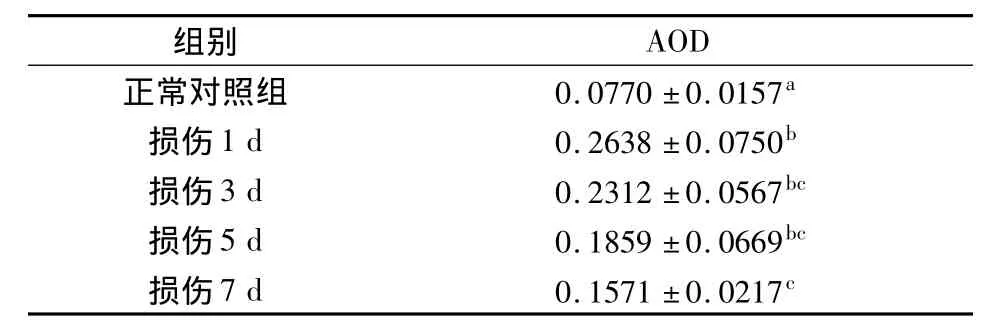
表2 各组串珠素染色阳性光密度值比较(±s)
组别AOD正常对照组 0.0770 ±0.0157a损伤1d 0.2638 ±0.0750b损伤3d 0.2312 ±0.0567bc损伤5d 0.1859 ±0.0669bc损伤7d 0.1571 ±0.0217c
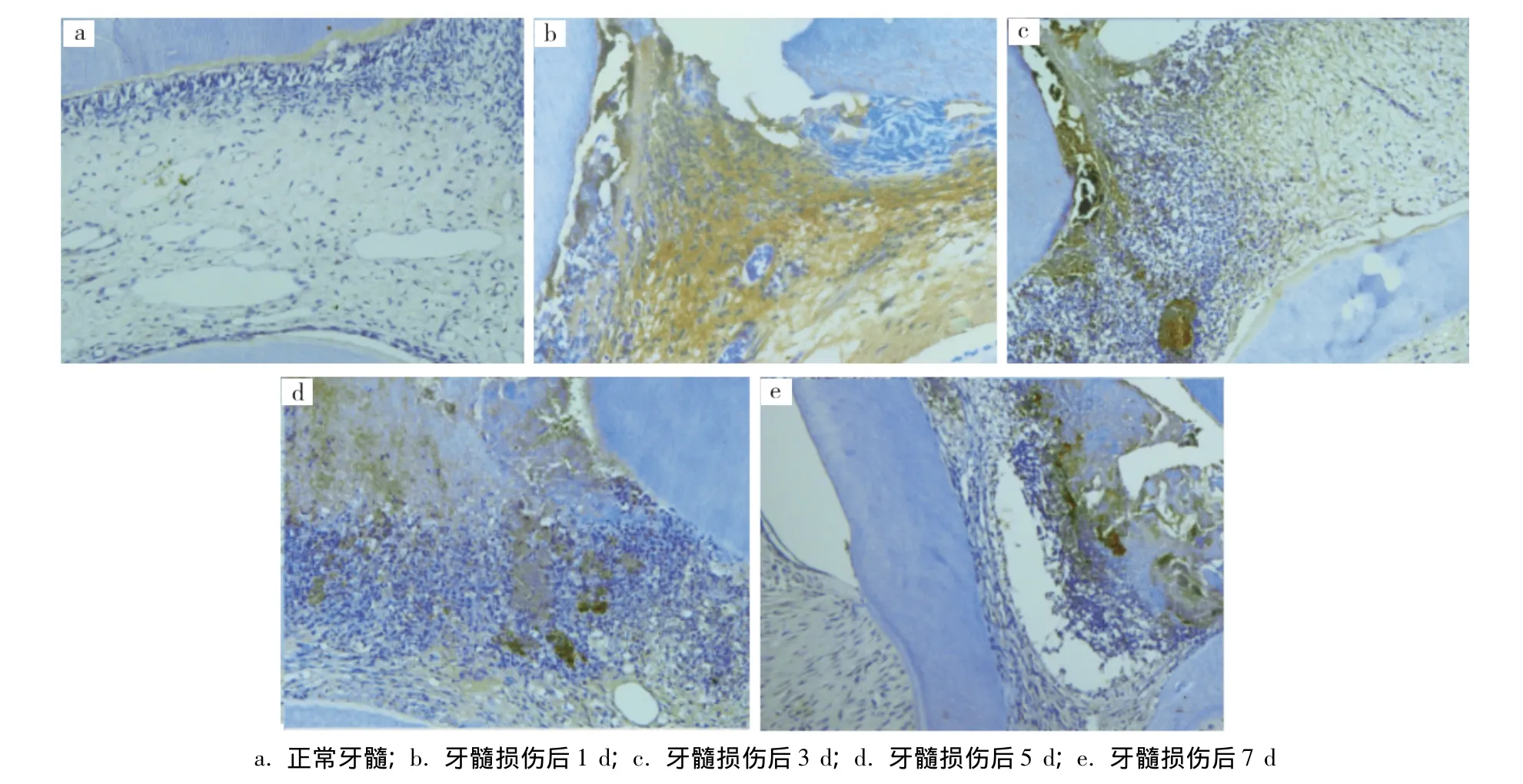
图1 串珠素在大鼠损伤牙髓中的表达(SP,×200)
2.2 Real-time PCR 检测结果
RT-PCR检测显示,牙髓损伤1~7d不同时间后,各实验组牙髓组织中串珠素mRNA相对表达均明显低于正常对照组(P<0.05),其中以损伤1d组下降最明显,此后随着时间延长,串珠素mRNA表达水平逐渐回升,7d时回升最明显;各实验组间两两相比差异均有统计学意义(P<0.05)(表3)。
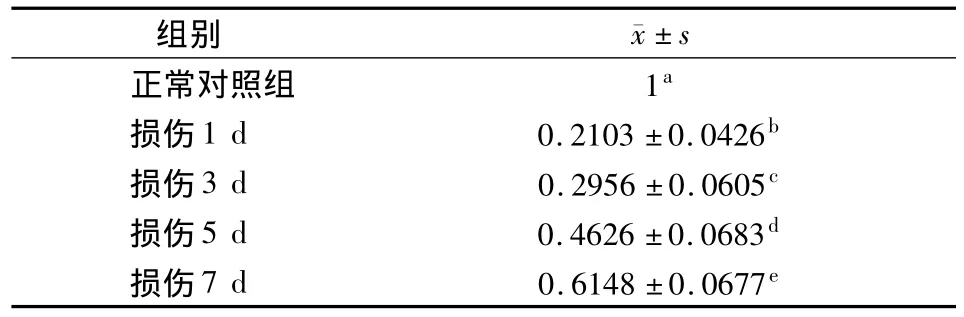
表3 各组串珠素mRNA表达水平比较
3 讨论
目前已知,串珠素可以存储多种生长因子,具有促进细胞增殖和基质合成,保持细胞外基质平衡等作用,并参与多种组织的损伤修复过程和炎症发生发展过程[4];而且这些作用在脑组织损伤[5-6]、动脉粥样硬化[7-8]等的发生、发展中均已得到证实。本结果显示,正常大鼠牙髓组织中串珠素呈弥散性弱阳性表达,与国外学者在小鼠发育中的研究结果相一致[9]。牙髓损伤后串珠素表达增强,并分布于炎症进展的前沿,与炎症细胞浸润呈一定的相关性;提示串珠素在牙髓损伤后的防御机制和炎症细胞浸润中起重要的作用。
有研究表明,串珠素可被分泌进入细胞间隙,并介导信号分子的活动[10]。串珠素基因敲除的小鼠在胚胎发育过程中表现出一系列复杂的异常表型,造成循环系统、呼吸系统异常和骨骼、软骨缺陷及死胎[11-12],这可能是由于其信号传导通路受干扰所致;提示串珠素基因的完整和正确表达是维持机体生长发育及正常生理功能所必需的。此外,串珠素基因的异常表达还可造成小鼠牙体硬组织形态发生异常[9-13],因而,可以认为串珠素基因的正确表达是组织结构重建的重要因素。
本实验通过 Real-time PCR检测了串珠素mRNA在大鼠上颌第一磨牙牙髓损伤不同时间后的表达变化,结果显示:串珠素mRNA表达水平的变化与免疫组化结果相反,在损伤初期明显下降;提示牙髓损伤后串珠素表达增加的机制可能并不是由mRNA水平调节造成的,推测可能存在其他更加重要的调节方式。Jung等[14]发现了类似的现象,如在皮肤紫外线损伤急性期,串珠素mRNA的表达下调,但其蛋白水平上升。这种相反表达的具体机制尚不清楚,推测其原因可能有以下3个方面:①分解串珠素的酶下调所致,诸如heparanase、组织蛋白酶和BMP1/Tolloid-like蛋白酶等若下调,则可减少串珠素的酶解,从而导致串珠素蛋白的表达相对增加;②由机体其他部位运输而来,如造血细胞来源的肥大细胞在组织损伤时向受损部位迁移,并能分泌串珠素,调节损伤部位的血管生成作用和基质的代谢[15];③正常状态下,部分串珠素在细胞外基质中与其他细胞外成分结合,封闭了其抗原位点,而当组织损伤时,由于细胞外基质的结构破坏,则可释放出包含抗原位点的串珠素,从而使其表达相对增多。当然,也可能还存在其他一些尚未认识到的机制,需进一步深入研究。
[1]Smith JG,Smith AJ,Shelton RM,et al.Antibacterial activity ofdentine and pulp extracellular matrix extracts[J].Int Endod J,2012,45(8):749-755.
[2]Goldberg M,Smith AJ.Cells and extracellular matrices ofdentin and pulp:a biological basis for repair and tissue engineering[J].Crit Rev Oral Biol Med,2004,15(1):13-27.
[3]Smith JG,Smith AJ,Shelton RM,et al.Recruitment ofdental pulp cells bydentine and pulp extracellular matrix components[J].Exp Cell Res,2012,318(18):2397-2406.
[4]Whitelock JM,Melrose J,Iozzo RV.Diverse cell signaling events modulated by perlecan[J].Biochemistry,2008,47(43):11174-11183.
[5]Garciade Yebenes E,Ho A,Damani T,et al.Regulation of the heparan sulfate proteoglycan,perlecan,by injury and interleukin-1alpha[J].J Neurochem,1999,73(2):812-820.
[6]Leadbeater WE,Gonzalez AM,Logaras N,et al.Intracellular trafficking in neurones andglia of fibroblastgrowth factor-2,fibroblastgrowth factor receptor 1 and heparan sulphate proteoglycans in the injured adult rat cerebral cortex[J].J Neurochem,2006,96(4):1189-1200.
[7]Tran PK,Agardh HE,Tran-Lundmark K,et al.Reduced perlecan expression and accumulation in human carotid atherosclerotic lesions[J].Atherosclerosis,2007,190(2):264-270.
[8]Tran-Lundmark K,Tran PK,Paulsson-Berneg,et al.Heparan sulfate in perlecan promotes mouse atherosclerosis:roles in lipid permeability,lipid retention,and smooth muscle cell proliferation[J].Circ Res,2008,103(1):43-52.
[9]Ida-Yonemochi H,Ohshiro K,Swelam W,et al.Perlecan,a basement membrane-type heparan sulfate proteoglycan,in the enamel organ:its intraepithelial localization in the stellate reticulum[J].J Histochem Cytochem,2005,53(6):763-772.
[10]Iozzo RV,Zoeller JJ,Nystrom A.Basement membrane proteoglycans:modulators Par Excellence of cancergrowth and angiogenesis[J].Mol Cells,2009,27(5):503-513.
[11]Arikawa-Hirasawa E,Watanabe H,Takami H,et al.Perlecan is essential for cartilage and cephalicdevelopment[J].Natgenet,1999,23(3):354-358.
[12]Costell M,Gustafsson E,Aszodi A,et al.Perlecan maintains the integrity of cartilage and some basement membranes[J].J Cell Biol,1999,147(5):1109-1122.
[13]Ida-Yonemochi H,Satokata I,Ohshima H,et al.Morphogenetic roles of perlecan in the tooth enamel organ:an analysis of overexpression using transgenic mice[J].Matrix Biol,2011,30(7-8):379-388.
[14]Jung JY,Oh JH,Kim YK,et al.Acute UV irradiation increases heparan sulfate proteoglycan levels in human skin[J].J Korean Med Sci,2012,27(3):300-306.
[15]Jung M,Lord M,Cheng B,et al.Mast cells produce novel shorter forms of perlecan that contain endorepellin:rolein angiogensis and wound healing[J].J Biol Chem ,2013,288(5):3289-3304.
Experimental study of perlecan expression in ratdental pulp after injury
LI Qiao,LIU Chuan-tong,PAN Yi-huai
(Hospital of Stomatology,Wenzhou Medical University,Wenzhou 325027,China)
AIM:To investigate perlecan expression indental pulp of rats after injury.METHODS:Dental pulp injury models were established in maxillary first molars on one side of 48 SD rats,the isonym healthy teeth on the opposite side were used as the controls.1,3,5 and 7days after injury perlecan expression of thedental pulp was examined by immunohistochemistry and real-time PCR(n=12).Data were statistically analyzed by ANOVA.RESULTS:The average opticaldensity(AOD)of staining intensity of perlecan in the injureddental pulps was higher than that in the controls at all time points(F=9.511,P <0.05),1d after injury AOD of the injurygroup was the highest(P <0.05).The relative expression of perlecan mRNA(perlecan/β- actin)wasdecreased in the injurygroups(F=198.152,P <0.05)1d after pulp injury,andgradually increased in the followingdays,but lower than that in the controls(P <0.05).CONCLUSION:Perlecan may play an important role in tissuedefense mechanism afterdental pulp injury.
perlecan;immunohistochemistry;rat;dental pulp injury
R780.2
A
1005-2593(2014)01-0017-04
2013-07-10
浙江省教育厅科研计划项目(20051196)温州市科技计划项目(Y20100015)
李桥(1983-),男,汉族,浙江温州人。硕士,住院医师
潘乙怀,E-mail:773502228@qq.com
