血管发生在慢性牙周炎发展中的形态学初探
2014-02-02褚云娟刘玲侠王新文王勤涛
李 晶,褚云娟,叶 菁,王 萌,陈 芳,王 欣,刘玲侠,王新文,王勤涛
(第四军医大学口腔医院,陕西西安 710032)
血管发生在慢性牙周炎发展中的形态学初探
李 晶,褚云娟,叶 菁,王 萌,陈 芳,王 欣,刘玲侠,王新文,王勤涛
(第四军医大学口腔医院,陕西西安 710032)
目的:探讨血管发生在牙周炎症发展中的可能作用。方法:纳入慢性牙周炎患者及牙周组织健康者各15例,分别于翻瓣术和冠延长术中切取牙龈组织,采用SP免疫组化染色观察血管内皮生长因子(vascular endothelialgrowth factor,VEGF)、CD31 及基质细胞衍生因子 -1(Stromal cellderived factor-1,SDF-1)在慢性牙周炎牙龈组织中的表达情况;在×200镜下选10个视野计算阳性表达CD31的管腔数目作为血管密度(Microvesslesdensity,MVD);×400镜下选5个视野分别计算阳性表达SDF-1、VEGF的细胞数;组间比较用两样本均数(±s)t检验。结果:慢性牙周炎组牙龈组织中SDF-1、VEGF和MVD的表达量分别为135.42±15.58、83.53 ±7.00 和20.80 ±1.74,健康对照组分别为64.67 ±10.26、41.87 ±5.97 和12.26 ±2.51(组间比较P<0.05)。结论:慢性牙周炎牙龈组织中SDF-1、VEGF和MVD的表达升高,血管发生在牙周炎的进展中可能有促进作用。
慢性牙周炎;基质细胞衍生因子-1;血管内皮生长因子;血管密度
[牙体牙髓牙周病学杂志,2014,24(1):13]
[Chinese Journal of Conservativedentistry,2014,24(1):13]
慢性牙周炎是由厌氧菌感染造成的,以牙周袋形成、进行性附着丧失及牙槽骨破坏为特点的牙周组织慢性炎症性疾病[1]。炎症反应会使炎症牙周组织中的血管数量增多,而增多的血管又可以为炎症因子、粘附分子等的产生提供更多的底物,与牙周炎的进展密切相关[2]。炎症中以血管发生(angiogenesis)的方式形成新的血管[3],是指由已存在的血管通过血管内皮细胞出芽的方式形成新的血管,在创伤愈合、炎症性疾病及肿瘤的发展中均具有促进性作用[4]。炎症组织通过使炎症生长因子和细胞因子表达升高,参与调节血管发生反应[5];在这些因子中血管内皮生长因子(vascular endothelialgrowth factor,VEGF)是作用于血管内皮的最有力的因子[5]。研究显示[6],VEGF 可促进组织中血管网的扩张,并且在牙周炎的起始及进展阶段发挥重要作用。但血管发生是多种分子信号相互作用的复杂过程,如何客观评价不同状态下组织中血管发生的变化就显得至关重要。
另外一种在炎症发展中具有重要作用的因子是基质细胞衍生因子-1(stromal cellderived factor-1,SDF-1),它是一类新近发现的具有趋化活性的细胞因子,在介导炎症反应、造血干细胞迁移及归巢、恶性肿瘤的浸润转移以及HIV感染等方面均发挥着重要的作用。SDF-1不仅可以诱导单核/巨噬细胞的募集反应[7];还可与VEGF相互作用,进而影响炎症组织的血管发生过程[8]。目前,关于SDF-1在牙周炎发展过程中的作用及其与血管发生的关系尚不明确。
本实验拟通过免疫组化方法对比检测MVD、VEGF及SDF-1在健康和炎症牙周组织中的表达变化,探讨牙周炎症状况下血管发生的变化及SDF-1在其中的作用。
1 材料和方法
1.1 主要材料和试剂
SDF-1鼠抗人单克隆抗体(R&D公司,美国);VEGF兔抗人单克隆抗体、CD31兔抗人单克隆抗体(Epitomics公司,美国);SP免疫组化试剂盒(中杉公司);DAB显色剂(武汉博士德公司)。
1.2 受试对象的选择
1.2.1 受试对象
2012-11—2013-07 在我院牙周黏膜病科确诊的慢性牙周炎患者(美国牙周病学会1999年及Armitage[9]诊断标准),选取符合纳入、排除标准的患者15例(男12例,女3例,年龄35~76岁)作为实验组;同时选取需行冠延长术,且牙周组织健康者15例(男4例,女11例,年龄23~60岁)作为对照组。所有参试者均知情同意。
1.2.2 纳入标准
慢性牙周炎组:全口剩余牙≥20个(每个象限≥2个);拟取材牙临床探诊深度(PD)≥6 mm、临床附着丧失(CAL)≥5 mm、牙槽骨吸收>Ⅰ度。
健康对照组:无牙周病史及缺牙;拟取材牙无牙龈自发性出血、无BOP、所有位点的PD均<3 mm。
1.2.3 排除标准
患全身性疾病(如糖尿病和免疫功能异常等);就诊前3个月服用抗炎药物和抗肿瘤药物;口腔局部放射治疗者;吸烟和过度饮酒者;女性妊娠、哺乳期。
1.3 牙龈组织样本的采集和常规组织学观察
所有受试者均于龈上、下洁治术后两周进行组织样本采集。慢性牙周炎组于翻瓣术中,健康对照组于冠延长术中分别切取各受试者取材牙的颊(唇)或舌(腭)侧全层牙龈组织。所有组织样本经40g/L多聚甲醛固定后,常规脱水、石蜡包埋,制作厚3 μm的组织切片。然后每组各取3张切片,HE染色,常规组织学观察。
1.4 免疫组织化学染色观察
取各组组织切片(每个样本3张)用SP免疫组化试剂盒以SP法进行免疫组化染色:切片经二甲苯、梯度乙醇脱水后,高压抗原修复;分别滴加SDF-1、VEGF及CD31一抗;4℃过夜后滴加二抗,DAB显色,苏木精衬染。以PBS代替一抗作为阴性对照,毛细血管瘤组织作为阳性对照,光学显微镜下分别观察SDF-1、VEGF、CD31的表达情况。
血管密度(Microvesslesdensity,MVD)计数:先在低倍镜下选取CD31高表达部位,×200镜下从该部位随机选取不重复的10个视野,分别计数每个视野阳性表达CD31的血管数,取平均值作为该样本的MVD数值。
SDF-1及VEGF计数:低倍镜下选取 SDF-1、VEGF高表达部位,再在×400镜下从该部位随机选取不重复的5个视野,以细胞质出现黄色或棕黄色为阳性表达,分别计数每个视野中阳性表达细胞数,取平均值作为该样本的SDF-1或VEGF阳性表达数。
1.5 统计学分析
采用SPSS 16.0统计软件进行统计分析,组间比较用两样本均数±s)t检验,检验水准α=0.05(双侧)。
2 结果
2.1 常规组织学观察结果
HE染色结果显示,在健康牙龈组织中仅固有层有少量炎症细胞浸润(图1a);而在慢性牙周炎牙龈组织中,可见上皮钉突向结缔组织内增生并伸长,上皮下有大量炎症细胞浸润(图1b)。
2.2 免疫组化染色结果
CD31主要表达于固有层(图2a、b);VEGF主要表达于血管内皮细胞、间质细胞及炎症细胞(图2c、d);SDF-1主要表达于血管内皮细胞、炎症细胞及沟内上皮细胞(图2e、f、g);3种指标均显示在炎症浸润广泛部位表达明显增强,且牙周炎组表达明显多于健康对照组。
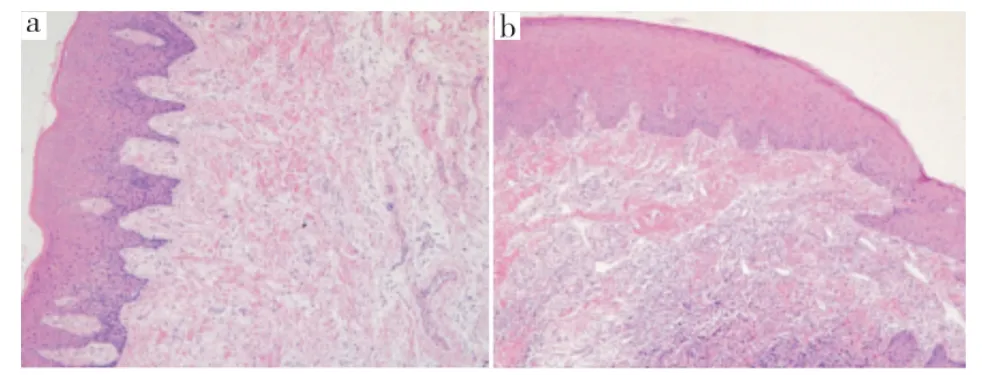
图1 不同来源牙龈组织HE染色(×100)

图2 不同来源牙龈组织免疫组化染色观察
2.3 两组 MVD、VEGF、SDF-1 表达水平比较
阳性细胞计数结果显示,慢性牙周炎牙龈组织中MVD、VEGF、SDF-1各因子的表达水平均明显高于健康对照组,差异均有统计学意义(P<0.05)(表1)。
表1 两组VEGF、SDF-1和MVD的表达水平比较(±s)
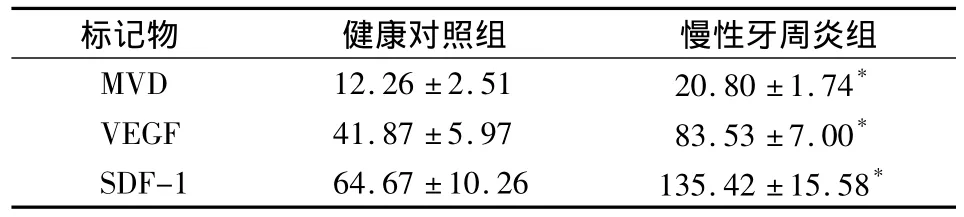
表1 两组VEGF、SDF-1和MVD的表达水平比较(±s)
*与对照组相比P<0.05
标记物 健康对照组 慢性牙周炎组MVD 12.26 ±2.51 20.80 ±1.74*VEGF 41.87 ±5.97 83.53 ±7.00*SDF-1 64.67 ±10.26 135.42 ±15.58*
3 讨论
慢性牙周炎主要是由龈下菌斑中的致病菌引起的慢性炎症性疾病,使牙龈组织常同时处于损伤与修复状态,并有多种炎症反应及趋化因子产物参与其中[10]。血管发生作为一种重要的病理变化,参与炎症状况下牙周组织的反应过程。血管发生,即在已存在的微血管上形成新生血管,其过程对组织再生及炎症性病理反应均具有重要的意义[11]。Bullon P等研究显示[12],在炎症牙周结缔组织中血管有量及质上的变化,主要表现为血管密度的升高和血管直径的增大,使炎症的反应和严重程度增加;另有研究显示,炎症状态下血管基底膜显著增厚,尤其表现于毛细血管和小静脉[13]。本研究以MVD计数方法评价牙龈组织中血管发生的状态,结果也显示慢性牙周炎中牙龈组织中的MVD数明显高于健康对照组,差异具有统计学意义。综合以上研究提示,血管发生可作为牙周炎症程度的评估指标之一。
Chapple等[14]报道,牙周炎时其牙周袋底上皮血管发生的平衡状况发生紊乱,并证明该现象是由VEGF的表达改变造成。正常组织中VEGF的表达水平较低,其作用主要是维持血管的正常功能、血管密度以及血管运送营养物质所必需的通透性;但在一些病理情况下,如在炎症和肿瘤时,则可出现VEGF的过量表达。有研究显示,VEGF可能是牙周炎早期阶段的重要病因因子,并参与牙龈炎向牙周炎的发展过程[2]。本结果显示,牙周炎牙龈组织中的VEGF表达水平明显高于对照组(P<0.05),且主要表达于血管内皮细胞和炎症细胞,提示VEGF可能同时影响血管发生和炎症的聚集,从而促进牙周炎症的发展。牙周炎中VEGF表达的上升可以提高新血管的形成和血管的通透性,可作为牙周炎严重程度的一个标志分子。
SDF-1(又名 CXCL12)是CXC趋化因子家族成员之一,可与CXC趋化因子受体-4(CXCR4)相结合而在调节免疫和炎症反应、调控造血、恶性肿瘤细胞的浸润转移、血管生成等方面发挥着重要作用。研究表明,SDF-1在运输淋巴细胞、造血干细胞及内皮祖细胞的过程中均起着关键性作用[15]。Hosokawa 等[16]报道,SDF-1 和 CXCR4 在正常的牙龈组织中均有表达,且主要表达于成纤维细胞、上皮细胞及单核细胞。Havens等[17]发现,SDF-1α的水平与牙周组织炎症状况相关,其在牙周炎牙龈组织及其龈沟液中的表达水平明显高于正常组织。Herna'ndez M等[18]报道,接种Pg小鼠的牙周组织中SDF-1α的表达明显升高,表明SDF-1的过表达可能与牙周炎的发病机制相关。本结果显示,SDF-1在炎症牙龈组织中的表达水平明显高于正常对照组(P<0.05),且主要表达于所有内皮细胞以及固有层炎症浸润处的淋巴细胞,表明SDF-1可能在促进牙周炎时炎症细胞聚集及血管发生中具有重要作用。
内皮细胞不仅可合成并分泌 SDF-1,又是SDF-1/CXCR4轴实现其特有功能的平台,因此SDF-1在内皮细胞形成血管的过程中起着重要作用。有研究表明,血管异常增殖及缺氧缺血是诱导VEGF高表达的重要因素,缺氧因子既能诱导VEGF高表达,也能促使 SDF-1的表达增高[19]。Salvucci[20]在对微血管的发生及形成的研究中也证实了这种相关性:VEGF以及碱性成纤维细胞生长因子(bFGF)能够促进内皮细胞表达SDF-1;当阻断SDF-1/CXCR4的功能时,则可抑制血管生长因子依赖的血管形成作用。另有研究也发现,SDF-1反之能诱导 VEGF高表达,并促进 VEGF分泌[21]。可见,SDF-1与VEGF之间能够相互影响,从而对各自生物学功能起促进作用。本结果也表明,SDF-1和VEGF可能是介导慢性牙周炎发生及进展中的重要因子,并通过影响炎症反应中的血管发生而发挥作用,但其具体机制尚需进一步的探讨。
[1]Loesche WJ,Gusberti F,Mettrauxg,et al.Relationship between oxygen tension and subgingival bacterial flora in untreated human periodontal pockets[J].Infect Immun,1983,42(2):659-667.
[2]Johnson RB,Serio FG,Dai X.Vascular endothelialgrowth factors and progression of periodontaldiseases[J].J Periodontol,1999,70(8):848-852.
[3]Yoshino H,Morita I,Murota S,et al.Mechanical stress induces production of angiogenic regulators in cultured humangingival and periodontal ligament fibroblasts[J].J Periodontal Res,2003,38(4):405-410.
[4]Folkman J.Angiogenesis in cancer,vascular,rheumatoid and otherdisease[J].Nat Med,1995,1(1):27 -30.
[5]ünlü F,Güneri PG,Hekimgil M,et al.Expression of vascular endothelialgrowth factor in human periodontal tissues:Comparison of healthy anddiabetic patients[J].J Periodontol,2003,74(2):181-187.
[6]Suthin K,Matsushita K,Machigashira M,et al.Enhanced expression of vascular endothelialgrowth factor by periodontal pathogens ingingival fibroblasts[J].J Periodontal Res,2003,38(1):90-96.
[7]Wright LM,Maloney W,Yu X,et al.Stromal cell-derived factor-1 binding to its chemokine receptor CXCR4 on precursor cells promotes the chemotactic recruitment,development and survival of human osteoclasts[J].Bone 2005,36(5):840 -853.
[8]Kanda S,Mochizuki Y,Kanetake H.Stromal cell-derived factor-1alpha induces tube-like structure formation of endothelial cells through phosphoinositide 3-kinase[J].J Biol Chem,2003,278(1):257 -262.
[9]ArmitagegC.Development of a classification system for periodontaldiseases and conditions[J].Ann Periodontol,1999,4(1):1-6.
[10]Buduneli N,Buduneli E,Cinar S,et al.Immunohistochemical evaluation of Ki-67 expression and apoptosis in cyclosporin A-inducedgingival over-growth[J].J Periodontol,2007,78(2):282-289.
[11]Battino M,Bompadre S,Politi A,et al.Antioxidant status(CoQ10 and Vit.E levels)and immunohistochemical analysis of soft tissues in periodontaldiseases[J].Biofactors,2005,25(1-4):213-217.
[12]Bullon P,Fioroni M,Goterig,et al.Immunohistochemical analysis of soft tissues in im-plants with healthy and peri-implantitis condition,and aggressive periodontitis[J].Clin Oral Implants Res,2004,15(5):553 -559.
[13]Pinchback JS,Taylor BA,Gibbins JR,et al.Microvascular angiopathy in advanced periodontaldisease[J].J Pathol,1996,179(2):204-209.
[14]Chapple CC,Kumar RK,Hunter N.Vascular remodel-ling in chronic inflammatory periodontaldisease[J].J Oral Pathol Med 2000,29(10):500 -506.
[15]Stellos K,Gawaz M.Platelet interaction with progenitor cells:potential implications for regenerative medicine[J].Thromb Haemost,2007,98(5):922 -929.
[16]Hosokawa Y,Hosokawa I,Ozaki K et al.CXCL12 and CXCR4 expression by humangingival fibroblasts in periodon taldisease[J].Clin Exp Immunol,2005,141(3):467 -474.
[17]Havens AM,Chiu E,Taba M,et al.Stromal-derived factor-1 alpha(CXCL12)levels Increase in periodontaldisease[J].J Periodontol,2008,79(5):845 -853.
[18]Herna'ndez M,Gamonal J,Salo T,et al.Reduced expression of lipopolysaccharide-induced CXC chemokine in Porphyromonasgingivalis-induced experimental periodontitis in matrix metalloproteinase-8 null mice[J].J Periodont Res,2011,46(1):58-66.
[19]Hitchon C,Wong K,Mag.Hypoxia-induced production of stromal cell-derived factor-1(CXCL12)and vascular endothelialgrowth factor by synovial fibroblasts[J].Arthritis Rheum,2002,46(10):2587-2597.
[20]Salvucci O,Yao L,Villalba S,et al.Regulation of endothelial cell branching morphogenesis by endogenous chemokine stromal-derived factor-1[J].Blood 2002,99(8):2703 -2711.
[21]Kijowski J,Baj-Krzyworzeka M,Majka M,et al.The SDF-1-CXCR4 axis stimulates VEGF secretion and activates integrins butdoes not affect proliferation and survival in lymphohematopoietic cells[J].Stem Cells,2001,19(5):453 -466.
Angiogenesis in Chronic Periodontitis
LI Jing,CHU Yun-juan,YE Jing,WANG Meng,CHEN Fang,WANG Xin,LIU Ling-xia,WANG Xin-wen,WANG Qin-tao
(School of Stomatology,The Fourth Military Medical University,Xi'an 710032,China)
AIM:To investigate the expression of stromal cellderived factor-1(SDF-1),vascular endothelialgrowth factor(VEGF)and CD31 in periodontal tissues with chronic periodontitis.METHODS:15 patients with chronic periodontitis and 15 periodontally healthy individuals were included.Thegingival tissues of the subjects were resected and immunohistochemically stained.The CD31 positive lumen was counted as microvesslesdensity(MVD)under 200 magnification in 10 fields.The SDF-1and VEGF positive cells were counted under 400 magnification in 5 fields.T - test was used to analyze thedata.RESULTS:The SDF-1,VEGF and MVD positive counts in chronic periodontal tissues were 135.42 ±15.58,83.53 ±7.00 and 20.80 ±1.74,in healthy periodontal tissues 64.67 ±10.26,41.87 ±5.97 and 12.26 ±2.51,respectively(P <0.01 betweengroups).CONCLUSION:Angiogenesis may play a positive role in thedevelopment of periodontitis.
chronic periodontitis;stromal cellderived factor-1(SDF-1);vascular endothelialgrowth factor(VEGF);microvesslesdensity(MVD)
R780.2
A
1005-2593(2014)01-0013-05
2013-08-31
国家自然科学基金项目资助(81271137)
李晶(1988-),女,汉族,河北邯郸人。硕士生(导师:王勤涛)
王勤涛,E -mail:yznmbk@fmmu.edu.cn
