南瓜皮粗多糖对小鼠抗疲劳功效研究
2014-01-30李贵节
王 强,龙 洁,李贵节,王 存
(1.重庆第二师范学院生物与化学工程系,重庆 400067;2.重庆第二师范学院教务处,重庆 400067)
南瓜(Cucurbita moschata Duch.)属于葫芦科(Cucurbitaceae)南瓜属(Cucurbita)的一年生蔓生草本植物,是一种重要的蔬菜作物,其富含氨基酸、维生素、胡萝卜素、矿物质、脂肪酸和色素等生物活性成分,并且钠含量较低,是一种优质的功效成分提取资源[1-4]。中医认为,南瓜味苦、性寒,可消炎、止痛、强肝、助肾、降低血压、为产妇催奶、补中益气。国内外研究表明[5-6],南瓜对糖尿病、特别是Ⅱ型糖尿病具有显著的疗效,并可预防由糖尿病引起的肾病、肝病、高血脂和高血压等疾病的发生,这使南瓜作为一种特效营养保健食品备受人们的重视。现代医学和营养学的研究表明南瓜中的活性多糖具有调节机体血糖水平等功能[7-8],已成为当前医药和食品领域研究与开发的热点。此外,包晓玮等[9]研究发现,南瓜多糖能提高小鼠免疫器官质量、巨噬细胞的吞噬功能,揭示南瓜多糖具有免疫调节作用。王传栋等[10]探讨南瓜多糖体内体外的抗肿瘤作用以及对红细胞免疫功能的影响,结果显示南瓜多糖可增强红细胞免疫吸附能力,具有一定的抗肿瘤及提高免疫活性的作用。
南瓜皮,作为南瓜深加工过程中产生的废弃物,富含多糖和果胶等功能成分。我国每年利用的南瓜籽数千吨,但对南瓜皮资源的利用十分有限[11-13]。若将这些废弃的南瓜皮作为生产多糖的原料,将会产生大量的优质南瓜皮粗多糖(pumpkin peel polysaccharides,PPPs)[14-16]。因此,本实验研究PPPs对小鼠抗疲劳能力的影响,以丰富PPPs在提高机体抗疲劳能力方面的证据,为PPPs的抗疲劳研究及其相关产品的应用开发提供参考。
1 材料与方法
1.1 材料与仪器
南瓜:新鲜,无病虫害,购于市场;SPF级小鼠(许可证号:SCXK(渝)2007-0002)50 只,体质量18~22 g,由第三军医大学提供。
D-半乳糖 美国Sigma-Aldrich公司;血尿素氮(blood urea nitrogen,BUN)试剂盒、血乳酸(blood lactic acid,BLA)试剂盒、肝糖原(hepatic glycogen,HG)试剂盒、肌糖原(muscle glycogen,MG)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、血乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒 南京建成生物工程研究所;其他试剂均为国产分析纯;所用水为双蒸水,所用其他溶液均自行配制。
DHG-9240A电热恒温鼓风干燥箱、DK-8D三孔电热恒温水槽 上海齐欣科学仪器有限公司;超声波 宁波新芝生物科技有限责任公司;UV-2450紫外-可见分光光度计 日本岛津公司;冷冻离心机 美国贝克曼公司;LSC真空冷冻干燥机 德国Martin Christ公司。
1.2 方法
1.2.1 PPPs的制备
选择成熟的南瓜作为原料,将原料清洗、削皮;将南瓜皮干燥(65℃)至水分含量8%;粉碎机粉碎,过60目筛。用95%的乙醇40℃热处理1 h,再重复1次,以除去单糖、低聚糖和色素等小分子物质,同时灭酶活以防止在提取过程中多糖的降解。抽滤、浓缩、干燥,得到预处理原料。预处理后的南瓜皮粉于95℃热水提取两次(料液比为25∶1(m/V),2 h/次)→离心(3 000 r/min、10 min)→合并上清液→95%乙醇、100%乙醇、丙酮分别处理,4℃放置24 h→离心(3 000 r/min、10 min)→溶解,Sevag方法脱蛋白[17](8次)→透析→冷冻干燥→PPPs。
1.2.2 实验动物条件和分组
实验小鼠饲养条件为:温度18~22℃、相对湿度45%~55%,自然光照,自由采食和饮水。实验前将50只小鼠在实验环境下给予基础饲料饲养1周,按体质量随机分成5 组(雌雄各半,每组小鼠平均体质量相差<2 g),分别是正常对照组(CN)、衰老模型对照组(DC)、多糖低、中、高剂量组(PPPs-L、PPPs-M、PPPs-H)。CN组腹腔注射100 mg/(kg·d)生理盐水,其余4 组腹腔注射100 mg/(kg·d)D-半乳糖,实验周期60 d。从实验第41天开始,CN和DC组灌胃蒸馏水,多糖低、中和高剂量组腹腔注射D-半乳糖的同时灌胃125、250、500 mg/(kg·d)剂量的PPPs,连续给药20 d。各组给予基础饲料和自由饮水。
1.2.3 力竭游泳实验
末次给药30 min后,给予小鼠尾部负重相当于自重5%的铅丝,将各组小鼠分别放入10个恒温水池箱,水深(20±5) cm、水温(25±1)℃,进行力竭游泳实验。放入后立即计时,观察小鼠游泳情况,并适时用玻璃棒拨动小鼠使其始终处于运动状态。小鼠自开始到沉于水面下8 s后不能浮出水面的时间作为力竭游泳时间(min)。
1.2.4 测试样品的制备和检测
力竭游泳实验后,断头取血致死,收集血液,4 000 r/min离心10 min,上清液备用。所有处理均在4℃条件下完成。
用BUN、BLA、HG、MG、MDA和SOD及LDH试剂盒结合紫外-可见分光光度计分别测定。
1.3 数据分析
采用SPSS 15数据处理软件,各组数据结果均以±s(n=10)表示,并进行方差分析,LSD法多重比较,P<0.05为差异具有显著性。
2 结果与分析
2.1 PPPs对衰老小鼠力竭游泳时间的影响
疲劳是一种常见的生理现象,其过程为过度劳动或运动引起机体生理生化功能改变而导致机体劳动或运动能力的暂时降低,实际上疲劳是防止机体发生机能衰竭而产生的一种保护性反应。疲劳可以导致精神不振、注意力不集中、抵抗力下降等一系列后果,严重影响工作效率或运动成绩,故研究延缓或消除疲劳的措施具有十分重要的意义[18-19]。
D-半乳糖衰老模型在国内外被广泛用于衰老机理研究和抗疲劳药物的药效学评价[20]。PPPs对衰老小鼠游泳时间的影响见图1。正常对照组和不同多糖剂量组小鼠力竭游泳时间均高于衰老模型组,PPPs-L组与衰老模型对照组差异不显著(P>0.05),其余均达到显著水平(P<0.05);并且衰老小鼠力竭游泳时间与多糖剂量成正相关,而且PPPs-M和PPPs-H组的小鼠力竭游泳时间均高于正常对照组,其中,PPPs-H组比正常对照组提高了21.6%(P<0.05)。结果说明南瓜皮多糖可显著提高衰老小鼠的运动能力,延缓疲劳的发生。
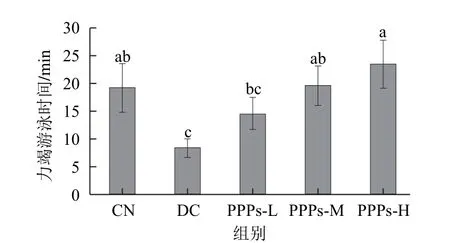
图1 PPPs对衰老小鼠力竭游泳时间的影响Fig.1 Effect of PPPs on exhaustive swimming time in aged mice
2.2 PPPs对衰老小鼠相关生理指标的影响
能量物质的消耗、代谢物质的堆积是产生疲劳的重要原因[21]。常用的疲劳的评价方法主要有两个:运动耐力实验和生化指标的检测。在反映疲劳的生化指标中,血尿素氮(BUN)、血乳酸(BLA)和糖原等生化指标的改变最具代表性,也是检测疲劳最常用的指标[22]。当糖原被大量消耗时,机体活动能力降低,从而导致全身性疲劳的发生。糖原贮备的提高有利于机体耐力速度的提高,并减少蛋白质和含氮化合物的分解代谢。

表1 PPPs对衰老小鼠的相关生理指标影响Table1 Effect of PPs on physiological indexes in aged mice
由表1可知,不同多糖剂量组小鼠BUN和BLA含量均显著低于衰老模型对照组(P<0.05),PPPs低、中和高剂量组BUN含量分别比衰老模型对照组降低了10.3%、15.9%和23.9%,呈显著差异(P<0.05),并且PPPs中和高剂量组对BUN含量的降低效果与正常对照组相比没有显著差异(P>0.05);PPPs低、中、高剂量组BLA含量分别比衰老模型对照组降低了18.7%、22.4%、33.8%,呈显著差异(P<0.05),并且PPPs低、中、高剂量组对BLA含量的降低效果与正常对照组相比没有显著差异(P>0.05)。由表1还可以看出,低、中、高3个剂量组的肝糖原和肌糖原含量均高于正常对照组;其中,与正常对照组相比,中、高剂量组肝糖原和肌糖原的含量均显著性增加,说明PPPs可以增加糖原的储备,为机体提供能量,延缓疲劳产生。国内外研究发现,机体疲劳时,会发生相应的生化改变,包括糖原储备量降低、血尿素氮和血乳酸水平升高等[21-22]。体内的糖原是运动时能量的来源,糖原储备充足,供应的能量就多,抗疲劳能力就强。因此糖原的含量能说明疲劳发生的快慢或程度,当机体剧烈运动时细胞相对缺氧,糖酵解加快、产生大量乳酸,清除肌肉中过多的乳酸,可延缓和消除疲劳[23]。此外,机体剧烈运动时,蛋白质及氨基酸的分解代谢增强,氨基酸会代谢转化生成尿素进入血液,使血尿素含量增加,与血乳酸一样,血尿素氮也是疲劳时肌肉酸痛的主要原因[19,24]。

表2 PPPs对衰老小鼠MDA含量、SOD及LDH活力的影响Table2 Effect of PPs on the contents of MDA, SOD and LDH in the blood of aged mice
表2显示PPPs对衰老小鼠的脂质过氧化水平(丙二醛)和血清抗氧化状态的影响,PPPs低、中和高剂量组与衰老模型对照组相比,血清MDA含量分别降低了10.3%、19.3%和27.7%,并且PPPs中和高剂量组对MDA含量的降低效果与正常对照组相比没有显著差异(P>0.05)。与衰老模型对照组相比,PPPs低、中和高剂量组的血清SOD活性显著提高(P<0.05),PPPs高剂量组的血清SOD活性与正常对照组相比没有显著差异。表2中的结果还表明,与衰老模型对照组相比,PPPs低、中和高剂量组的血LDH活性显著提高(P<0.05),并且PPPs中、高剂量组的血LDH活性与正常对照组相比显著提高。本实验结果表明,PPPs具有良好的体内抗氧化活性,可显著提高体内抗氧化系统酶活力,增强体内抗氧化防护能力,清除体内氧自由基,防止细胞膜脂质过氧化,有效预防动物细胞自由基损伤,可能是其具有抗疲劳作用的主要机制所在。
本实验结果表明,南瓜皮粗多糖具有良好的体内抗氧化活性和抑制脂质过氧化能力,可显著提高体内抗氧化系统酶活力,增强体内抗氧化防护能力,清除体内氧自由基,防止细胞膜脂质过氧化,有效预防动物细胞自由基损伤,可能是其具有抗疲劳作用的主要机制所在。
3 结 论
疲劳是由运动引起机体一系列生化改变而导致的肌肉力量的降低。评价疲劳的方法包括耐力实验和生化指标的检测。通过小鼠耐力实验不难发现,PPPs-H高剂量组比正常对照组运动耐力时间延迟了21.6%(P<0.05)。不仅如此,PPPs-H组还有效增加了衰老小鼠SOD及LDH活性,显著降低小鼠剧烈运动后血尿素氮、血乳酸和MDA含量,显示出PPPs-H具有延长小鼠运动耐力的作用。
此外,长时间运动后,机体为维持血糖水平,肝糖原会下降,因此糖原含量也是检测抗疲劳作用的重要指标之一。本实验证实,PPPs高、中、低3个剂量组的肝糖原和肌糖原含量均高于正常对照组;其中,与正常对照组相比,PPPs中、高剂量组肝糖原和肌糖原的含量均显著性增加(P<0.05),说明PPPs可以增加糖原的储备,为肌体提供能量,延缓疲劳产生。尽管南瓜皮粗多糖能够提高小鼠的运动能力,显著改善了脂质过氧化水平和血清抗氧化状态,但有关其具体的抗疲劳机理以及构效关系仍需进一步研究。
[1]AKWAOWO E U, NDON B A, ETUK E U.Minerals and antinutrients in fluted pumpkin (Telfairia occidentalis Hook f.)[J].Food Chemistry,2000, 70(2): 235-240.
[2]王丽波, 徐雅琴.南瓜籽油的水酶法提取工艺及产品的理化性质[J].农业工程学报, 2011, 27(10): 383-387.
[3]LONGE O G, FARINU G O, FETUGA B L.Nutritional value of the fluted pumpkin (Telfaria occidentalis)[J].Journal of Agricultural and Food Chemistry, 1983, 31(5): 989-992.
[4]范文秀, 李新峥, 荆瑞俊.南瓜中微量元素测定的研究[J].光谱学与光谱分析, 2006, 26(3): 567-570.
[5]ADAMSA G G, IMRANA S, WANG S, et al.The hypoglycaemic effect of pumpkins as anti-diabetic and functional medicines[J].Food Research International, 2011, 44(4): 862-867.
[6]CAILI F, HAIJUN T, TONGYI C, et al.Some properties of an acidic protein-bound polysaccharide from the fruit of pumpkin[J].Food Chemistry, 2007, 100(3): 944-947.
[7]ZHANG Y, YAO H.Study on effect of hypoglycemia of different type pumpkin[J].Journal of Chinese Food Science, 2002, 23: 118-120.
[8]朱红艳, 孟国良.PPARγ与胰岛素抵抗及其南瓜多糖干预研究[J].时珍国医国药, 2013(2): 369-370.
[9]包晓玮, 李凤鸣, 韩海霞, 等.南瓜及刺山柑多糖对小鼠免疫功能的影响[J].新疆农业科学, 2010, 47(3): 508-511.
[10]王传栋, 蓝天, 郭效东, 等.南瓜多糖抑瘤及增强红细胞免疫吸附作用研究[J].中国当代医药, 2012(4): 17-18.
[11]付莉.南瓜皮类胡萝卜素的提取工艺研究[J].中国农学通报, 2012,28(36): 295-299.
[12]张忠, 郑小义, 毕阳, 等.南瓜皮提取物的体外抑菌活性[J].食品工业科技, 2012, 33(8): 128-131.
[13]付莉, 王丽颖, 顾英.南瓜皮黄色素的提取工艺及其抗氧化性的研究[J].食品工业科技, 2011, 32(1): 238-239.
[14]白娣斯, 马冬.南瓜皮多糖PP1的提纯、组分分析及原子力显微镜技术观测研究[J].食品科学, 2012, 33(9): 122-126.
[15]王丽波, 赵玉, 徐雅琴.南瓜多糖大孔吸附树脂纯化工艺[J].农业机械学报, 2010(9): 138-142.
[16]陈立江, 王永杰, 刘宇, 等.星点设计-效应面法优选南瓜多糖提取工艺[J].食品科学, 2013, 34(8): 107-112.
[17]SEVAG M G, LACKMAN D B, SMOLENS J.The isolation of components of streptococcal nucleoproteins in serologically active form[J].Journal of Biological Chemistry, 1938, 124(2): 425-436.
[18]TAN Wei, YU Keqiang, LIU Yanyan, et al.Anti-fatigue activity of polysaccharides extract from Radix Rehmanniae Preparata[J].International Journal of Biological Macromolecules, 2012, 50: 59-62.
[19]WANG Jia, LI Shanshan, FAN Yuying, et al.Anti-fatigue activity of the water-soluble polysaccharides isolated from Panax ginseng C.A.Meyer[J].Journal of Ethnopharmacology, 2010, 130: 421-423.
[20]SUN Yangying, PAN Daodong, GUO Ying.Purification of chicken breast protein hydrolysate and analysis of its antioxidant activity[J].Food and Chemical Toxicology, 2012, 50: 3397-3404.
[21]杨晓杰, 付学鹏, 刘泽东.蒲公英多糖抗疲劳作用研究[J].时珍国医国药, 2008, 19(11): 2686-2687.
[22]李莉, 赵效国, 马龙, 等.黑加仑提取物抗疲劳作用的动物实验研究[J].营养学报, 2008, 30(5): 499-501.
[23]IVY J L.Musel glycogen synthesis before and after exercise[J].Sports Medicine, 1991, 11(1): 6-19.
[24]郑素玲, 郭立英, 范永山.杏鲍菇多糖对老龄小鼠抗疲劳能力的影响[J].食品科学, 2010, 31(7): 269-271.
