黑果枸杞种子萌发对水分和钠盐胁迫的响应
2014-01-22刘克彪张元恺李发明
刘克彪,张元恺,李发明
(甘肃省治沙研究所 a.甘肃沙生植物工程技术研究中心,甘肃 兰州 730070;b.甘肃省荒漠化与风沙灾害防治国家重点实验室,甘肃 武威 733000;c.甘肃民勤荒漠草地生态系统国家野外科学观测研究站,甘肃 武威 733000)
黑果枸杞Lycium ruthenicumMurr.为茄科枸杞属落叶小灌木,在我国主要分布于青海、宁夏、甘肃、新疆、西藏等省区,在中亚、高加索和欧洲亦有分布。成熟浆果呈紫黑色、球形,无毒而有甜味,晒制成的干果含蛋白质10.61%、脂肪6.6%、多糖4.28%、总黄酮4.29%、原花青素3.42%,是迄今为止发现的原花青素含量最高的野生植物之一,其氨基酸和矿物质含量丰富,属高钾低钠食品,具有较高的营养价值和药用价值,极具市场开发利用前景[1]。黑果枸杞在甘肃河西走廊89.38万hm2盐渍化和次生盐渍化土壤上有大量的分布[2],生于硫酸盐盐渍化土壤上,常与盐爪爪Kalidium foliatumMoq.和骆驼刺Alhagi sparsifoliaShap.构成黑果枸杞盐生-旱生植物群落[3]。人工大量采摘黑果枸杞果实,使其野生资源遭到相当程度的破坏。有关黑果枸杞种子育苗的研究报道较多:苗增建[4]研究了基质对其种子发芽及不同移栽方式对其幼苗生长的影响情况,刘荣丽等人[5]研究了几种生长调节剂对黑果枸杞种子萌发及幼苗生长的影响情况,陈海魁等人[6]研究了不同浓度NaCl胁迫对黑果枸杞种子萌发的影响情况,姜霞等人[7]研究了黑果枸杞的耐盐机理,杨志江等人[8]研究了3种钠盐胁迫对黑果枸杞种子萌发的影响情况。但是,至今尚未见到有关黑果枸杞在硫酸盐盐渍化土壤上实生苗天然更新的研究报道。为此,本试验模拟硫酸盐盐渍化土壤溶液渗透势和阴离子组成,探索了土壤水分和盐分胁迫对黑果枸杞种子萌发的影响情况,以期为人工辅助盐碱地黑果枸杞林天然更新提供理论数据和界限,这对建立和恢复以黑果枸杞为主的盐生-旱生植物群落,发展黑果枸杞经济林,改善地区生态环境,具有一定意义。
1 材料和方法
1.1 试验材料与仪器药品
参试种子来源于民勤治沙站2年生人工黑果枸杞林,采种时间为2013年8~9月。种子千粒质量为0.93g,其净度为100%。
试验仪器:RQX-400人工气候箱、Psypro植物水势仪、三申YM系列N型立式压力蒸汽灭菌器、FA2004N电子天平、Eppendorf移液枪和发芽皿、滴管、量筒、滤纸等物。
试验药品:溶质为聚乙二醇(PEG)-6000、NaCl、Na2SO4、NaHCO3、H2SO4(98%)、KMnO4,溶剂为蒸馏水。
1.2 试验时间与地点
试验时间:2013年11月10~30日,2014年2月27日~3月21日。
试验地点:甘肃省荒漠化与风沙灾害防治国家重点实验室。
1.3 试验设计
4种钠盐以0.2%、PEG-6000以5%(溶质质量/溶液质量)为起始浓度和梯度,以种子发芽率大于20%的溶液浓度为终止浓度,以蒸馏水作为对照(CK),药品的配制浓度详见表1。用Psypro水势仪测定不同浓度PEC溶液的渗透势,PEC溶液浓度分别设为5%、10%、15%、20%、25%、30%、35%、40%,其相应渗透势分别为-0.05、-0.15、-0.28、-0.44、-0.77、-0.94、-1.26、-1.53MPa。

表1 药品的配制浓度†Table 1 Preparation concentrations of drugs
1.4 种子的催芽和消毒处理
用H2SO4(98%)浸泡种子3min,用蒸馏水清洗至水无色[10],然后用5%的KMnO4溶液消毒10min,清洗后再用40℃的蒸馏水浸泡24h[11]以待用。
1.5 发芽皿的消毒处理
在清洗后的发芽皿中铺 2层滤纸,将其放入立式压力蒸气灭菌器内,于120℃下消毒1.5h后取出待用。
1.6 溶液的配制
用FA2004N电子天平按表1的配比配制试验用的溶液200mL。
1.7 试验处理与试验方法
在每个消毒过的发芽皿内滤纸上置入用滤纸吸干了表面水分的种子50粒,滴入各种不同浓度的溶液4mL,共设47个试验处理,每个处理重复3次,共计141个处理标本。 将试验标本放入RQX-400人工气候箱中,设定温度为25℃,相对湿度为60%,光照条件设为全暗。每天观测标本时用Eppendorf移液枪加蒸馏水0.6mL,保持滤纸湿润,不积水。
1.8 观测指标与计算方法
于每天下午15:00时开始观测并记录黑果枸杞种子的发芽情况。其发芽始期,以胚根伸出种皮2mm 时的天数计算;发芽高峰期,以发芽粒数>2粒的天数计算;其发芽结束期,以连续3天不再有种子发芽的天数计算。发芽率等指标的计算公式分别如下:
发芽率F=n/N×100%(n为正常发芽粒数,N为供试种子数);
发芽势Fs=n1/N×100%(n1为种子发芽达到高峰即发芽数>2粒时的正常发芽种子数);
萌发抗旱指数RI=干旱胁迫下发芽数/CK发芽数;
发芽指数GI=Nt/Dt(Nt即为t日后的发芽数,Dt为相应的发芽天数);
平均发芽时间T=Σ(hn2)/Σn1(h为从播种之日算起的天数,n1为相应各日正常发芽的粒数);
相对盐害率Rd=(CK发芽率-盐溶液处理的发芽率)/CK发芽率×100。
1.9 数据处理
采用Excel进行数据处理并制图。
2 结果与分析
2.1 黑果枸杞种子萌发对水分胁迫的响应
2.1.1 黑果枸杞种子发芽率和发芽势对水分胁迫的响应
用PEG溶液处理黑果枸杞种子,随着溶液浓度逐渐增加,渗透势相应减小,水分胁迫程度增加,种子发芽始期、发芽高峰期、发芽末期均逐步延迟1~3d[12],说明水分胁迫对种子萌发具有一定的延缓作用[13]。不同浓度PEG溶液处理后种子的发芽率与发芽势如图1 所示。由图1 可知,随着PEG溶液渗透势的逐渐降低,种子发芽率与发芽势均有明显的下降趋势,当溶液渗透势为-0.94MPa时,其发芽率与发芽势比CK分别降低62%和59%,均超过50%;当渗透势为-1.26MPa时,发芽率与发芽势的下降幅度均增大,分别只有CK的42%和32%;当渗透势达到-1.53MPa时,发芽率与发芽势分别为CK的24%和15%。这一结果说明,随着溶液水分胁迫程度的增大,其对种子发芽表现出抑制作用,特别是当渗透势低于-0.94MPa后抑制作用明显增强[14]。根据图1建立了PEG溶液渗透势和种子发芽率的线性回归方程,分析得到的相关系数与种子萌发PEG溶液渗透势的适宜值(发芽率>80%)、临界值(发芽率>50%)、极限值(发芽率>20%)见表2[15]。

图1 不同浓度PEG溶液处理后种子的发芽率与发芽势Fig.1 Seed germination rates and germination potentials in different PEG solution treatments
2.1.2 黑果枸杞种子萌发抗旱指数、发芽指数和平均发芽时间对水分胁迫的响应
不同浓度PEG溶液处理后种子的萌发抗旱指数与发芽指数及平均发芽时间分别见图2~4。图2表明,不同浓度PEG溶液处理的黑果枸杞种子,其萌发抗旱指数随着PEG溶液渗透势的降低而降低:当渗透势为-0.05~-0.94 Mpa时,其萌发抗旱指数几乎以10%的比例下降;当其渗透势为-0.94~-1.53 Mpa时,其萌发抗旱指数则以大约35%的比例降低。图3表明,随着PEG溶液浓度的升高、渗透势的降低,种子发芽指数的降低趋势明显:当渗透势为-0.05MPa时,发芽指数为CK的61%;当渗透势为-0.44~-0.77MPa时,发芽指数几乎不变,为CK 的50%;当渗透势为-1.26 Mpa时,发芽指数只有CK的20%。图4表明:当PEG溶液的渗透势较高(-0.05~-0.15MPa)时,种子平均发芽时间比CK大约延长1d,当其渗透势中等(-0.28~-0.94MPa)时,种子平均发芽时间比CK延长2~3d;当其渗透势较低(-0.94~-1.53MPa)时,种子平均发芽时间比CK延长4~5d。这可能是由于种子在抵抗干旱胁迫时延长了种子萌发的准备期造成的,黑果枸杞种子需要积累一定水分后才萌发,这种萌发机制降低了黑果枸杞在干旱区盐渍化荒漠上生存的风险。

图2 不同浓度PEG溶液处理后种子的萌发抗旱指数Fig.2 Drought resistance of seed germination in different PEG solution treatments

图3 不同浓度PEG溶液处理后种子的发芽指数Fig.3 Seed germination indexes in different PEG solution treatments

图4 不同浓度PEG溶液处理后种子的平均发芽时间Fig.4 Mean seed germination time in different PEG solution treatments
2.2 黑果枸杞种子萌发对钠盐胁迫的响应
2.2.1 黑果枸杞种子发芽率和发芽势对钠盐胁迫的响应
不同钠盐溶液处理后种子的发芽率与发芽势分别见图5和图6。图5表明,低浓度的Na2SO4溶液(0.2%~0.4%)处理的黑果枸杞种子其发芽率高于CK,说明Na2SO4溶液对于种子发芽具有增效效应,这可能因为SO4-2的毒害作用小,在低浓度盐溶液中,种子通过吸收盐溶液内的无机离子增加了细胞溶液的浓度,从而有效地进行渗透调节,以抵抗外界环境的胁迫[16]。以中性盐NaCl和Na2SO4溶液(溶液浓度0.4%~2.6%)处理黑果枸杞子,随着溶液浓度的增加,其发芽率和发芽势均有明显的降低趋势。以NaCl溶液处理黑果枸杞种子后,发芽率、发芽势呈弱倒“V”型降低:当溶液浓度为1.0%时,发芽率、发芽势分别为CK的70%、68%;当溶液浓度为1.6%时,发芽率、发芽势分别为CK的27%、20%。以Na2SO4溶液浓度处理黑果枸杞种子,当溶液浓度为0.8%时,发芽率与发芽势比CK分别下降4%和7%;当溶液浓度为1.2%时,发芽率与发芽势比CK分别下降31%和41%;当溶液浓度为2.6%时,发芽率与发芽势分别为CK的25%和17%。根据图5建立了钠盐溶液浓度和种子发芽率的线性回归方程,回归分析结果见表2。

表2 PEG溶液渗透势、钠盐溶液浓度和发芽率的回归分析结果Table 2 Regression analysis of PEG solution osmotic potential and sodium salt solution concentrations with germination rate
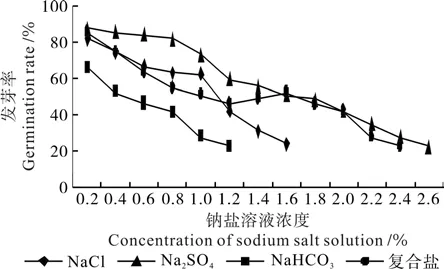
图5 不同钠盐溶液处理后种子的发芽率Fig.5 Seed germination rates in different sodium salt solution treatments

图6 不同钠盐溶液处理后种子的发芽势Fig.6 Seed germination potentials in different sodium salt solution treatments
以碱性盐NaHCO3溶液处理黑果枸杞种子,随着盐液浓度的增加,在碱与盐的胁迫下,其发芽率与发芽势均有十分明显的降低趋势。当溶液浓度为0.8%时,发芽率与发芽势比CK分别下降53%和59%;当溶液浓度为1.2%时,发芽率与发芽势分别为CK的24%和14%。
以复合盐溶液处理黑果枸杞种子,随着盐液浓度的增加,在碱与盐的交互胁迫下[17],发芽率与发芽势整体均呈十分弱的“S”型降低[18]。当溶液浓度为0.8%时,发芽率与发芽势分别是CK的62%和50%;当溶液浓度为2.6%时,发芽率与发芽势分别是CK的24%和14%。
2.2.2 黑果枸杞种子发芽指数和平均发芽时间对钠盐胁迫的响应
不同钠盐溶液处理后种子的发芽指数见图7。图7表明:以中性盐NaCl溶液处理黑果枸杞种子,除溶液浓度为0.8~1.0%时发芽指数有所增加外,其余各浓度的NaCl溶液处理后,随着浓度的增加,发芽指数总体均有所降低,发芽高峰期为3~6d,且有向后延长的趋势;以中性盐Na2SO4溶液处理黑果枸杞种子,除浓度在0.6~0.8%时发芽指数有所增加外,随着溶液浓度的增加,发芽指数总体有所降低,发芽高峰期为3~7d,且有提前的趋势;以碱性盐NaHCO3溶液处理黑果枸杞种子,随着溶液浓度的增加,发芽指数呈现不同幅度的降低趋势,发芽高峰期集中于3~5d;以复合盐溶液处理黑果枸杞种子,随着浓度的增加,发芽指数呈弱“S”型降低,发芽高峰期集中于3~9d,当溶液浓度>1.8%时,发芽高峰期集中于3~7d,这可能与溶液SO4-2含量较高有关。

图7 不同钠盐溶液处理后种子的发芽指数Fig.7 Seed germination indexes in different sodium salt solution treatments
不同钠盐溶液处理后种子的平均发芽时间见图8。图8表明:以NaCl、NaHCO3、复合盐溶液处理黑果枸杞种子,当溶液浓度较低(0.2%~0.6%)时,随着浓度的增加其平均发芽时间缓慢缩短,与CK相比,由比最初发芽的延长1.5d缩短至延长1.0d;当溶液浓度>0.6%时,平均发芽时间随着浓度的增加有不同幅度的延长趋势。而以Na2SO4溶液处理黑果枸杞种子,当溶液浓度较低(0.2%~0.8%)时其平均发芽时间缓慢缩短;当溶液浓度为0.2%时,其平均发芽时间比CK延长1.5d;当溶液浓度为0.8%时,其平均发芽时间比CK延长0.5d;当溶液浓度>0.8%时,其平均发芽时间呈十分弱的“S”型延长。

图8 不同钠盐溶液处理后种子的平均发芽时间Fig.8 Mean seed germination time in different sodium salt solution treatments
2.2.3 黑果枸杞种子萌发相对盐害率对盐分胁迫的响应
不同钠盐溶液处理后种子遭受的盐害率见图9。图9表明,不同的钠盐溶液处理对黑果枸杞种子萌发的毒害作用不同:以NaCl溶液处理种子,随着溶液浓度的增加其盐害率呈弱“V”型增大,当溶液浓度为1.0%时,盐害率为29%;当溶液浓度为1.6%时,盐害率为73%;以Na2SO4溶液处理种子,低浓度(0.2%~0.4%)溶液处理对黑果枸杞种子萌发有促进作用,中浓度(0.4%~0.8%)溶液处理后盐害率缓慢增大,高浓度(0.8%~2.6%)溶液处理后盐害率急剧增大,当溶液浓度为2.6%时,盐害率为76%;以NaHCO3溶液处理种子,随着溶液浓度的增加盐害率明显增大,当溶液浓度为1.2%时,盐害率为76%;以复合盐溶液处理种子,随着溶液浓度的增大盐害率呈“S”型增大,当溶液浓度<0.2%时,黑果枸杞种子萌发无盐害现象(这可能与溶液阴离子对抗作用和SO4-2所占比例较大有关),当溶液浓度为2.4%时,盐害率为76%。用相同浓度的钠盐处理黑果枸杞种子,种子萌发盐害率的大小顺序总体为NaHCO3>NaCl>复合盐>NaSO4。

图9 不同钠盐溶液处理后种子的盐害率Fig.9 Seed salt injury rates in different sodium salt solution treatments
3 结论与讨论
聚乙二醇(PEG)是常用来造成水分胁迫的渗透剂,它能使组织失水从而起到类似自然干旱的作用。水分胁迫显著影响黑果枸杞种子的萌发,随着PEG溶液浓度逐渐增加,渗透势逐步降低,种子发芽率、发芽势、发芽指数、萌发抗旱指数均有明显的下降趋势,且发芽始期、发芽高峰期均逐步延迟。在PEG溶液高渗透势下,其平均发芽时间比CK延长约1d,在中渗透势下延长2~3d,在低渗透势下延长4~5d,说明适度的干旱可使黑果枸杞种子的发芽指数几乎保持不变,使其平均发芽时间缓慢延长,萌发抗旱指数缓慢降低,但重度干旱胁迫则会显著降低发芽指数和萌发抗旱指数,使其平均发芽时间延长。黑果枸杞种子萌发的PEG溶液渗透势的适宜值、临界值与极限值分别为-0.24、-0.97、-1.69MPa。这说明,干旱胁迫可能是导致黑果枸杞种群天然更新能力变弱的原因之一,黑果枸杞在水分条件良好时成为竞争种,而在条件不利时,它会增加萌发数以避免种群的过度萎缩,又成为胁迫忍耐种。对干旱环境的忍耐力越强可能会使其在干旱环境中的竞争力更强,这种生存机制对于生长在盐渍化荒漠的黑果枸杞来说非常重要[19]。
不同的盐分处理对种子萌发的影响效应不同,除了低浓度的Na2SO4溶液(0.2%~0.4%)处理能提高黑果枸杞种子的发芽率,以单盐NaCl和Na2SO4、NaHCO3溶液处理黑果枸杞,随着溶液浓度的增加,种子发芽率、发芽势和发芽指数均有明显的下降趋势,但盐液浓度和降低幅度各不相同,以碱性盐溶液处理黑果枸杞种子,在碱与盐的胁迫下,盐液浓度越大其下降越明显,这和陈海魁等人的研究结果[6]明显不同,而和杨志江等人的研究结果[8]相似,造成这种差异的原因可能是黑果枸杞本身的特性及其环境的异质性[20]、催芽方法的差异。以复合盐溶液处理黑果枸杞种子,在碱与盐的复合作用下,种子发芽率、发芽势、发芽指数均呈十分弱的“S”型降低。以NaCl、NaHCO3、复合盐溶液处理黑果枸杞种子,当溶液浓度较低(0.2%~0.6%)时,随着浓度的增加其平均发芽时间缓慢缩短;当溶液浓度在0.6%以上时,其平均发芽时间随着浓度的增加有延长的趋势。以Na2SO4溶液处理黑果枸杞种子,以低浓度(0.2%~0.8%)的Na2SO4溶液处理后,其平均发芽时间缓慢缩短;在盐液浓度>0.8%时,其平均发芽时间明显延长,这说明高浓度盐胁迫降低了种子的活力和发芽的整齐度[21],黑果枸杞种子在低盐环境下的萌发比在高盐生环境下的萌发要好[22]。
以NaCl溶液处理黑果枸杞种子,其萌发高峰期为3~6d;以Na2SO4和复合盐溶液处理种子,种子萌发的高峰期为3~7d;以NaHCO3溶液处理种子,种子萌发的高峰期集中于3~5d。盐分对种子萌发的影响一般可归结为渗透胁迫和离子毒害。以NaCl溶液处理种子,随着盐液浓度的增加,盐害率呈弱“V”型增大;低浓度的Na2SO4溶液处理对黑果枸杞种子萌发具有促进作用,而当盐液浓度>0.8%时,随着溶液浓度增加,盐害率急剧增大;以NaHCO3溶液处理种子,随着溶液浓度的增加盐害率明显增大;以复合盐溶液处理种子,随着盐液浓度的增加,盐害率呈“S”型增大。以NaCl、Na2SO4溶液处理黑果枸杞种子,其萌发浓度的适宜值、临界值与极限值分别为0.4%、1.08%、1.76% 和 0.76%、1.73%、2.70%;以NaHCO3溶液处理黑果枸杞种子,萌发浓度的临界值与极限值分别为0.56%和1.23%。在实际栽培中,由于减小或避免了单盐的毒害作用,黑果枸杞种子耐盐的临界值可能会提高[23-24]。以复合钠盐溶液处理黑果枸杞种子,萌发浓度的适宜值、临界值与极限值分别为0.18%、1.42%和2.66%。Ungar[25]研究认为,很多盐生植物种子在萌发时有盐诱导的休眠现象,说明黑果枸杞对盐渍化土壤有较强的适应能力,这和黑果枸杞在硫酸盐盐土的自然分布特点高度一致。用相同浓度的钠盐处理黑果枸杞种子,其对种子萌发的盐害率大小总体依次为NaHCO3>NaCl>复合盐>Na2SO4。
[1] 陈海魁,蒲凌奎,曹君迈,等.黑果枸杞的研究现状及其开发利用[J].黑龙江农业科学,2008,5(5):155-157.
[2] 王继和.甘肃盐碱地治理[M].兰州:兰州大学出版社,2000:1-2.
[3] 常兆丰,赵 明.民勤荒漠生态研究[M].兰州:甘肃科学技术出版社,2006:82-83.
[4] 苗增建.黑果枸杞高效种子育苗技术[J].北方园艺,2013,(3):167-169.
[5] 刘荣丽,杨海文,司剑华,等.五种生长调节剂对黑果枸杞种子萌发及幼苗生长的影响[J].甘肃农业,2011,27(5):93-94.
[6] 陈海魁,赵文红.不同浓度NaCl胁迫对黑果枸杞种子萌发的影响[J].农业科学与技术,2010,11(4):37-38.
[7] 姜 霞,任红旭,马占青,等.黑果枸杞耐盐机理的相关研究[J].北方园艺,2012,(10):119-23.
[8] 杨志江,李 进,李淑朕,等.不同钠盐胁迫对黑果枸杞种子萌发的影响[J].种子,2008,27(9):19-23.
[9] 王继和.甘肃盐碱地治理[M],兰州,兰州大学出版社,2000:35-38.
[10] 刘克彪,李爱德.黑果枸杞种子发芽试验[J].甘肃科技,2013,29(022):168-170.
[11] 张 勇,薛林贵,高天鹏,等.荒漠植物种子萌发研究进展[J].中国沙漠,2005,25(1):106-111.
[12] 申瑞雪,潜伟平,刘江华,等.不同温度下赤霉素处理对乌饭树与短尾越橘种子发芽的影响[J].经济林研究,2012,30(4):13-18.
[13] 武 冲,仲崇禄,张 勇,等.聚乙二醇模拟干旱对三种木麻黄种子萌发的影响[J].中南林业科技大学学报,2011,31(2):22-26.
[14] 陈国雄,李定淑,张志谦,等.盐胁迫对西葫芦和黄瓜种子萌发影响的对比研究[J].中国沙漠,1996,16(3):307-310.
[15] 宋丽华,刘雯雯,陈淑芬.PEG处理对臭椿种子萌发的影响[J].农业科学研究,2005,26(4):25-29.
[16] 沈振荣,杨万仁,徐秀梅.不同盐分胁迫对苜蓿种子萌发的影响[J].种子,2006,25(4):34-37.
[17] 高战武,蔺吉祥,邵 帅,等.复合盐碱胁迫对燕麦种子发芽的影响[J].草业科学,2014,31 (3):451-456.
[18] 阮长林,冯 剑,刘 强,等.水黄皮种子发芽试验的初步研究[J].中南林业科技大学学报,2013,33(4):38-42.
[19] 吕美婷,杨九艳,杨 明,等.不同强度干旱胁迫对红砂种子萌发的影响[J].中国草地学报,2010,32(6):58-62.
[20] 段德玉,刘小京,李存桢.不同盐分与水分胁迫对灰绿藜种子萌发效应研究[J].中国生态农业学报,2005,13(2):79-81.
[21] 龚洪恩,吕芳德,司芳芳,等.离子注入对伞树种子发芽的影响[J].经济林研究,2014,32(2):156—158
[22] 王 娅,李 利,钱 翌,等.盐分与水分胁迫对两种猪毛菜种子萌发的影响[J].干旱区地理,2007,30(2):217-221.
[23] 刘宝玉,张文辉,刘新成,等.沙枣和柠条种子萌发期耐盐性研究[J].植物研究,2007,27(6):721-728.
[24] 于 畅,王竞红,薛 菲,等.沙棘对碱性盐胁迫的形态和生理响应[J].中南林业科技大学学报,2014,34(9):70-75
[25] Ungar I A.EcophysioIogy of Vascular Halophytes[M].Boca Raton:CRC Press Inc,1991:26-28.
