油桐丙二酰单酰CoA:ACP转酰基酶的克隆与序列分析
2014-01-22刘美兰谭晓风龙洪旭王僳僳
刘美兰 ,谭晓风 ,龙洪旭 ,王 哲 ,刘 璐 ,王僳僳
(1.中南林业科技大学 经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004;2.泰安市林业局,山东 泰安 271000;3.咸安区林业局林业调查规划设计院,湖北 咸宁 437000)
油桐Vernicia fordii是世界著名的工业油料树种,也是我国四大木本油料植物(油桐、油茶、核桃、乌桕)之一。桐油是一种具有很高经济价值的工业油料和原料,是油漆、油墨、生物柴油等产品的生产原料[1]。桐油是由多种脂肪酸(如桐酸、亚油酸、亚麻酸等)混合而成的,而这些脂肪酸的合成又是通过油桐内脂肪酸合成代谢过程完成的[2-5]。因此,了解油桐内参与脂肪酸合成的相关酶对于分子改良桐油性质有着非常重要的意义。
丙二酰单酰CoA:ACP转酰基酶(Malonyl CoA:ACP transacylase,MCAT)是脂肪酸生物合成途径的关键酶,它是由mcat基因编码的一种巯基酶,在Ⅱ型脂肪酸合成途径中起着极其重要的作用,负责在起始步骤把丙二酰基团从丙二酰单酰CoA上的硫酯连接部位转移到ACP的磷酸泛酰巯基乙胺臂上而形成丙二酰单酰ACP,即脂肪酸生物合成过程中的延伸底物,是从头合成脂肪酸的关键构件[6-10]。目前,玉米中MCAT基因是直接通过基因功能互补的方法筛选出来的,Verwoert等人将玉米的cDNA文库转化到大肠杆菌fabD突变体中,筛选转化后代的遗传表型,结果发现,一个编码GTP结合蛋白的基因可以互补fabD的表型,并通过进一步的实验确认了该基因即玉米的MCAT基因[11]。利用玉米的MCAT制作探针筛选油菜的cDNA文库,得到了油菜中MCAT基因,将此基因在大肠杆菌fabD突变体中表达,结果发现,它能恢复MCAT基因的生物活性,这一结果证明它具有MCAT的功能[12]。大豆中的MCAT基因至少有两种等位酶形式,虽其生化性质有所不同,但都能催化转酰基反应,其中MCAT1主要在种子中表达,而在叶子中两种形式都存在[13]。有关油桐中MCAT基因的研究迄今未见有报道,因此本研究以油桐为试材,克隆获得了油桐MCAT基因序列,并对其生物学功能进行了预测分析,以期为下一步验证MCAT基因在油桐脂肪酸合成代谢中的功能奠定基础,同时为油桐分子育种提供依据。
1 材料与方法
1.1 研究材料
供试葡萄桐栽培于湖南省永顺县青坪镇中南林业科技大学油桐试验基地,于2012年采集成熟种子,经液氮处理后保存于-80℃的冰箱内。
主要试剂:RNA提取试剂盒购自invitrogen,反转录试剂盒购自Fermentas公司;PrimeSTAR HS DNA Polymerase高保真DNA聚合酶购自Takara;2×EasyTaq PCR SuperMix、pEASY-Blunt Simple Cloning Kit、大肠杆菌Trans-T1感受态细胞均购自全式金公司;琼脂糖凝胶DNA回收试剂盒购自天根公司;引物合成及测序分别由华大基因和博尚生物公司完成;其他试剂均为分析纯。
1.2 研究方法
1.2.1 RNA 的抽提与cDNA 第一链的合成
油桐种子总RNA是采用试剂盒+CTAB方法[14]抽提的,取2μL 的总RNA,用1% 的琼脂糖凝胶电泳进行检测,最后用紫外分光光度计定量测定和纯度分析抽提效果。选择一定浓度且高纯度的总RNA样品,根据反转录试剂盒的步骤合成油桐cDNA 第一链,贮存于-20℃的冰箱内。
1.2.2 油桐MCAT基因的特异引物设计和片段扩增
设计引物序列来源于本实验室油桐种子转录组数据库[15],利用Primer Premier 5.0软件设计MCAT的上下游引物,其分别是MCAT-F(5'GCTCCGCTAACCTACTCAGT3')和MCAT-R(5' GCTGTCTATCTTGGATTGAACA 3')。以油桐cDNA为模板,用高保真酶进行PCR扩增,反应体系和程序见说明书。用琼脂糖凝胶检测并回收目的片段,将目的片段连入pEASY-Blunt Simple载体和转化大肠杆菌细胞中,筛选阳性克隆并测序。
1.2.3 油桐MCAT基因的生物信息学分析
利用在线NCBI-ORF Finder和本地软件DNAMAN进行开放阅读框(Open reading frame,ORF)的查找和翻译;在线 NCBIblastp进行同源搜索并下载序列,利用本地软件GeneDoc和MEGA5.1进行同源比对和构建系统进化树;利用ProtParam 在线工具分析油桐MCAT基因编码蛋白的氨基酸组成及其理化性质;采用在线工具ProtScale、TMpred对其编码蛋白的疏水性、跨膜结构和跨膜区拓扑结构进行预测;利用在线工具SOPMA 和SWISS-MODE对其二维结构和三维结构分别进行预测,并利用本地软件UCSF Chimera对其三维结构进行分析;最后利用在线PSORTⅡ预测MCAT的亚细胞位置。
2 结果与分析
2.1 油桐MCAT基因的克隆与序列分析
根据本实验室收集的油桐不同时期转录组数据进行分析[15],利用本地软件Premier 5设计特异引物,以油桐种子cDNA为模板,克隆并测序,获得了一条长为1 488bp的片段(如图1A)。采用在线NCBI的ORFFinder程序,参照Kozak法则[16],寻找出一条长为1 179bp的ORF(如图1B),编码392个氨基酸。ORF的识别是证明一个新的DNA序列为特定的蛋白质编码基因的部分或全部的先决条件。因此可初步判断,获得的序列为油桐中一个新基因的cDNA序列。

图1 油桐MCAT的RT-PCR扩增产物和ORF分析结果Fig.1 The result of RT-PCR ampli fi cation and ORF analysis of VfMCAT gene
2.2 油桐MCAT蛋白的同源性和系统进化树分析
利用本地软件GeneDoc将找出的ORF序列翻译成氨基酸序列,然后利用在线NCBIblastp将序列进行比对分析,结果发现,本次实验获得的序列与蓖麻和亚麻的MCAT的同源性均达到85%。将获得的序列与NCBI数据库中已知的各树种的MCAT进行同源性比对,结果(如图2)发现,获得的蛋白质序列与各树种的MCAT都有较高的同源性,各物种MCAT所编码的氨基酸都存在“GXSXG”和“GQGXQ”这两个高度保守的motif,且各树种MCAT的C端序列的保守性特别强(如图2中的黑色部分所示),而N端前100 aa序列的特异性则特别强。利用本地软件MEGA5.1中的Construct/Test Neighbor-Joining Tree将NCBIblast的搜索结果生成进化树,结果(如图3)表明,获得的序列与蓖麻和亚麻的MCAT的亲缘关系最近。综合上述结果可以判断,本实验获得的片段确为油桐MCAT基因片段。
2.3 油桐MCAT编码蛋白的理化性质分析
蛋白质的基本性质包括其氨基酸组成、相对分子质量、原子组成和等电点等[17]。采用在线软件ProtParam和本地软件DNAMAN对油桐MCAT编码蛋白的理化性质进行了分析,结果表明:油桐MCAT编码392个氨基酸,氨基酸的组成如图4,其中最多的为Ala(丙氨酸),占11.7%;其负电荷残基总数(Asp+Glu)为40,正电荷残基总数(Arg+Lys)为43;该蛋白的分子式为C1834H2972N504O569S15,分子量约为41.67 Kda;其理论等电点pI为8.43,不稳定系数为34.9,说明它是一种稳定蛋白。
2.4 油桐MCAT编码蛋白的疏水性或亲水性和跨膜结构的预测与分析
利用在线软件ProtScale分析油桐MCAT编码蛋白的疏水性或亲水性,所得图谱如图5A。由图5A可知,多肽链的第223位的丝氨酸(Ser)具有最高的分值2.089,说明其疏水性最强;第48位的天冬酰胺(Asn)具有最低分值-2.111,说明其亲水性最强,亲水残基多于疏水残基,且疏水残基与亲水残基均分布在整条多肽上,整条多肽上都表现出亲水性。利用在线软件TMPred进行分析,结果表明,油桐MCAT编码蛋白存在一个跨膜结构域,可能的位置是第284~302的19个氨基酸位置。因此可以推断,油桐MCAT是含有一个跨膜结构的可溶性蛋白。
2.5 油桐MCAT编码蛋白的二级结构及三级结构的预测分析
用SOPMA预测油桐MCAT编码蛋白的二级结构,结果如图6所示,α- 螺旋和无规则卷曲是油桐MCAT最大量的结构元件,而β-转角和延伸链则散布于整个蛋白质中。统计结果表明,油桐MCAT编码蛋白由41.84%的α-螺旋(Alpha helix)、28.57%的无规则卷曲(Random coil)、20.66%的延伸链(Extended strand)、8.93%的β-转角(Beta turn)构成。采用SWISS-MODE和UCSF Chimera软件对MCAT编码蛋白的三维结构进行预测和分析,结果(如图7A和B)发现,其二级结构与三级结构一致。

图2 油桐MCAT与其它植物MCAT的氨基酸序列的比对结果Fig.2 Alignment of deduced amino acid sequences of VfMCAT and MCAT from other plants
2.6 油桐MCAT编码蛋白的亚细胞定位分析
亚细胞定位的预测一般通过算法比较查询序列中所包含的特征参数与各类相应的亚细胞定位的相似度,然后以一组概率值的形式作出判断。借助工具WoLF PSORT预测MCAT编码蛋白的亚细胞定位,分析结果表明,该蛋白最有可能在叶绿体基质中发挥作用。
3 结论与讨论

图3 不同物种MCAT基因的系统进化树分析结果Fig.3 Phylogenetic tree analysis of MCAT from different species
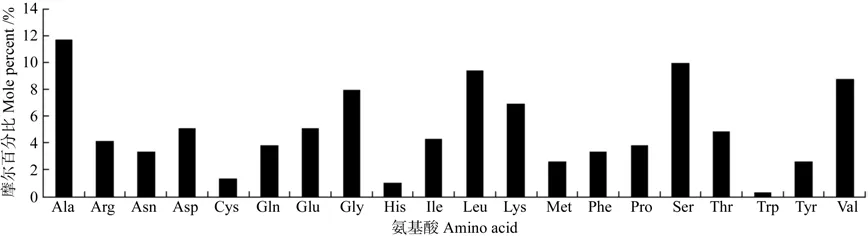
图4 油桐MCAT的氨基酸组成Fig.4 The amino acid compositions of VfMCAT
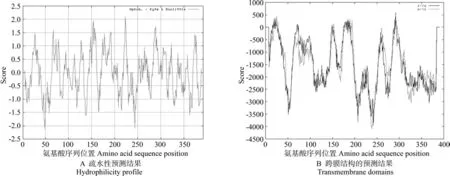
图5 油桐MCAT蛋白的疏水性及跨膜结构的预测结果Fig.5 The predicted hydrophilicity pro fi le and transmembrane domains of VfMCAT
在Ⅱ型脂肪酸的合成代谢中,丙二酰单酰CoA:ACP转酰基酶的催化产物丙二酰单酰ACP是脂肪酸代谢过程中的核心物质,是酮酯酰ACP合成酶(KASI/II/Ш)进行脂肪酸链延伸进一步合成脂肪酸的底物,因此丙二酰单酰CoA:ACP转酰基酶是控制脂肪酸能否从头合成的关键酶[6-7]。同源性比对和进化树构建结果表明,油桐MCAT与蓖麻、亚麻的MCAT的同源性最高都为85%,且它们之间的分子进化距离最近,其亲缘关系最为密切。各物种MCAT所编码的氨基酸都存在“GXSXG”和“GQGXQ”这两个高度保守的motif;结构信息分析结果也证实这两个motif与MCAT的功能密切相关[7,18-19]。同源性是在一定程度上代表着物种之间功能的相似性和亲缘关系的远近,同时也反映了MCAT编码产物在不同物种结构上的稳定性与对生物体的功能重要性[20]。所以可以确定,本研究获得的序列为油桐MCAT基因序列,且各物种间MCAT的C端都特别保守,这可能是各物种MCAT具有相似功能的原因。分析该蛋白后发现,油桐MCAT编码392个氨基酸,平均疏水系数为-0.031,整条多肽链表现为亲水性,说明其为水溶性蛋白,其二级结构很容易接近水分子,油桐MCAT编码蛋白的二级结构主要为α-螺旋和无规则卷曲。对其蛋白质的亚细胞定位、疏水或亲水性和跨膜结构的分析与预测结果表明,油桐MCAT是一种含有一个跨膜结构的水溶性蛋白,而且主要是在线粒体内发挥作用。植物MCAT是Ⅱ型脂肪酸的合成代谢中的关键酶,主要发生在叶绿体内[21],由此可以判断,油桐MCAT是在线粒体中参与油桐内脂肪酸合成代谢的。
油桐是我国四大木本油料树种之一,桐油中的脂肪酸种类较多,目前对桐油的脂肪酸合成过程尚不清楚,以往对油桐的研究主要集中在良种选育等方面,而对桐油脂肪酸合成的分子机理的研究报道则相对较少。本研究克隆获得了与油桐油脂合成相关的MCAT基因,并对其生物学功能进行了预测,这为进一步研究和探讨该基因的功能奠定了基础,也为研究油桐脂肪酸合成代谢提供了理论依据。
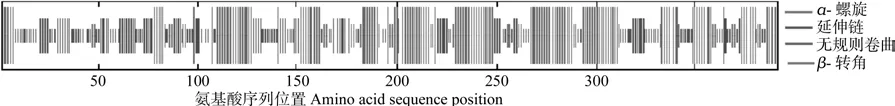
图6 油桐MCAT蛋白二级结构预测结果Fig.6 The predicted secondary structure of VfMCAT
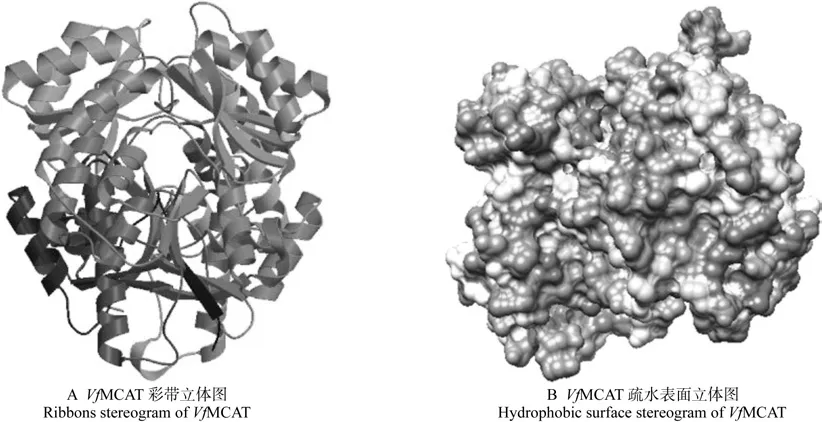
图7 油桐MCAT蛋白三级结构模型预测结果Fig.7 The predicted tertiary structure of VfMCAT
[1] 谭晓风.油桐的生产现状及其发展建议[J].经济林研究,2006,24(3):62-64.
[2] 傅伟昌,顾小红,陶冠军,等.桐油脂肪酸组成分析和甘三酯结构判定[J].天然产物研究与开发,2008,20(6):964-968.
[3] Rock C O,Cronan J E.Escherichia coli as a model for the regulation of dissociable (type II) fatty acid biosynthesis[J].Biochim Biophys Acta,1996,1302(1):1-16.
[4] 王 婧,刘泓利,宋 超,等.甘蓝型油菜叶表皮蜡质组分及结构与菌核病抗性关系[J].植物生理学报,2012,48(10):958-964.
[5] 李永华,史春会,李 永,等.低温下4种秋菊叶片和根系膜脂脂肪酸组分比较[J].植物生理学报,2013,49(5):457-462.
[6] Arthur C J,Williams C,Pottage K.Structure and Malonyl CoAACP Transacylase Binding ofStreptomyces coelicolorFatty Acid Synthase Acyl Carrier Protein [J].ACS Chem Biol,2009,4(8):625-636.
[7] Prigge S T,He X,Gerena L,et al.The initiating steps of a type II fatty acid synthase inPlasmodium falciparumare catalyzed bypfACP,pfMCAT,andpfKASШ [J].Biochemistry,2003,42(4):1160-1169.
[8] Kremer L,Nampoothiri K M,Lesjean S,et al.Biochemical characterization of acyl carrier protein (ACP) and malonyl-CoA:ACP transacylase (mtFabD),two major components ofMycobacterium tuberculosisfatty acid synthase II [J].J Biol Chem,2001,276(30):27967-27974.
[9] Keatinge-Clay A T,Shelat A A,Savage D F,et al.Catalysis,specificity,and ACP docking site of Streptomyces coelicolor malonyl-CoA:ACP transacylase [J].Structure,2003,11:147-154.
[10] Oefner C,Schulz H,D’Arcy A,et al.Mapping the active site ofEscherichia colimalonyl-CoA-acyl carrier protein transacylase(FabD) by protein crystallography [J].Acta Oystallogr D Biol Crystallogr,2006,62(6):613-618.
[11] Verwoert I I,Van L K,Walsh M C,et al.Modification ofBrassica napusseed oil by expression of theEscherichia coli fabHgene,encoding β-ketoacyl-acyl carrier protein synthase III[J].Plant Mol Biol,1995,27(5):875-886.
[12] Simon J W,Slabas A R.cDNA cloning ofBrassica napusmalonyl-CoA:ACP transacylase (MCAT) (fab D) and complementation of anE.coliMCAT mutant [J].FEBS Lett,1998,435(2-3):204-206.
[13] Guerra D J,Ohlrogge J B.Partial purification and characterization of two forms of malonyl-coenzyme A:acyl carrier protein transacylase from soybean leaf tissue [J].Arch Biochem Biophys,1986,246(1):274-285.
[14] 龙洪旭,谭晓风,陈 洪,等.油桐油体蛋白基因的克隆及序列分析[J].中南林业科技大学学,2010,30(4):31-38.
[15] 陈 昊,蒋桂雄,龙洪旭,等.转录组测序揭示油桐脂肪酸的合成途径[J].植物生理学报,2014,50 (1):37-44.
[16] 罗 轶.鸡FATP1基因cDNA的克隆、组织表达及其生物信息学分析[D].雅安:四川农业大学,2008.
[17] 蒋 彦.基础生物信息学及应用[M].北京:清华大学出版社,2003:150-160.
[18] Hong S K,Kim K H,Kim K H,et al.Cloning,purification,crystallization and preliminary X-ray crystallographic analysis of MCAT fromStaphylococcus aureus[J].Acta Cryst,2010,66(1):20-22.
[19] Verwoert I I,Verbree E C,van der Linden KH,et al.Cloning,nucleotide sequence and expression of theEscherichia coli fabDgene,encoding malonyl Coenzyme A-acyl carrier protein transacylase [J].J Bacteriol,1992,174(9):2851-2857.
[20] Walter J,High KA.Gene therapy for the hemophiliac [J].Advvet Med,1997,23(12):119-134.
[21] John Ohlroggeav,John Browse.Lipid biosynthesis [J].The plant cell,1995,7:957-970.
