额叶冲突加工机制及年老化改变的事件相关电位研究*
2014-01-22刘赛男王鲁宁
刘赛男,张 熙,王鲁宁
随着社会进步和预期寿命的提高,我国正步入老龄化社会,认知功能年老化的研究已成为认知神经科学研究的重点之一。前额叶是大脑受年老化影响最为敏感的脑区,额叶执行功能的年老化也被认为是其它认知功能随龄减退的主要原因[1],其中对冲突信息的干扰控制是执行抑制功能的一个重要方面[2],因此从冲突信息加工机制角度进行研究,对揭示前额叶功能有重要的意义。
近年来,有关额叶冲突信息的干扰控制功能及其年老化相关的事件相关电位(event-related potential,ERPs)研究逐渐增多。其中经典的 Erisksen flanker实验范式反映出冲突既可以表现在知觉阶段,也可以表现在反应阶段,而且负责在不同加工水平上监控冲突的脑区也有不同。如Brydges等[3]采用flanker任务观察到,靶刺激呈现后288~379 ms诱发出一负波N2,反应冲突状态下其波幅增高,头皮分布为额-中央区域,提示该区域激活所诱发的N2与反应冲突而不是知觉冲突有关。Cona等[4]的研究则表明,随着年龄的增长,前额叶的功能开始衰退,注意变得涣散而不易保持,前额叶对皮层初级感觉区信息的抑制筛选能力也逐渐减弱。Qiu等[5]则研究发现,刺激呈现后350~550 ms之间出现差异波N380,头皮分布为额-中央区域,溯源分析定位于前额叶皮层,提示该区域与冲突处理及反应选择有关。那么当侧翼干扰的冲突信息呈现时,前额叶皮层在冲突信息处理机制中的作用如何,老年人干扰控制功能的衰退表现在知觉阶段还是反应阶段或者二者兼而有之,哪种ERPs成分对年龄增长更为敏感?为此,我们采用ERPs和低分辨率电磁断层成像源定位分析技术(low resolution brain electromagnetic tomography,LORETA)源定位分析技术,操纵冲突出现的加工阶段,研究冲突信息处理机制、脑部相关功能定位及其年老化改变,观察对年龄增长变化敏感的ERPs指标,并希以此为基础,进一步研究及掌握老年人认知功能障碍的病理变化机制,以期探索临床早期诊断、治疗的可能途径。
1 材料与方法
1.1 研究对象
青年组被试 15人,平均年龄(19.3±2.1)岁,平均受教育年限(10.3±2.3)年;老年组有效被试 15人,平均年龄(70.2±6.3)岁,平均受教育年限与青年组相比无显著差异(10.5±3.0)年。所有被试均为右利手,身体基本健康,无神经或精神疾病病史,视力正常或校正后正常,均自愿参加本实验。
1.2 研究方法
1.2.1 仪器设备 采用荷兰Advanced Neuro Technology B.V.公司128导脑电诱发电位仪。按国际10/20脑电记录系统安置 30电极(FPz,AFz,Fz,Cz,Pz,Oz,FP1,FC1,CP1,O1,F3,C3,P3,FC5,CP5,F7,T7,P7,FP2,FC2,CP2,O2,F4,C4,P4,FC6,CP6,F8,T8,P8),A1和A2双耳联合电极为参考电极,眉间置接地电极,左眼上下各2 cm处安置垂直眼动电极,两眼外眦1 cm安置水平眼动电极。使用Ag/AgCl电极,电极与皮肤间的阻抗小于5 KΩ。
1.2.2 ERPs视觉刺激范式 改良的flanker干扰任务:刺激材料为白色简单平面图形,由不同朝向的箭头组成,在以黑色为背景色的屏幕中央闪现,每张图形持续呈现 300 ms,刺激间隔(ISI)为(2000±200)ms。程序中包括三种状态:中性状态(++<++或++>++);刺激-反应一致状态(匹配状态,<<<<<或>>>>>);刺激-反应不一致状态(冲突状态,<<><<或>><>>)。三种状态随机出现且概率相等。因此,本实验设计为刺激-反应相容性×年龄因素的两因素混合因素设计,其中刺激一致性效应是考察知觉阶段干扰控制的指标,反应一致性效应是考察反应阶段干扰控制的指标。
1.2.3 测试方法 被试者坐于暗光屏蔽室内,双眼水平注视显示屏中心,距显示屏100 cm,水平及垂直视角均<5°,室温25℃左右。要求被试者对中间的箭头方向作反应,而忽略旁边的箭头或“+”,中间箭头朝向左则左手按键,朝向右则右手按键。
1.2.4 ERPs测量及分析 ERPs分析以刺激呈现前200 ms至刺激呈现后1 000 ms,根据总平均图确定ERPs各成分的时间分析窗口,取200~350 ms为N2时间窗,以-200~0 ms为基线,测量平均电压值及峰值潜伏期。将刺激-反应不一致状态减去中性状态的电位曲线得到差异电位曲线N380,采用ASA 3.1软件测量差异电位曲线N380的始潜时、持续时间及平均波幅,并进行LORETA源定位分析。具体测量方法:自200~800 ms内每50 ms为一个时间分析窗口,分别测量不同刺激条件下各时间窗的平均波幅,对同一时间窗内两种条件下的平均波幅以SPSS 13.0软件包进行重复测量的单因素方差分析,采用Greenhouse-Geisser方法校正P值,Repeated方法进行因素内不同水平间的对比,以此确定差异波N380的始潜时及持续时间,继而测量平均波幅。
1.2.5 统计学方法 以 SPSS 13.0软件包对 N2的平均电压值、峰值潜伏期及波幅进行重复测量的方差分析并比较其主效应,对差异电位曲线N380的始潜时、持续时间及平均波幅进行重复测量的多因素方差分析。
2 结果
2.1 ERPs行为学指标
2.1.1 正确率 青年组中性状态下正确率较刺激-反应一致状态略有降低(P<0.05),刺激-反应不一致时明显下降(P<0.05)。老年组中性状态下正确率与刺激-反应一致状态相比无显著差异,但刺激-反应不一致时则较中性状态明显降低(P<0.01)。与青年组相比,老年组不同刺激条件下的正确率均无显著差异,刺激-反应相容性与年龄因素间亦无交互效应(表 1)。
2.1.2 反应时 青年组中性状态下的反应时较刺激-反应一致状态明显延长(P<0.01),刺激-反应不一致状态与中性状态相比亦差异显著(P<0.01)。老年组有类似趋势,且各刺激条件下反应时均较青年组明显延长(P<0.01)。中性减去刺激-反应一致状态后,刺激一致性效应与年龄因素无交互效应。刺激-反应不一致减去中性状态后,反应一致性效应与年龄因素存在交互效应。
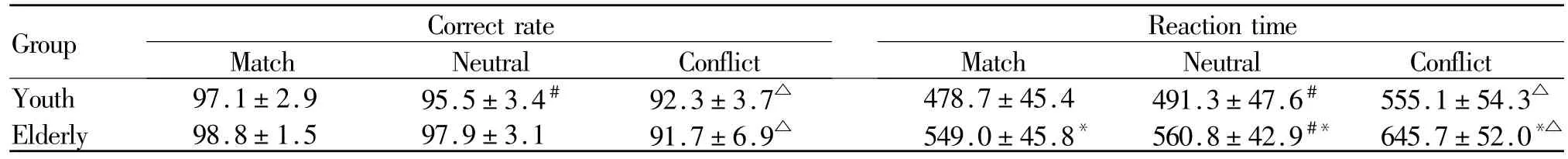
Tab.1 Reaction time(ms)and correct rate(%)of two groups
2.2 ERPs数据
2.2.1 N2青年组 N2 出现于刺激呈现后209~318 ms时间窗内,头皮分布局限于前头中央部,前头部波幅略高于后头部,左右半球波幅无差异。老年组N2于刺激呈现后205~316 ms时间窗内出现,但头皮分布明显后移,后头部波幅明显高于前头部(P<0.01),Pz波幅最高,左右半球波幅亦无差异。不同刺激条件下相比较,两组N2潜伏期与波幅均无变化。刺激-反应相容性与左右半球、前后头部及年龄因素均无交互效应(图1,见彩图页Ⅰ)。
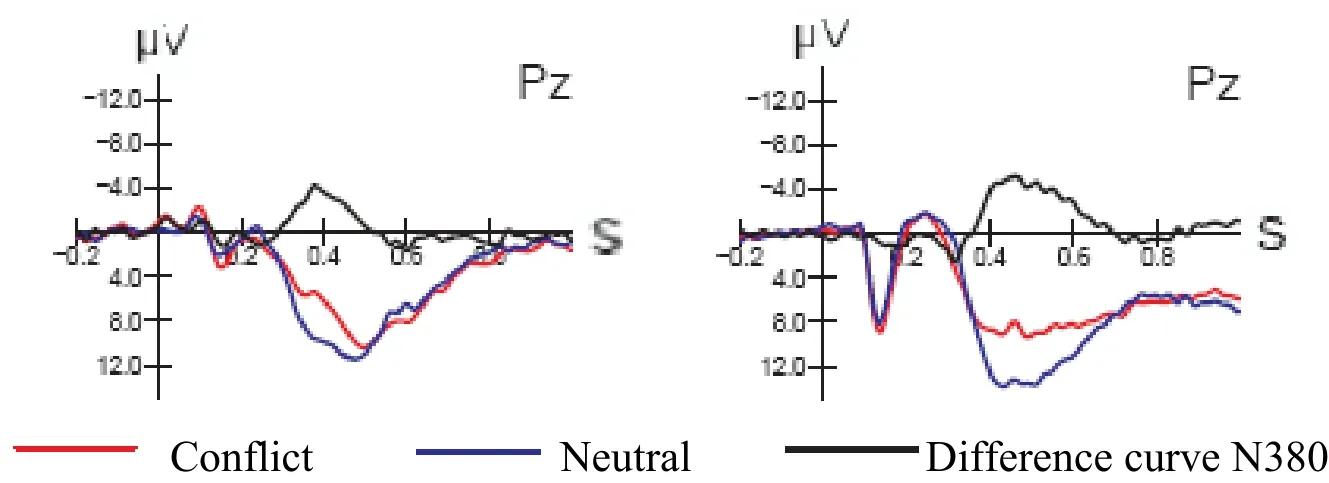
Fig. 1 N380 of youth group(left)and elderly group(right)
2.2.2 差异波N380 以刺激-反应不一致状态减去中性状态的ERPs波形得到N380差异曲线(图1,见彩图页Ⅰ)。青年组N380于刺激呈现后300 ms出现,持续时间150 ms。该波形呈全头分布,Pz波幅最高,左右半球波幅无显著差异,后头部显著高于前头部,后头部左右两侧无差异。老年组N380于刺激呈现后350 ms始出现,持续时间明显延长至250 ms。波形亦为全头分布,Pz波幅最高,左右半球波幅无显著差异,后头部亦显著高于前头部(P<0.01),后头部左右两侧亦无明显差异。
与青年组相比较,老年组N380始潜时延迟,持续时间延长,平均波幅无显著差异。左右半球与组间、前后头部与年龄因素均无交互效应。
2.3 LORETA源定位分析
图2为两组被试不同刺激条件下N2所在时间窗脑内电流活动密度断层图。刺激-反应一致状态下,青年组左前额叶内侧面及扣带回背侧左前辅助运动区明显激活,右前额背外侧区域轻度激活。老年组可见双侧颞叶、双前额叶背外侧区域激活,左前额内侧面电流活动较弱;中性状态下,青年组脑内电流活动主要集中于左前辅助运动区,右前额叶背外侧区域激活亦较为明显。老年组双前额叶背外侧尤其右侧区域激活增强,其次为双侧颞叶区域,前额内侧面激活不明显;刺激-反应不一致即冲突状态下,两组激活脑区均与中性状态相似,但老年组前额叶活动减弱,颞叶区域明显增强(图2,见彩图页Ⅰ)。
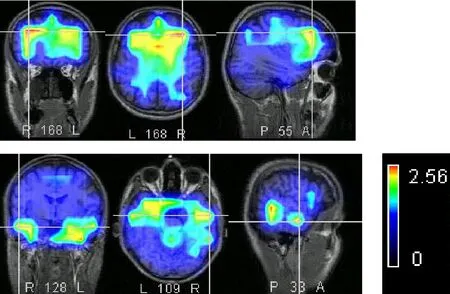
Fig. 2 N2 LORETA of youth group(up)and elderly group(down)(Conflict condition)
对差异波N380进行LORETA源定位分析,青年组在357至400 ms时间窗内出现右侧颞叶、右侧前额背外侧、左颞叶、左前额叶背外侧多个区域的激活,右侧较左侧明显。老年组在420至486 ms时间窗内右前额背外侧、右颞叶区域激活不明显,而主要见左颞叶、左前额背外侧、左前额内侧面区域激活(图3,见彩图页Ⅰ)。
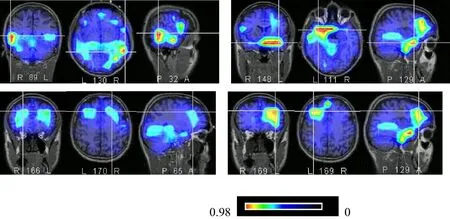
Fig. 3 N380 LORETA of youth group(left)and elderly group(right)
3 讨论
在正常的年老化过程中,前额叶和皮层下的单胺能核受年龄变化的影响最为明显,包括皮层萎缩和神经元的丧失、树突分枝减少和轴突髓鞘结构的破坏(白质退行性变化)以及一些神经递质浓度的降低和受体数量的减少(如多巴胺系统的退化)等[6],而前额叶是执行功能重要的物质基础,因此相对于其它的脑结构或认知功能,前额叶或执行功能的年老化改变更为显著[7]。
对冲突信息的干扰控制是执行抑制功能的一个重要方面,目的是抑制与目标行为产生竞争的事件或反应,而flanker侧翼冲突信息干扰效应可能源自运动反应阶段的竞争,也可作用于知觉加工过程。为了将二者区分开来,本研究操纵了冲突出现的知觉与反应阶段。行为学数据显示,老年组各种刺激条件下的反应时均明显延长,尤其当冲突发生在反应阶段上时,老年组反应时的延长程度表现出较青年组更为明显的干扰效应。提示随年龄增长,老年人对冲突信息的加工处理速度减慢、抑制干扰的能力减退,尤其当冲突信息出现于反应阶段时,该种增龄改变尤为明显,提示前额叶执行抑制功能随增龄减退主要表现为反应执行过程中由于反应选择的竞争以致运动反应起动延迟、耗时增多,也侧面提示了知觉阶段冲突信息监测及加工处理在某种程度上受高级认知功能变化的影响比较小[8]。
单纯行为学研究常常难以揭示认知活动中不同阶段不同脑区的活动,因此本研究将行为学指标与ERPs指标相结合,结果发现,无论冲突出现在知觉阶段还是反应阶段,青年组前额负成分N2的潜伏期、波幅均无变化,提示在flanker刺激范式下,N2并非是一项反映刺激知觉阶段或反应阶段冲突信息干扰作用的ERPs敏感指标,这与某些研究结果相一致[9]。而老年组在不同刺激条件下N2潜伏期、波幅的变化趋势与青年组相同,变化程度亦无显著差异,提示N2随年龄增长,潜伏期及波幅的变化均不明显,这似乎说明老年人前额叶冲突监测的执行抑制功能无明显衰退,但老年组N2头皮分布较青年组明显后移,源定位分析结果显示刺激-反应不一致状态下出现双额叶背外侧、双侧颞叶区域的激活,而前辅助运动区、前额中央部内侧面激活并不明显,提示在该刺激状态下青年人表现出高度特异性的神经激活模式,而老年人不仅出现左前辅助运动区、右前额背外侧等相关区域激活减弱,而且调动了左前额背外侧、双侧颞叶等其它脑区的认知资源以完成任务,从而表现出神经结构分布的更广泛性和非特异性,使得老年人在认知相关区域功能减退的情况下能够完成认知任务。Lucci等[10]在一项 go-Nogo任务的ERPs研究中则发现,虽然老年被试额叶Nogo-N2几乎消失,但该时间窗内可见到后头部及前额叶区域的显著激活,且前额叶活动与错误率呈负相关,提示随年龄增长,额叶干扰抑制功能进行性衰退,其它脑区则加入到任务执行过程中以确保认知任务的准确完成。
为了分离冲突出现的不同阶段、进而寻找ERPs敏感指标,本研究采用了相减技术,以刺激-反应不一致状态减去中性状态ERPs波形得到差异曲线N380(反映反应阶段的冲突)。N380在青年组于刺激呈现后300~450 ms时窗内出现,老年组始潜时及持续时间明显延长,与行为学结果所示刺激-反应不一致状态较中性状态反应时延长相一致。提示老年人额叶干扰控制功能的减退主要表现在反应阶段冲突信息加工过程的起动及信息处理缓慢、持续时间延长,而N380正是可敏感反映这种变化的ERPs成分。进一步的源定位分析显示,N380所在时间窗内青年组双侧前额叶背外侧、双侧颞叶多个区域激活,尤其右前额背外侧、右侧颞叶激活最为显著,提示前额叶皮层及颞叶均参与了反应阶段冲突信息的加工处理过程,其中前额叶背外侧区域与冲突信息加工处理过程中的反应选择、执行控制密切相关[11]。老年组可见左前额背外侧、左侧颞叶、左前额内侧面区域激活,右前额背外侧区域激活较青年组明显减弱而左颞叶激活增强,右颞叶则未见明显电流活动。提示随年龄增长,在反应阶段出现冲突时,老年人右前额叶皮层对冲突信息干扰的执行控制、反应选择等认知过程起动延迟,速度减慢,并由此调动左前额背外侧、左侧颞叶等其它脑区的认知资源以完成任务,表明老年人对冲突信息干扰的执行抑制功能随龄减退,ERPs成分N380可能反映了前额叶背外侧皮层在冲突信息加工处理过程中反应选择、评价执行控制等认知方面的活动。
[1] Raz N,Williamson A,Faith GD,et al.Neuroanatomical and cognitive correlates of adult age differences in acquisition of a perceptual-motor skill[J].Microsc Res Tech,2000,51(1):85-93.
[2] Nigg JT.Response inhibition and disruptive behaviors:toward a multiprocess conception of etiological heterogeneity for ADHD combined type and conduct disorder elearly-onset type[J].Ann N YAcad Sci,2003,1008:170-182.
[3] Brydges CR,Clunies-Ross K,Clohessy M,et al.Dissociable components of cognitive control:an event-related potential(ERP)study of response inhibition and interference suppression[J].PLoSOne,2012,7(3):e34482.
[4] Cona G,Bisiacchi PS,Amodio P,et al.Age-related decline in attentional shifting:evidence from ERPs[J].Neurosci Lett,2013,556:129-134.
[5] Qiu J,Lou YJ,Wang QH,et al.Brain mechanism of Stroop interference effect in Chinese characters[J].Brain Res,2006,1072(1):186-193.
[6] Raz N.Aging of the brain and its impact on cognitive performance:Integration of structural and functional findings.In:Craik FIM,Salthouse TA(Eds.).The hankbook of aging and cognition(2nd Eds)[M].Mahwah,NJ:Lawrence Erlbaum Associates Publishers,2000:1-90.
[7] Friedman D,Nessler D,Cycowicz YM,et al.Development of and change in cognitive control:a comparison of children,young adults,and older adults[J].Cogn Affect Behav Neurosci,2009,9(1):91-102.
[8] Anguera JA,Gazzaley A.Dissociation of motor and sensory inhibition processes in normal aging[J].Clin Neurophysiol,2012,123(4):730-740.
[9] Mathewson KJ,Dywan J,Segalowitz SJ.Brain bases of errorrelated ERPs as influenced by age and task[J].Biol Psychol,2005,70(2):88-104.
[10] Lucci G,Berchicci M,Spinelli D,et al.The effects of aging on conflict detection[J].PLoS One,2013,8(2):e56566.
[11] De Sanctis P,Katz R,Wylie GR,et al.Enhanced and bilateralized visual sensory processing in the ventral stream may be a feature of normal aging[J].Neurobiol Aging,2008,29(10):1576-1586.
