籽鹅卵泡颗粒细胞烯醇化酶过表达模型的建立及其对孕酮分泌的影响*
2014-01-22张伟宏王江璐赫荣贺杨焕民
张伟宏,计 红,王江璐,赫荣贺,杨焕民
卵泡生长发育及其成熟排卵是一个复杂的过程。卵泡的生长发育需要消耗大量的能量,研究表明糖酵解是卵巢内卵泡发育主要的供能方式[1]。α-烯醇化酶 (α-enolase,ENO1)作为糖酵解酶[2],若在颗粒细胞中高表达,可能会促进相关激素分泌从而进一步促进卵泡发育。
禽类无黄体,其孕酮(progesterone)可直接作用于腺垂体,引起促黄体生成素(luteotropic hormone,LH)释放,诱发排卵。研究发现,蛋鸡的产蛋性能与其血浆P4的含量成平行关系,且孕酮是排卵前LH峰形成的关键刺激信号。因此,研究禽类孕酮的分泌调节对雌禽产蛋启动和维持具有重要意义。
近年来,关于禽类生殖激素与产蛋性能的相关研究很多,但关于ENO1是否能促进相关激素分泌进而促进鹅卵泡排卵尚未见报道。本研究以东北籽鹅为实验动物,构建籽鹅卵泡颗粒细胞烯醇化酶过表达模型,并应用ELISA方法检测颗粒细胞中ENO1过表达对孕酮分泌的影响,为进一步探讨ENO1与籽鹅卵泡发育之间的关系奠定基础。
1 材料与方法
1.1 主要试剂与器材
ENO1过表达载体由本实验室构建保存;M199培养液(赛默飞世尔生物化学制品(北京)有限公司);胎牛血清 Solarbio(Beijing Solarbio Technology Co.Ltd.);Trizol Reagent(Invitrogen,美国);ENO1引物、βactin引物(上海生工公司合成);反转录酶试剂盒(Perfect Real Time)(购自中国大连 TaKaRa公司);318-Microplate Reader(上海三科仪器有限公司);Goose Prog ELISA Kit(美国 RD)。
1.2 实验动物和颗粒细胞分离方法
8月龄健康雌性籽鹅(大庆市大同种鹅场饲养)。籽鹅颈静脉放血致死,取F1级卵泡,参考Gillbert等[3]介绍的方法,剥离颗粒细胞层。将剥离后的颗粒细胞膜置于0.9%生理盐水中清洗后,可选择用培养液再次清洗2~3次,尽量去除卵黄物质。用小剪刀将颗粒细胞膜剪成约1 mm3大小的小块,用 12.5μg/mlⅠ型胶原酶,37℃消化 5~6 min,吹打数次,将细胞膜混合液于200目滤网过滤,制备得到粗制的颗粒细胞悬液,将滤液离心3次(1 000 r/min,8 min),清洗残存的胶原酶,以及细胞碎片和少许的卵黄物质。沉淀的颗粒细胞加入10.0%胎牛血清M199培养液制备成颗粒细胞悬液备用。取少量细胞悬液加入等体积0.1%台盼蓝,用血球计数板计数,细胞存活率在90%以上。
1.3 籽鹅卵泡颗粒细胞生长曲线的绘制
1.3.1 细胞计数法 分离颗粒细胞以2×105cells/ml密度接种于96孔板的40个孔,体积分数5%CO2,37℃CO2培养箱静置培养。每天取4个孔的细胞进行计数取平均值,每5 d换液,连续10 d。以培养时间轴为横轴,细胞数为纵轴(对数),绘制生长曲线。
1.3.2 WST-1法 分离颗粒细胞以 2×105cells/ml密度接种于96孔板的40个孔,体积分数5%CO2,37℃CO2培养箱静置培养。每天取4个孔的细胞,每孔加入200μl配置好的WST-1工作液,37℃,孵育4 h,将96孔板置于摇床上摇动1 min,以充分混匀待检测体系。在450 nm测定吸光度。
1.4 ENO1腺病毒过表达载体转染原代培养颗粒细胞模型的建立
将分离的颗粒细胞以1×106cells/ml的密度接种于12孔板,置于5%O2,37℃恒温培养箱静置培养。倒置显微镜下观察,培养的颗粒细胞约12孔板底约70%~80%时,换液。加入含有ENO1过表达病毒的病毒培养液。根据相关资料,以不同感染复数值(multiplicity of infection,MOI)100、250、350和 400 pfu/cell,将ENO1腺病毒过表达载体液转染培养的颗粒细胞。该腺病毒载体携带增强型绿色荧光蛋白基因(GFP),于感染后 24 h、48 h,在荧光显微镜下观察GFP的表达。荧光显微镜下观察感染率大约98%~100%时,细胞状态良好时,即符合实验后续要求。设置ENO1过表达组、腺病毒空载体组、培养液组,依据筛选出的最佳MOI和培养时间进行试验,收集细胞悬液和细胞备用。
1.5 ENO1 mRNA的表达
Trizol法提取颗粒细胞总RNA,反转录生成cDNA。ENO1的上游引物:5′-GCGGTGCCTCAACTGGAA TT-3′,下 游 引物:5′-CCATGTCCAGCATCAGTTTGTC-3′,扩增片段大小为183 bp。GAPDH为内参,上游引物:5′-GCTGATGCTCCCATGTTCGTGAT-3′,下游引物:5′-GTGGTGCAAGAGGCATTGCTGAC-3′,扩增片 段 大小为86 bp。所有引物由上海生工生物技术有限公司合成。荧光定量 PCR扩增条件为:94℃预变性10 s,94℃ 5 s,56℃ 30 s,72℃ 20 s,45个循环。
1.6 ENO1的表达
收集培养液组、腺病毒空载组和ENO1过表达组细胞,用PBS清洗,加入细胞裂解液裂解细胞,提取总蛋白,应用Bradford比色法检测蛋白含量。每个样品槽内60μl样本进行SDS-PAGE电泳,通过电转法将蛋白从聚丙烯酰胺凝胶上转移到PVDF膜上,转印后的PVDF膜用5%脱脂奶粉4℃封闭过夜后加入一抗(浓度 1∶500),37℃孵育 2 h,TBST洗膜后加入浓度为1∶3 000的二抗(羊抗兔),37℃孵育2 h,TBST洗膜,LICOR Odyssey双色红外激光成像系统扫描出图像。
1.7 双抗体一步夹心法酶联免疫吸附试验 ELISA法检测细胞上清液中孕酮含量
收集培养液组、腺病毒空载组和ENO1过表达组细胞上清液,3 000 r/min,离心10 min去除颗粒和聚合物。-20℃保存。从室温平衡20 min后的铝箔袋中取出所需板条,剩余板条用自封袋密封放回4℃。设置标准品孔和样品孔,标准品孔各加不同浓度的标准品50μl;样本孔先加待测样本10μl,再加样本稀释液40μl;空白孔不加。除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100μl,用封板膜封住反应孔,37℃水浴锅或恒温箱温育60 min。弃去液体,吸水纸上吸干,每孔加满洗涤液(×20洗涤缓冲液的稀释:蒸馏水按1∶20稀释,即1份的×20洗涤缓冲液加19份的蒸馏水),静置1 min,甩去洗涤液,吸水纸上吸干,如此重复5次(也可用洗板器洗板)。每孔加入底物A、B各50μl,37℃避光孵育 15 min。每孔加入终止液50μl,15 min内,在450 nm波长处测定各孔的OD值。
绘制标准曲线:在Excel工作表中,以标准品浓度作横坐标,对应OD值作纵坐标,绘制标准品线性回归曲线,按曲线方程计算各样本浓度值。
1.8 统计学分析
实验数据用均数±标准差(x±s)表示,数据采用SPSS17.0统计软件处理,进行ANOVA对数据进行方差分析。
2 结果
2.1 ENO1腺病毒过表达载体转染原代培养颗粒细胞
荧光倒置显微镜下观察,当MOI为100和200时,细胞生长良好,但即使培养48 h,感染率仍然较低,当MOI为350转染48 h,观察可发现感染可达100%,且细胞依然生长良好,细胞凋亡不明显。当MOI增至400时,转染24 h,即可见细胞生长状态差,缩成圆形,细胞内空泡增多,逐步趋向凋亡。综合细胞生长状态和转染率,当 MOI为350,转染48 h为ENO1腺病毒过表达载体转染籽鹅颗粒细胞最佳条件(图 1)。
2.2 细胞生长曲线绘制
细胞计数法和WST-1法所作的生长曲线均表现为1~2 d生长缓慢,2~6 d进入对数生长期并增殖到高峰,7~10 d细胞生长处于停滞状态并逐渐进入衰亡期(图2)。
2.3 荧光定量检测ENO1 mRNA表达情况
培养液组和腺病毒空载体组ENO1 mRNA表达量无明显差异;与培养液组和腺病毒空载体组相比,过表达组中ENO1 mRNA表达量升高极显著(P<0.01)。
2.4 Western blot结果
2.4.1 ENO1与β-actin的表达 Western blot检测培养液组、腺病毒空载体组和ENO1过表达组中ENO1与β-actin蛋白表达结果,47 kD处为ENO1,43 kD处为β-actin(图 3)。
2.4.2 ENO1/β-actin半定量分析结果 对培养液组、腺病毒空载体组和过表达组间ENO1反应条带进行半定量分析,与培养液组和腺病毒空载体组进行比较,培养液组和腺病毒空载体组进行比较无明显差异,与培养液组和腺病毒空载体组相比较,过表达组中ENO1表达极显著升高(P<0.01)。
2.5 ELISA检测细胞上清液中孕酮含量
与培养液组和腺病毒空载体组相比较,ENO1过表达组孕酮量极显著增多(P<0.01,图5)。

Fig.1 Granulosa cell transfected with different titers of adenavirus and transfected time(×200)A:Light microscope;B:Fluorescence microscope;A1:MOI=100,24 h;B1;MOI=100,24 h;A2:MOI=100,48 h;B2;MOI=100,48 h;A3:MOI=250,24 h;B3;MOI=250,24 h;A4:MOI=250,48 h;B4:MOI=250,48 h;A5:MOI=350,24 h;B5:MOI=350,24 h;A6:MOI=350,48 h;B6:MOI=350,48 h;A7:MOI=400,24 h;B7:MOI=400,24 h
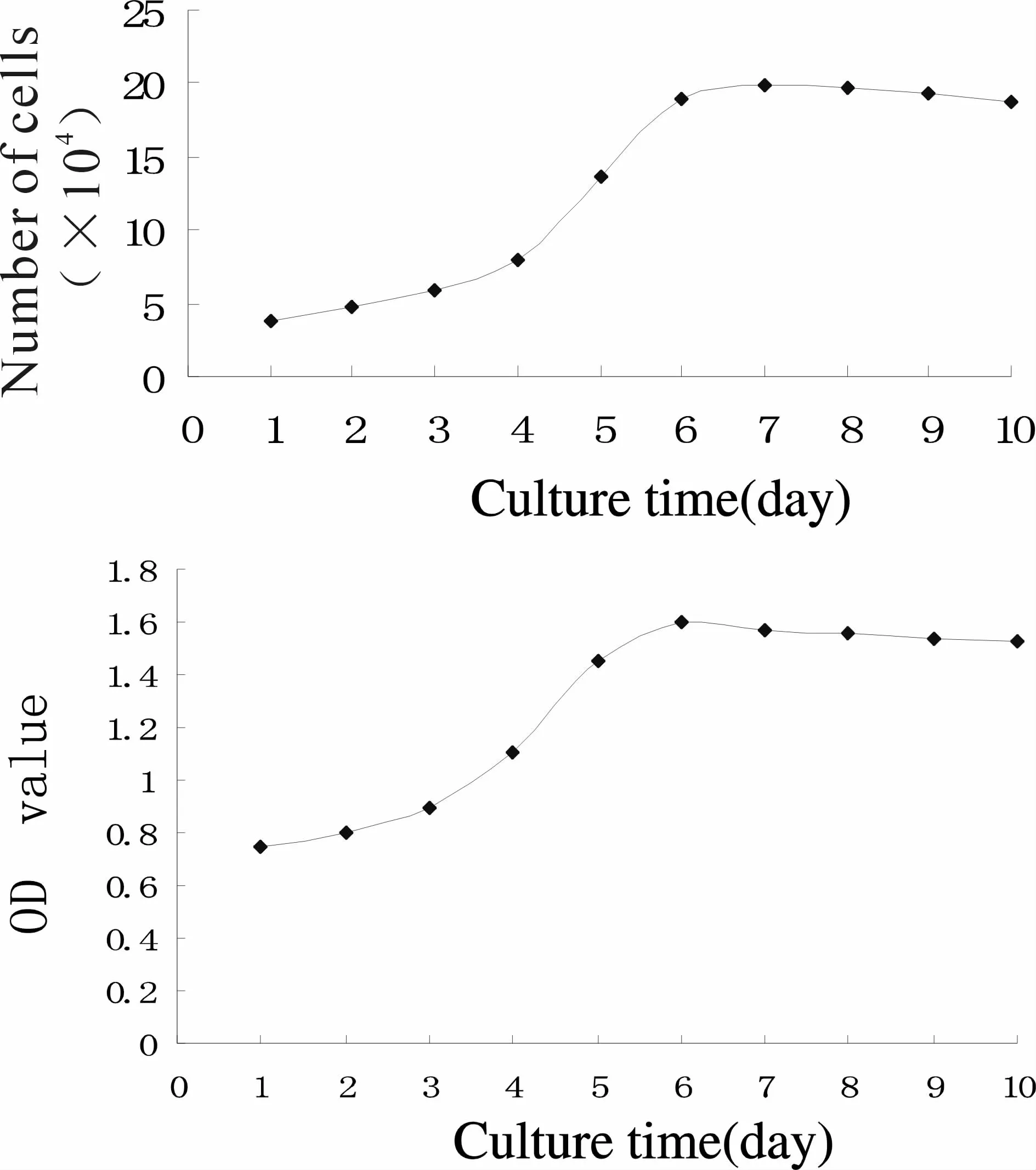
Fig.2 Growth Curve
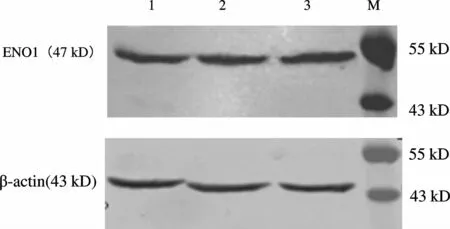
Fig.3 Western blot assay detected ENO1 expression1:Control group;2:Ad-CMV-Null group;3:Ad-CMVENO1 group;M:Mark;ENO1:α-enolase
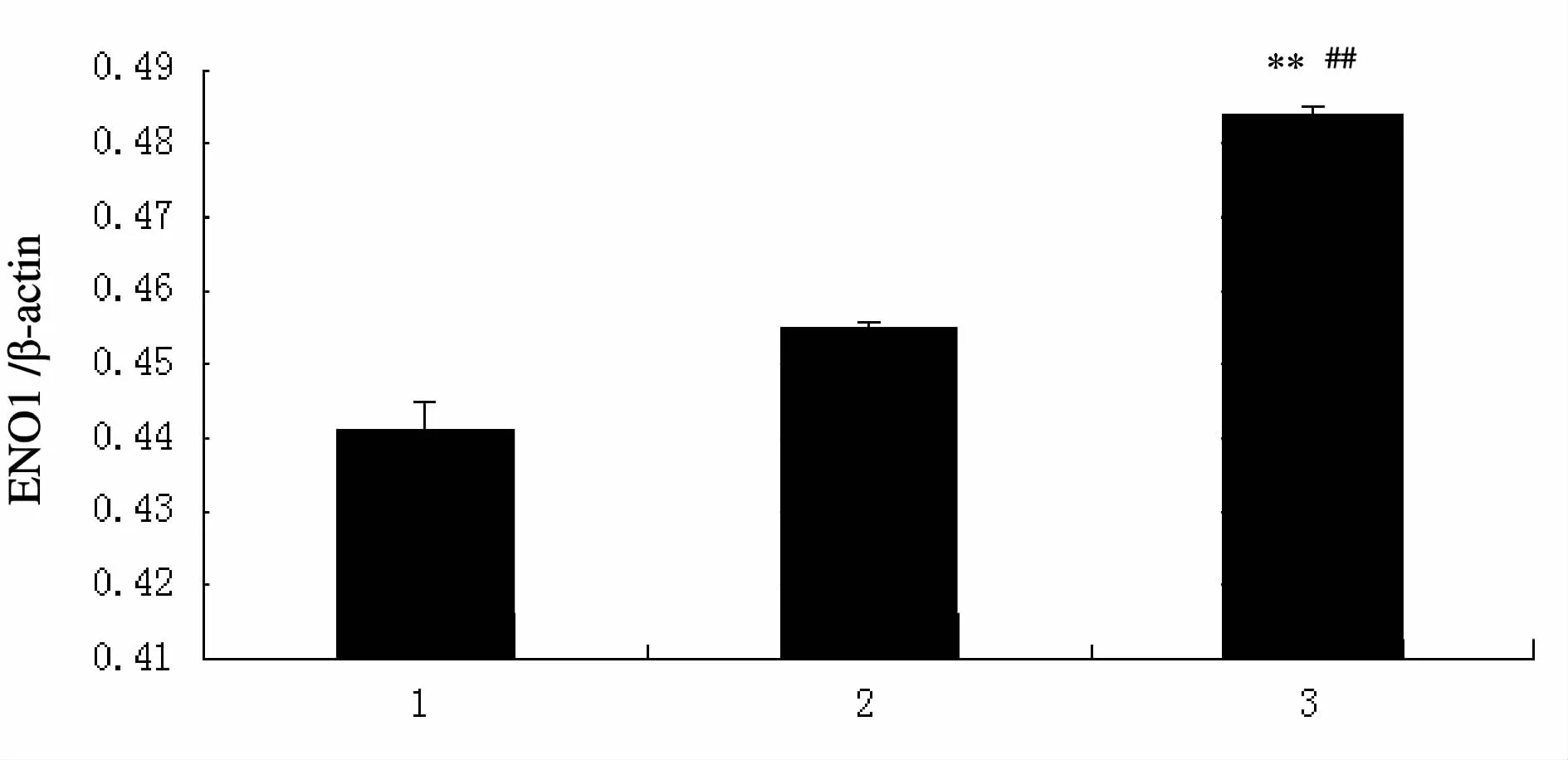
Fig.4 ENO1 protein in different groups1:Control group;2:Ad-CMV-Null group;3:Ad-CMV-ENO1 group;ENO1:α-enolase**P<0.01 vs control group,##P<0.01 vs Ad-CMVNull group
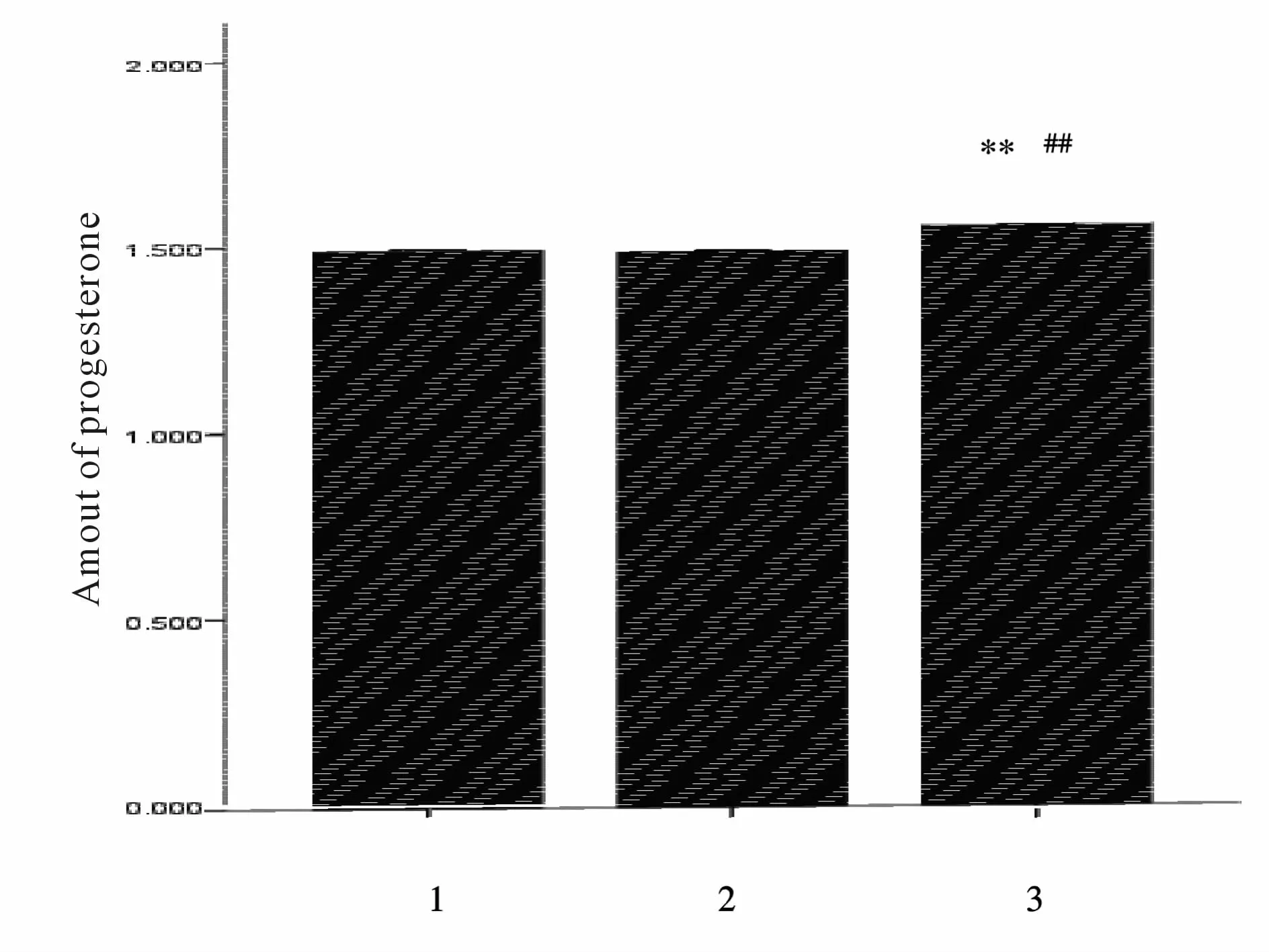
Fig.5 Progesterone in different groups1:Control group;2:Ad-CMV-Null group;3:Ad-CMV-ENO1 group;ENO1:α-enolase**P<0.01 vs control group,##P<0.01 vs Ad-CMVNull group
3 讨论
细胞的生命活动时刻需要能量的供给,ENOl正是通过调节细胞的产能过程,维持细胞ATP水平,保证细胞的存活及其生理功能的执行。ENO1在细胞能量代谢过程中起重要的作用,许多快速增殖的细胞或者组织主要是通过糖酵解途径获取能量。卵巢卵泡是生长最快的正常组织之一,而与卵母细胞一起构成卵泡的颗粒细胞与内膜细胞的分化则是其生长的主要原因。有研究显示糖酵解是卵巢内卵泡发育主要的供能方式,即葡萄糖通过内膜血管进入卵泡中参加相关能量代谢,在颗粒细胞中发生糖酵解反应。研究发现籽鹅快速生长的卵泡中ENO1相对表达量是原始卵泡中表达量的 2.34倍(P<0.05)[4],所以我们推测 ENO1过表达可能通过促进卵泡颗粒细胞的增殖和分化及有关激素分泌,进而调控卵泡发育。颗粒细胞是体外研究禽类卵泡发育的良好模型。卵泡颗粒细胞核膜细胞的相互作用是卵泡发育和维持正常功能的重要条件。因此我们首先构建了籽鹅卵泡颗粒细胞ENO1过表达模型。
孕酮是一种类固醇激素[5],可在卵巢内合成,但在卵泡不同发育阶段,颗粒细胞、膜细胞/基质细胞、黄体细胞均能够分泌孕酮。禽产蛋性能与性腺激素分泌水平密切相关,孕酮是其中一个重要的内分泌激素。研究表明,排卵前大卵泡(F1-F6,直径大于15 mm)颗粒细胞合成孕酮的能力随卵泡成熟逐渐增强,F1卵泡时达到高峰[6]。颗粒细胞分泌孕酮增加,促进LH峰出现,从而进行排卵。本研究结果显示ENO1过表达会促进体外培养的颗粒细胞分泌孕酮量极显著增加。由此推测ENO1过表达可能会促进卵泡排卵。本试验研究结果进一步丰富禽类产蛋过程中激素分泌理论,为生产实践和科学研究奠定基础。
[1] Uhm SJ,Gupta MK,Yang JH.et al.Epidermal growth factor can be used in lieu of follicle-stimulating hormone for nuclear maturation of porcine oocytes in vitro[J].Theriogenol,2010,73(8):1024-1036.
[2] Sutton-McDowall ML,Gilchrist RB,Thompson JG.The pivotal role of glucose metabolism in deter mining oocyte developmental competence[J].Reproduction,2010,139(4):685-695.
[3] Gilbert AB,Evans AJ,Perry MM,et al.A method for separating the granulose cells,the basal lamina and the theca of the preovulatory ovarian follicle of the domestic fowl(Gallus domesticus)[J].Reprod Fertil,1977,50(1):179-181.
[4] 王 丹,郭景茹,刘胜军,等.籽鹅卵巢产蛋性能相关基因全长cDNA序列的克隆与分析[J].中国生物制品杂志,2010,23(12):1320-1324.
[5] 王小引,李晓娟,李东亮,等.孕酮通过抑制iNOS的表达和NO的生成保护新生鼠缺氧缺血性脑损伤[J].中国应用生理学杂志,2012,28(3):253-255.
[6] Schuster MK,Schmierer B,Shkumatava,et al.Activin A and follicle-stimulating hormone control tight Junctions in avian granulosa cells by regulating occludin expression[J].Bio Reprod,2004,70(5):1493-1499.
