缺血后处理对大鼠再灌注损伤肺细胞凋亡的影响*
2014-01-22贾旭广刘亚坤陈海娥马迎春王万铁
石 璐,贾旭广,罗 岷,刘亚坤,赵 珊,陈海娥,马迎春,陈 丹,王万铁△
近年来,随着心胸外科手术的广泛开展,肺动脉袖状切除、肺移植、心肺联合移植、肺溶栓治疗等新的医疗方法不断建立和发展,但肺缺血/再灌注损伤(lung ischemia reperfusion injury,LIRI)始终是影响溶栓及移植后预后的一个重要因素。但迄今为止,LIRI的发生机制尚未完全阐明,有研究证实肺缺血再灌注损伤诱导了细胞凋亡[1]。
缺血后处理(ischemic postconditioning,IPostC)即长时间缺血后再灌注前短时间内反复短暂再缺血处理,可调动机体内源性保护机制,明显减轻缺血组织的缺血/再灌注损伤[2]。近年来有研究发现 IPostC对肺组织具有保护作用[3],但对这种保护作用的观察主要集中在生化指标的改变,而IPostC对LIRI时肺组织细胞凋亡影响的研究鲜有报导。本研究在大鼠LIRI模型上观察IPostC对LIRI过程中细胞凋亡及其相关基因影响,并探讨其作用机制,为临床防治LIRI提供实验依据。
1 材料与方法
1.1 材料
健康雄性成年SD大鼠24只,体重(220~250)g,由上海斯莱克实验动物有限责任公司提供(许可号:2007-0005)。MDA、SOD、MPO试剂盒购自南京建成公司,Bcl-2、Bax鼠多克隆抗体购自美国santa cruz公司,In Situ Cell Death Detection Kit购自瑞士Roche公司,Trizol购自美国invitrogen公司,cDNA第一链合成试剂盒购自美国fermentas公司,PCR mix购自天根公司。PCR引物由上海捷瑞合成。Bcl-2引物序列:上游:5’-CTTCCAGCCTGAGAGCAACC-3’下游:5’-CATCCCAGCCTCCGTTATCC-3’;Bax引物序列:上游:5’-ATTGGAGATGAACTGGACAAT-3’下 游:5’-CCACAAAGATGGTCACTGTC-3’;β-actin引物序列:上游:5’-CCAGCCATGTACGTTGCTA TCCAG-3’下游:5’-GGAACCGCTCATTGCCAATGGTGA-3’。
1.2 动物模型的制备及分组
实验大鼠随机分为 3组(n=8):(1)对照组(control,C组):左肺门游离后留置阻断带,观察150 min;(2)肺缺血/再灌注组(lung ischemia reperfusion,I/R组):阻断左肺门30 min后开放再灌注120 min;(3)肺缺血/再灌注 +缺血后处理组(ischemic postconditioning,IPostC组):阻断左肺门30 min后给予连续的缺血30 s/再灌注30 s后处理循环3次后再灌注120 min。
1.3 血清指标检测
实验完毕各组动物于颈动脉取血约2 ml,注入空白离心管中,于4℃3 000 r/min离心10 min后取上清即为血清。取各组大鼠血清按试剂盒说明书操作,检测血清中超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)及髓过氧化物酶(myeloperoxidase,MPO)活性及含量。
1.4 原位缺口末端标记法(TUNEL)测定肺组织细胞凋亡
每只大鼠取1张肺组织石蜡切片,脱蜡水化后蛋白酶 K(10μg/mg)37℃消化 20 min;加 TUNEL restion mixture 50微升/片,37℃反应 60 min;加 Convert-POD 37℃反应 30 min;3,3-二氨基联苯胺(DAB)显色;苏木素复染。计算5个高倍视野(×400)下的凋亡细胞数。凋亡指数(apoptosis index,AI)=检测到的凋亡细胞数÷5个高倍视野检测到的细胞总数×100%。
1.5 肺组织Bcl-2、Bax免疫组化分析
肺组织切片常规脱蜡,3%H2O2灭活内源性过氧化物酶;复合消化液暴露抗原,封闭非特异性抗原后滴加1∶100稀释的Ⅰ抗,37℃1 h,阴性对照为PBS替代I抗;滴加生物素化Ⅱ抗IgG,37℃20 min;滴加SABC,37℃20 min;DAB显色3 min,然后苏木素复染、脱水、透明、封片。镜检:显色呈棕黄色为阳性表达。应用美国 IPP6.0(Image-pro plus)彩色图像分析系统测定吸光度(optical density,OD)值。
1.6 RT-PCR测定肺组织Bcl-2、Bax mRNA的表达
用Trizol一步法提取肺组织总RNA,逆转录cDNA的过程参照试剂说明书进行。PCR反应体积12.5μl:cDNA 2.5μl,上下游引物各 0.25μl,PCR mix 6.25μl,双蒸水补足体系。反应条件:94℃变性5 min,然后以94℃30 s,退火 Bcl-2为66℃ 45 s,Bax为55℃ 45 s,延伸72℃45 s,循环次数:Bcl-2为30次,Bax为 35次,最后 72℃ 7 min。PCR产物以1.5%琼脂糖凝胶电泳分离和溴化乙锭染色后,用凝胶成像及定量扫描仪测得。用gelpro analyze分析软件分析电泳图,用内参β-actin的灰度值校正计算Bcl-2、Bax mRNA的相对含量。
1.7 统计学处理
计量资料均进行正态性检验,以均数±标准差(¯x±s)形式表示,采用 SPSS 16.0软件进行统计分析。多组样本均数比较进行方差齐性检验,组间比较采用单因素方差分析(one-way ANOVA),方差齐性者两两比较采用LSD法,方差不齐者进行Dunnet’s t检验。双变量相关性分析,采用Bivariate过程的Pearson相关分析法。
2 结果
2.1 氧化-抗氧化系统检测结果
与C组比较,I/R组血清SOD活性显著降低;MDA含量和 MPO活力显著升高(均 P<0.01),IPostC组与 I/R组相比,MDA含量显著降低(P<0.05),MPO活力显著降低(P<0.01),SOD活性升高(P<0.01,表 1)。
2.2 肺组织原位细胞凋亡检测结果
肺组织原位细胞凋亡检测示,I/R组凋亡指数(39.03±3.46)显著高于 C组(2.88±0.34),IPostC组 AI(8.03±0.88)显著低于 I/R组(均 P<0.01)。凋亡细胞主要为肺泡上皮细胞与血管内皮细胞(棕黄色凋亡细胞颗粒)(表2,图1,见彩图页Ⅲ)。
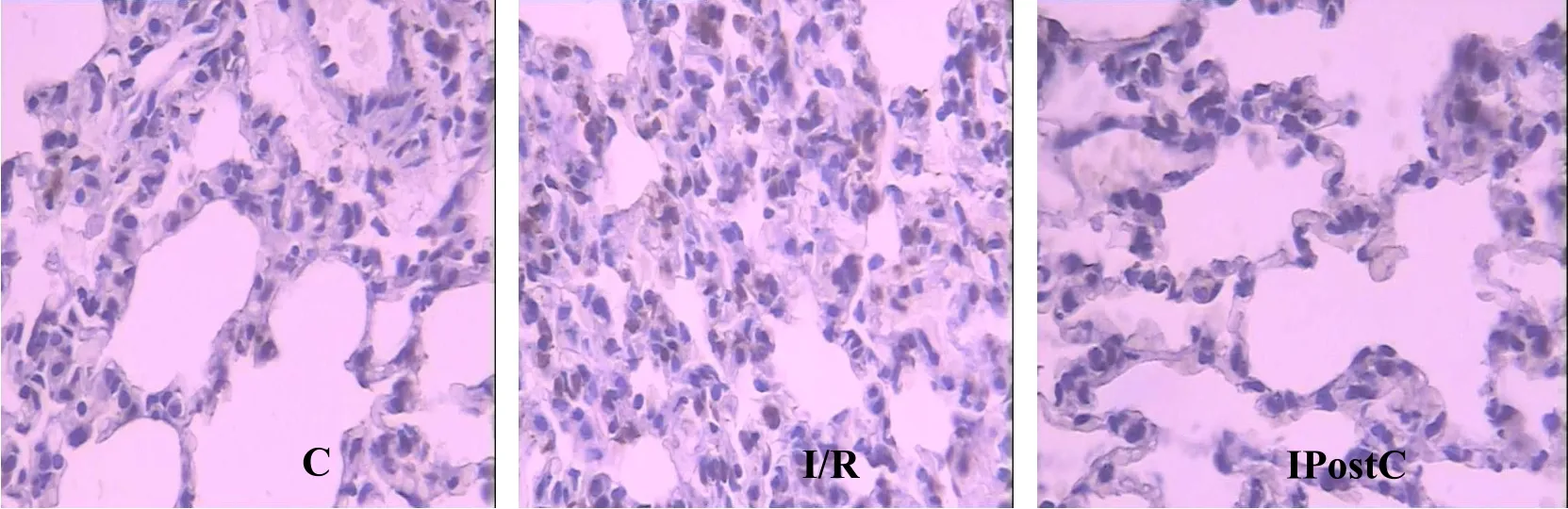
Fig. 1 Apoptotic cells in lung tissue of each group(DAB ×400)C:Control group;I/R:Ischemia/ reperfusion group;IPostC:Ischemic postconditioning group

Tab.1 Changes of the content of MDA and the activity of MPO,SOD in serum of rat in different groups(¯x±s,n=8)

Tab.2 Comparision of apoptosis index in lung tissue of rats by TUNEL among groups(%,¯x±s,n=8)
2.3 肺组织Bcl-2、Bax免疫组化检测结果
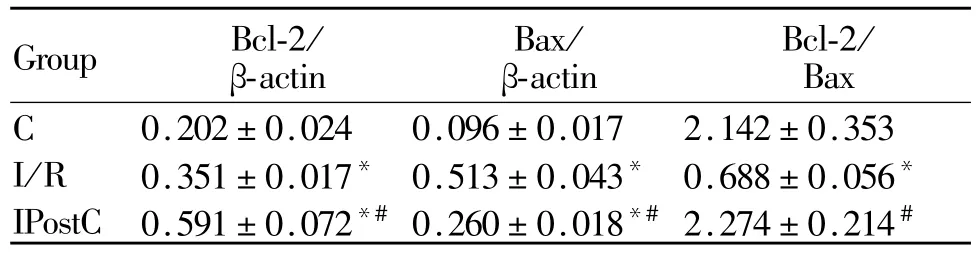
肺组织Bcl-2、Bax蛋白表达呈棕黄色为阳性表达。在C组表达不明显,I/R组表达较C组明显上调,同时 Bcl-2/Bax的比值降低(均 P<0.01,表 3);与I/R组比较,IPostC组 Bcl-2蛋白表达增强(P<0.05),Bax表达明显减弱,Bcl-2/Bax的比值增高(均P<0.01,图 2、图 3,见彩图页Ⅲ)。
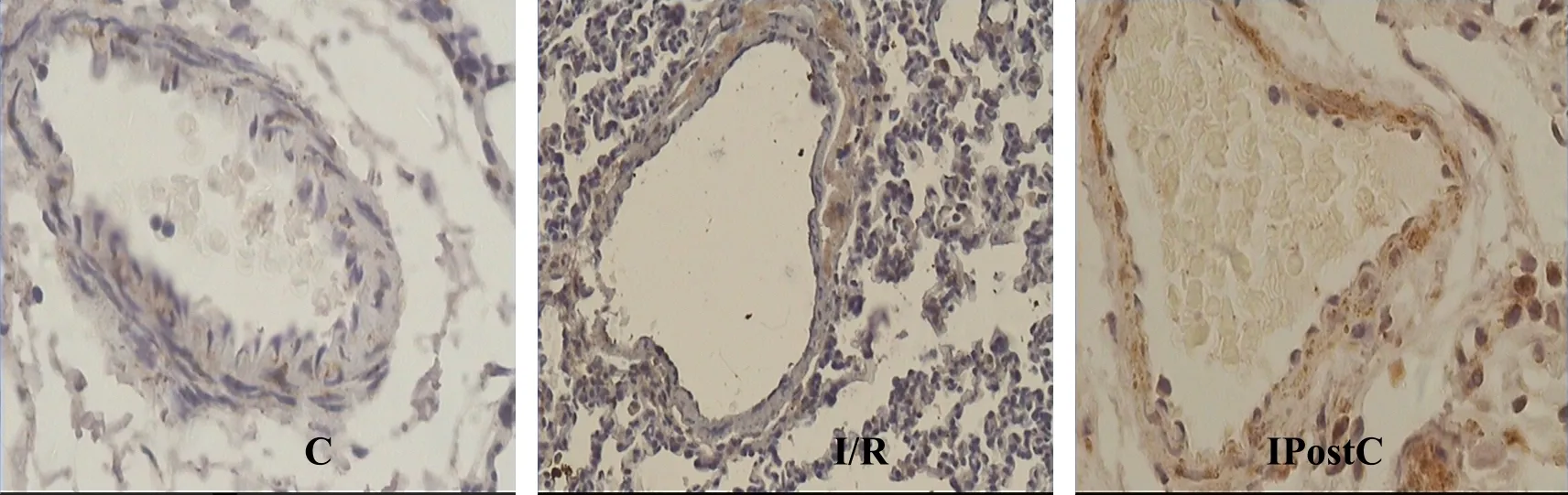
Fig. 2 Positive expression of Bcl-2 protein in lung tissue of each group(DAB ×400)C:Control group;I/R:Ischemia/ reperfusion group ;IPostC:Ischemic postconditioning group
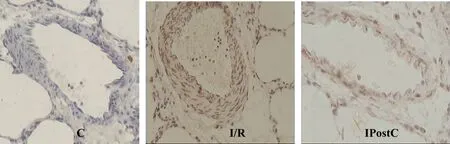
Fig. 3 Expression of Bax protein in lung tissue of each group(DAB ×400)C:Control group;I/R:Ischemia/ reperfusion group ;IPostC:Ischemic postconditioning group
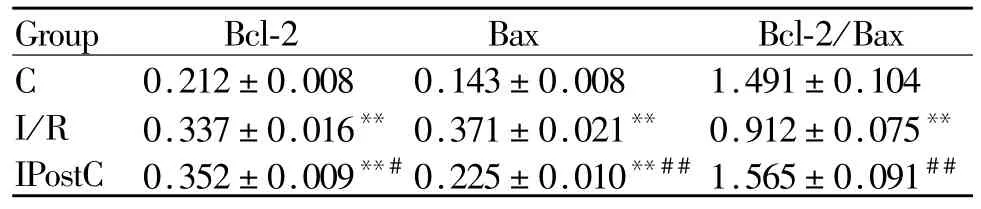
Tab.3 Optical density of Bcl-2、Bax of lung tissues in different groups and ratio of Bcl-2/Bax protein(¯x±s,n=8)
2.4 肺组织Bcl-2、Bax mRNA的表达
在C组表达不明显,I/R组表达较C组明显上调,同时 Bcl-2/Bax的比值降低(均 P<0.05,表 4);与I/R组比较,IPostC组 Bcl-2 mRNA表达增强,Bax mRNA表达减弱,Bcl-2/Bax的比值增高(均 P<0.05,图 4、图 5)。
Tab.4 Reletive amout of Bcl-2、Bax mRNA and ratio of Bcl-2/Bax mRNA in lung tissue in 3 groups(¯x±s,n=8)

Fig.4 RT-PCR electrophoresis strip of Bcl-2 in lung tissue of each group1、4:Control group;2、5:LIR group;3、6:LIR+ IPostC group;M:Marker;LIR:Lung ischemic reperfusion;IpostC:Ischemic postconditioning
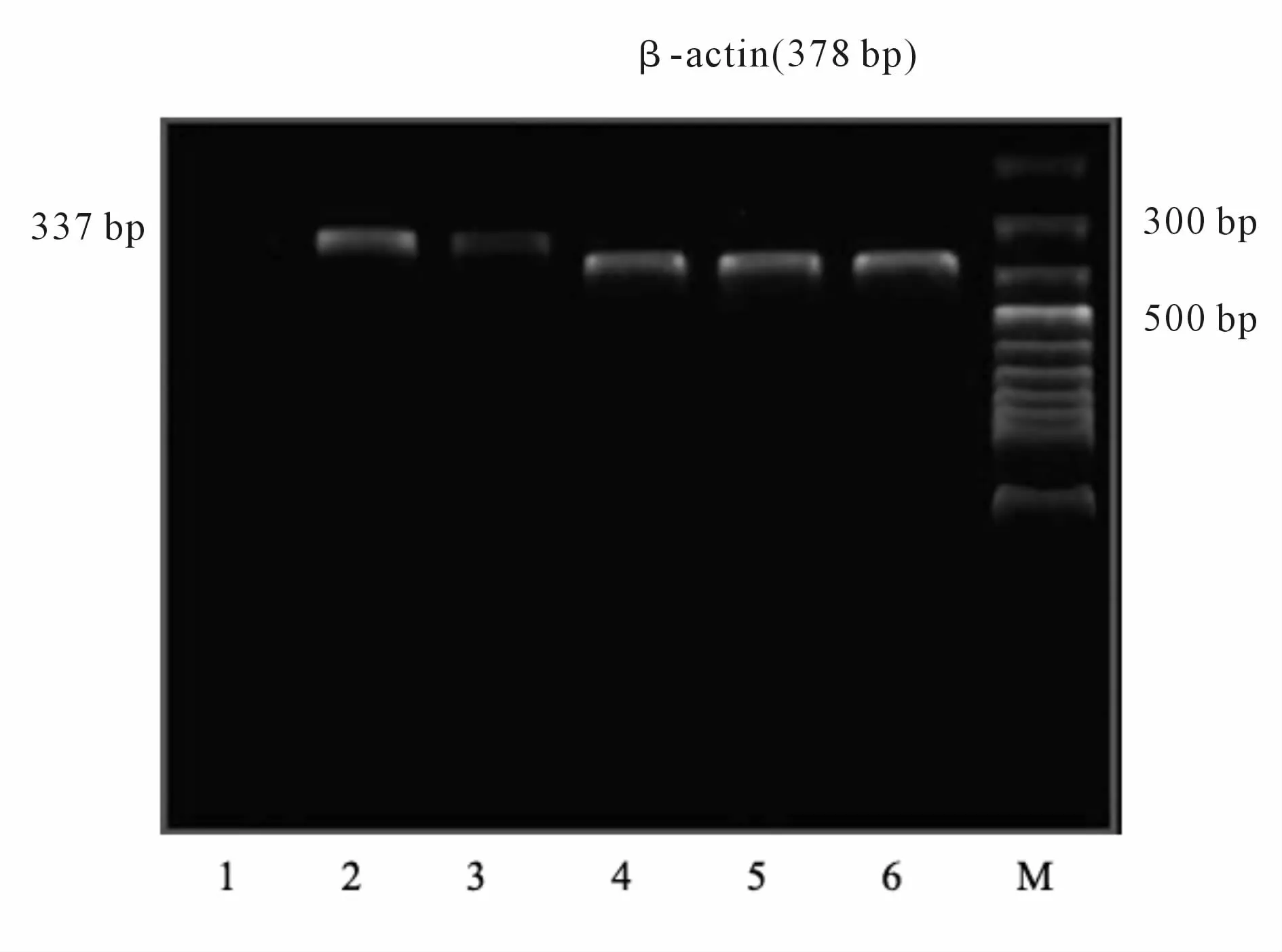
Fig.5 RT-PCR electrophoresis strip of Bax in lung tissue of each group1、4:Control group;2、5:LIR group;3、6:LIR+ IPostC group;M:Marker;LIR:Lung ischemic reperfusion;IpostC:Ischemic postconditioning
2.5 相关性分析
肺组织细胞凋亡指数AI与MDA、MPO呈显著正相关(P<0.01);凋亡指数与 SOD、Bcl-2/Bax蛋白比值、Bcl-2/BaxmRNA比值均呈显著负相关(均 P<0.01)。
3 讨论
肺缺血/再灌注损伤可在多种临床情况下发生,包括心肺转流、肺栓塞及肺移植等。介导LIRI的病理生理机制较复杂,目前认为主要与白细胞活化、炎症介质的释放、氧自由基的产生等有关,从而导致肺泡-毛细血管屏障渗透性增高、中性粒细胞渗出、间质与肺泡水肿、组织炎症与细胞损伤等一系列病理变化,最终引起肺组织细胞的坏死或凋亡。Fischer等学者[4]发现,缺血/再灌损伤能促进供肺移植后再灌早期肺组织细胞的凋亡,过度的凋亡以导致肺功能的受损。本实验TUNEL法结果发现,对照组偶见细胞凋亡;I/R组细胞凋亡较对照组明显增加,凋亡细胞主要为肺泡上皮细胞及血管内皮细胞;相关分析结果表明肺组织细胞凋亡指数与MDA、MPO呈显著正相关,与SOD呈显著负相关。结果说明了细胞凋亡可能是LIRI的机制之一,而氧自由基的产生、中性粒细胞的聚集等多种因素参与诱导细胞的凋亡的发生。
细胞凋亡又被称为程序化细胞死亡,是细胞接受某种信号后或受到某些因素剌激后的一种主动的,由一些凋亡相关基因相互作用的细胞死亡过程。Bcl-2家族蛋白是在细胞凋亡过程中起关键作用的一类蛋白质[5]。Bcl-2是重要的抗细胞凋亡基因,在I/R损伤中表现得尤为突出。Bax基因与Bcl-2基因具有高度同源的序列,但其作用与Bcl-2基因相反,属于促凋亡基因。Bcl-2高表达时,可形成 Bcl-2/Bcl-2同源二聚体,也可形成Bcl-2/Bax异源二聚体,均起抑制凋亡作用[6]。近年来也有研究表明Bcl-2/Bax异源二聚体有助于减轻肺组织凋亡,减轻肺损伤[7]。本研究采用免疫组织化学与 RT-PCR的方法,观察到缺血/再灌注后肺组织Bcl-2、Bax表达明显上调,Bcl-2/Bax下降;且肺组织细胞AI与Bax呈正相关,而与Bcl-2/Bax比值呈负相关,提示 Bcl-2、Bax基因参与LIRI,而且再灌注后Bcl-2/Bax的比例下降是促进凋亡的重要因素。
缺血后处理作为机体一种潜在性的、内源性的保护措施,已经在心[8]、脑[9]、肾[10]等组织缺血实验中得以证实,它能使组织增加自身对缺血/再灌损伤的耐性。目前有实验亦证实,IPostC能减轻肺组织缺血/再灌损伤[3,4],但对肺组织细胞凋亡的影响还未见报道。本实验结果发现,IPostC组细胞凋亡较I/R组明显减轻;SOD活性明显升高,MDA含量、MPO活力明显下降;Bax蛋白和Bax mRNA表达显著下调;Bcl-2蛋白和Bcl-2 mRNA表达上调;Bcl-2/Bax的比值明显升高。而且AI与Bax呈正相关,与Bcl-2/Bax比值呈负相关,提示IPostC可能是通过减轻脂质过氧化反应,减少中性粒细胞的聚集,下调促凋亡基因Bax的表达,提高Bcl-2/Bax比值来抑制细胞凋亡,从而保护再灌注损伤肺组织的。
[1] Stammberger U,Gaspert A,Hillinger S,et al.Apoptosis induced by ischemia and reperfusion in experimental lung transplantation[J].Ann Thorac Surg,2000,69(5):1532-1536.
[2] Zhao ZQ,Corvera JS,Halkos ME,et al.Inhibition of myocardial injury by ischemic Postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003,285(2):H579-588.
[3] 李 奎,白育庭.单次与多次缺血后处理对肺缺血再灌注损伤的实验研究[J].临床外科杂志,2008,16(5):341-343.
[4] Fischer S,Cassivi SD,Xavier AM,et al.Cell death in human lung transplantation:apoptosis induction in human lung during ischemic and after transplantation[J].Ann Surg,2000,231(3):424-431.
[5] Ji HB,Zhai QW,Liu XY,et al.Transcription regulation of bcl-2 gene[J].Acta Biochem Biophys Sin,2000,32(2):95-99.
[6] Chang TH,Liu XY,Zhang XH,et al.Effects of dlpraeruptorin A on interleukin-6 level and Fas,bax,bcl-2 protein expression in ischemia-reperfusion myocardium [J].Acta Pharmacol Sin,2002,23(9):769-774.
[7] 邱晓晓,戴雍月,宋张娟,等.SP600125对大鼠肺缺血/再灌注损伤的保护作用及机制[J].中国应用生理学杂志,2012,28(3):255-258.
[8] 高立威,谢瑞芹,崔 炜,等.不同强度及时间窗骨骼肌缺血后处理对兔心肌的保护作用[J].中国应用生理学杂志,2012,28(1):28-32.
[9] Huang H,Zhang L,Wang Y,et al.Effect of ischemic postconditioning on spinal cord ischemic-reperfusion injury in rabbits[J].Can J Anaesth,2007,54(1):42-48.
[10] Liu X,Chen H,Zhan B,et al.Attenuation of reperfusion injury by renal ischemic postconditioning:The role of NO[J].Biochem Biophys Res Commun,2007,359(3):628-634.
