精氨酸对动物能量代谢的影 响
2014-01-21吕怡航
■吕怡航
(通威股份有限公司惠州分公司,广东惠州516121)
精氨酸(L-arginine)作为一种条件性必需氨基酸,不仅是机体蛋白质的组成成分,而且是一氧化氮(NO)、尿素、多胺、肌酸等活性物质的前体,在促进肌肉蛋白质合成、增强机体的免疫力、细胞分裂伤口复原和激素分泌、繁殖等各种生理过程中起着重要的作用。精氨酸在一氧化氮合酶的作用下催化生成NO。大量研究表明,NO通过影响信号转导、能量代谢和DNA合成等途径在神经、免疫和心血管等系统中具有广泛而复杂的生理和病理作用。近年来研究发现,日粮供应L-arginine,可以减少脂肪沉积,增加了脂肪酸氧化关键基因的表达,并且对肥胖引起的病理反应起到了一定的缓解作用;给生长肥育猪日粮供应L-argi⁃nine也得到类似的结果。有研究表明,肥胖病人皮下脂肪组织中诱导型一氧化氮合酶(iNOS)的表达量高于正常人;而在日粮中添加NOS合酶抑制剂L-NωNi⁃troarginine,发现大鼠体脂含量有所增加。由此可见,精氨酸能够影响脂肪沉积,并且可能是通过NO的作用完成的。
本文就针对精氨酸通过NO对脂类代谢的影响进行综述。
1 精氨酸-NO途径
1.1 一氧化氮合酶性质
精氨酸在一氧化氮合酶(NOS)、BH4、NADPH、Ca2+、钙调素、FMN和FAD等辅助因子的共同催化作用下生成NO。NOS包括三种不同亚型,存在于不同组织器官的不同细胞器中:神经型nNOS、内皮型eNOS和诱导型iNOS。前两种又称为原生型NOS(cNOS),主要存在于内皮细胞和神经细胞,是Ca2+和钙调素(CaM)依赖性的酶;由它们催化生成的NO量较少,一般在10-12mol/l水平,cNOS活性只能维持几秒到几分钟,主要调节细胞的信息传递和其他一些生理功能。iNOS是在内毒素(LPS)、细胞因子(TNF-α、IFN-γ)以及一些病变等诱导下生成的;iNOS存在于巨噬细胞和其他一些细胞,Ca2+和钙调素(CaM)非依赖性的酶,iNOS一经诱导生成,活性可维持数小时到数天,并催化生成大量NO,其水平可高达10-9~10-6mol/l,作为细胞毒分子,在宿主防御功能方面起重要作用,也介导疾病的发生。NOSs是双域结构,N-端是氧化酶区,主要连接的位点有血红素、BH4和L-arginine;而C-端是还原酶区,主要连接的位点有FAD、FMN和NADPH,这两功能区通过CaM识别位点连接到一起。氧化酶和还原酶区通过限制性蛋白水解酶作用,从而进行各种表达系统高水平的表达。在人eNOS和鼠iNOS中发现,分隔开的两区域具有催化活性,并且通过氧化酶区和还原酶区的连接完成NO的合成。由于它可以和Ca2+、钙调素紧密连接,当外源Ca2+和钙调素缺乏时,iNOS的活性就会很大。相对于通过iN⁃OS催化生成NO的量,eNOS和nNOS催化生成的NO少。大量研究表明,NO的合成不仅受NOS蛋白磷酸化量的调控,而且也与辅助因子(尤其是NADPH、BH4和Ca2+)和精氨酸有关。虽然NOS对于精氨酸的Km值是3~20 μM,增加胞外精氨酸的浓度从0.05到5 mM,但增加了NO合成,并且激活了巨噬细胞和上皮细胞。精氨酸增加了巨噬细胞中iNOS的转录和上皮中BH4的合成,此外,精氨酸-NO途径通过各种氨基酸调节,包括谷氨酰胺、赖氨酸、谷氨酸、苯丙氨酸和牛磺酸。
1.2 NO合酶在脂肪组织中的分布
脂肪组织是最大的脂质贮藏和脂类代谢部位,由白色脂肪组织和棕色脂肪组织组成,不同的动物在不同的阶段两种脂肪组织的含量不同。
白色脂肪组织是体脂的主要成分,广泛分布在体内皮下组织和内脏周围,主要功能是将体内过剩的能量以中性脂肪的形式储存起来,以供机体在需要的时候使用,随着年龄的增长而增加,是脂类代谢的主要场所。C.Ribiere等研究发现,白色脂肪组织中的脂肪细胞在经过LPS处理后,发现细胞膜和胞质中都有iNOS的分布,而细胞膜上还有eNOS分布,蛋白质印迹结果见图1,表明内毒素处理过脂肪组织是NO生成的重要部位。Montserrat Elizalde等研究肥胖人群和非肥胖人群皮下脂肪组织中NOS的表达情况,发现人类皮下脂肪组织中存在eNOS和iNOS,但是不存在nNOS,而肥胖人群中这两种合酶的基因表达和蛋白水平都有所增加,从而增加了NO的生成。
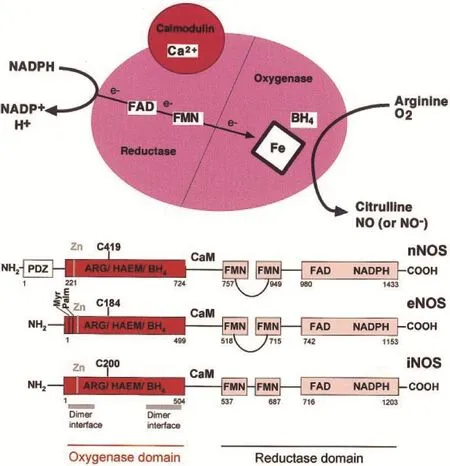
图1 蛋白质印迹结果
棕色脂肪组织主要分布在人体的肩胛骨间、颈背部、腋窝、纵膈及肾脏周围,随着年龄的增长,体内棕色脂肪组织逐渐减少。Antonio Giordano等对大鼠棕色脂肪组织中NO合酶的分布和活性进行研究发现,细胞质和细胞核中有eNOS和iNOS分布,不存在nNOS。体内试验发现,通过冷应激或β-肾上腺素处理大鼠,棕色脂肪组织中eNOS和iNOS的表达量显著高于对照组;体外试验,通过去甲肾上腺素处理分离培养的棕色脂肪细胞,也得到类似的结果。
由上可知,NOS在脂肪组织的分布有差异,各种亚型在细胞膜、细胞质、细胞核中的表达量不同:褐色脂肪组织中eNOS在细胞质和细胞膜上表达,iNOS在胞内和细胞核中表达;而在白色脂肪细胞核中,eNOS和iNOS是不表达的,仅在胞内和细胞膜中。在褐色和白色脂肪中nNOS是很少表达的(见表1)。

表1 NO合酶不同亚型在脂肪组织中的分布
1.3 Arg-NO途径与脂类代谢的关系
脂肪组织作为最大的脂质贮藏和脂类代谢部位,其中存在iNOS和eNOS,提示我们Arg-NO途径与脂类代谢有一定的相关性。Abdelkrim等(1999)研究发现,日粮中添加0.02%L-Nω硝基精氨酸(L-NNA)(NOS抑制剂),增加了血清中甘油三酯的含量和体脂,在添加了4%的L-arginine后这种效应得到了缓解。Wenjiang J等(2005)研究发现,日粮供应L-argi⁃nine给ZDF大鼠,能够增强NOS的活性,从而减少脂肪沉积。
由此可知,正常情况下L-arginine可以通过NO途径调节脂类代谢,而在肥胖或与肥胖相关的疾病情况下,皮下脂肪组织可以内源性的调节NOS的活性,进而通过NO途径调节脂类代谢。
2 NO对脂类代谢的影响
脂解作用是指储存在脂肪细胞中的脂肪分解及脂肪酸和甘油的释放过程,脂解作用受激素和脂滴包被蛋白调控,而精氨酸可以通过精氨酸-NO途径影响脂肪组织脂解作用。
2.1 对激素敏感脂酶的影响
激素敏感脂酶是动物体脂肪分解的关键酶,它能水解甘油三酯成甘油和脂肪酸以满足动物体的需要;HSL的活性受磷酸化或去磷酸化作用的调控,当无活性型受到cAMP-依赖型蛋白激酶的催化而被ATP磷酸化后,就转变为活性型;而活性型则可通过作用于脂肪酶的磷酸脂酶去磷酸化而失去活性。
2.2 对AMPK的影响
AMPK在调节脂类代谢中起着重要的作用,它是一个异源三聚体,包括三个亚基:一个催化亚基α和调节亚基β和γ。AMPK作为一个细胞能量感受器,当AMP/ATP比例增加时被激活。AMPK的激活通过上游区确定的AMPK激酶LKB1激活。AMPK主要的作用就是关闭ATP消耗途径而打开ATP生成途径,像脂肪酸和糖的氧化。大量实验证明,AMPK的活性是通过蛋白磷酸化和去磷酸化实现的,但是蛋白水平的变化可能通过基因转录水平和蛋白质降解进行调节。
AMPK对能量代谢的调节是多条途径的。具有活性的AMPK磷酸化从而抑制ACC,导致丙酰COA水平减少,而丙酰COA是增加脂肪酸氧化的关键酶。AMPK也激活丙酰COA的脱羧酶,这种酶主要负责丙酰COA的降解。在肝脏、肌肉和脂肪组织中,AMPK抑制了TAG酰基转移酶的活性。AMPK也增强PGC-1α的表达,借此促进线粒体生物合成和氧化磷酸化。AMPK可以增加哺乳动物雷帕霉素靶标的活性和表达,因此增加了脂肪细胞中脂着素的形成。这也导致了脂滴包被蛋白的减少。因此,脂着素能和中性脂滴结合易化TAG的水解。通过多种机制,AMPK调节能量底物分解代谢和氧化。
有大量研究表明,NO与AMPK的表达以及活性有关,这种关系促进了糖和脂肪酸的氧化。有足够证据表明AMPK能够调节NO的产量。eNOS在Ser1177位置被磷酸化,因此生理和病理条件下的AMPK活性导致了NO合成。确实,在人类骨骼肌中AMPK的活性与eNOS的磷酸化相关。进而增加血流和营养物质的吸收,因此促进了糖和脂肪酸的氧化。除了生理刺激外,AMPK还可以被药剂激活。AMPK激活剂——AICAR能增强肌肉细胞中NOS的活性和糖转运。值得注意的是,体内试验和骨骼肌心肌体外培养试验表明,NOS能抑制因AICAR引起的糖摄入减少的程度,表明NO在调节AMPK促进糖类摄入中的重要性。近来研究表明,AMPK的活化减少了iNOS在肌细胞、巨噬细胞核脂肪细胞中的表达,同时也表明了AMPK的抗炎症效应。
虽然AMPK能调节NO合成,但是NO也能调节AMPK活性,通过以下两条途径:①通过过亚硝酸盐改变基因表达和AMPK活性,如日粮供应精氨酸给ZDF大鼠,增加了脂肪细胞中AMPKmRNA的水平将近两倍。②近来,一个新的激活AMPK的途径,是在AMP/ATP比例没有改变的情况下发生的。由于NO和超氧阴离子自发反应产生的过亚硝酸盐,通过c-Src-调节和磷酸肌醇途径激活了AMPK。虽然过亚硝酸盐在高水平(>100 μM)能引起氧化应激,但是在1~10 μM可以激活AMPK。值得注意的是,抗糖尿病药物通过增加过亚硝酸盐的产量能增强AMPK的活性。相反的是,过亚硝酸盐的抑制既可以通过消除超氧阴离子,也可以使用NOS抑制剂减小降血糖药物引起的AMPK活性。重要的是,在eNOS敲除的小鼠,降血糖药物对AMPK的活性没有影响,由此可知内源NO合成在AMPK活性调节中的重要性。通过过亚硝酸盐激活PI3K活性,可以专一地增加AMPK与上游激酶LKB1的结合。由此可知,生理水平的自由基是代谢调节的信号分子。
Wenjuan Jobgen等研究发现,无论是基因诱导型肥胖还是日粮诱导型肥胖,通过饮用水添加1.51%L-arginine-HCl可以显著减少脂肪组织沉积,并且在日粮诱导型大鼠的试验中还可以增加棕色脂肪的含量。而Bie Tan等在生长肥育猪日粮中添加1.0%L-arginine-HCl,发现骨骼肌增加了5.5%,体脂减少了11%;Qinglma He等也得到类似的结果。
脂解作用受激素和脂滴包被蛋白的调控。脂滴包被蛋白是一种包裹在脂肪滴外面,在非磷酸化条件下对脂滴起保护作用避免脂解作用的蛋白质。脂滴包被蛋白是PAT-家族成员,包括脂滴包被蛋白、adi⁃pophilin和TIP47。这些蛋白与中性脂滴相连,与脂滴有相似的核苷酸序列。现在,adipophilin和TIP47在脂肪代谢中的精细作用还不清楚。关于肾上腺素能和其他促进剂激活的脂解作用,HSL和脂滴包被蛋白都是通过cGMP途径被磷酸化,HSL还通过PKA和AMPK被磷酸化。磷酸化激活了HSL也促进了脂滴包被蛋白与HSL的互作效应。HSL从细胞质中到脂滴表面时激活了脂解作用。胰高血糖素和β-肾上腺素能激活剂通过鸟苷酸环化酶增加了胞内cAMP的水平,而胰岛素通过调节磷酸二酯酶-3B的活性减少了胞内cAMP的浓度。同样,鸟苷酸环化酶激活剂增加cGMP的水平,通过增加cGMP的水平,抑制磷酸二酯酶-5的活性。
线粒体β-氧化途径是短、中、长链脂肪酸氧化的主要途径。长链脂肪酰-CoA通过CPT系统进入线粒体。线粒体长链脂酰CoA经过β-氧化生成乙酰CoA,乙酰辅酶A经过线粒体的三羧酸循环和电子转移系统,生成了CO2、水和ATP。长链、超长链、二羟酸、支链脂肪酸和胆酸衍生物的β-氧化发生在过氧化物酶体,通过肉碱系统进行。长链和支链脂肪酸的β-氧化通过过氧化物酶体ⅠⅡ系统进行,生成的短链脂肪酸进入线粒体完成氧化作用。线粒体的β-氧化通过转录作用完成,NRF、NRF-2、PPAR-α和线粒体为转录因子。过氧化物酶体增殖受体辅助因子上调了cGMP途径中的这些转录因子和UCPs。因此,PGC-1α是线粒体生物合成和氧化磷酸化的主要调节物。和PPAR-α一样,PPAR-β可以通过增加CPT-1和β-氧化酶来增强脂肪酸氧化。过氧化物增殖受体-γ主要在脂肪组织表达,通过增加LPL表达和甘油三酯的合成在脂肪合成和脂贮藏中起主要作用。PPAR-α、PPAR-β和PPAR-γ合成配体包括降血脂药物、HDL和低血糖药物。PPAR的生物配体包括长链和超长链脂肪酸、高脂日粮、肾上腺类固醇、花生四烯酸。有活性的PPAR和VA受体相互作用形成了PPAR/RXR杂二聚体,结合在PPAR上调节一些基因促进的部位。像其他代谢途径一样,虽然关键酶的蛋白质磷酸化和变构提供了脂解和脂肪酸氧化的快速机制,但是长期调节作用最有效的机制是基因表达。
2.3 对棕色脂肪组织脂类代谢的影响
棕色脂肪组织外观呈棕色,细胞内含有大量的脂肪小滴及高浓度的线粒体,细胞间含有丰富的毛细血管和大量的交感神经纤维末梢,组成了一个完整的产热系统。褐色脂肪组织的功能类似一个“产热器”,它主要通过细胞内脂肪酸的非耦联氧化磷酸化分解产热,当机体进食或遇寒冷刺激时大量产热。
3 NO和线粒体功能
3.1 NO和线粒体呼吸
近来,许多研究致力于线粒体NOS的鉴定和NO在线粒体呼吸中的应用。有研究表明,nNOS在哺乳动物的大脑、肝脏、肌肉、心和肾脏线粒体中存在。因此,我们可以推测NO在线粒体氧化和对氧气感受起着重要的作用。NO通过直接的途径调节线粒体的呼吸作用。首先,生理水平的NO调节血流量,因此增加了代谢底物的供应,使氧气到达线粒体。第二,高水平的NO可以直接调节线粒体电子转运系统。如,线粒体中NO的浓度高于生理水平时,内源NO是可逆的连接在细胞色素氧化酶氧接位点上,因此抑制电子转运和氧气的消耗。来自底物氧化的ATP减少,增强了糖酵解。当NO水平高的时候,这种机制在急性氧敏感和低氧环境中起着重要作用。然而,在正常水平以下时,乙酰辅酶A很容易在线粒体中被氧化,因此当iNOS在低水平表达时,内源性NO抑制了线粒体的呼吸作用。
3.2 NO和线粒体的生物合成
NO有益于线粒体的生物合成,即有利于线粒体增殖激活。NO诱导的生物合成是细胞代谢长期调节的关键因素。在哺乳动物各种细胞中,如褐色脂肪细胞、3T3-L1细胞、骨骼肌L6细胞和永生的HeLa细胞,NO触发了线粒体生物合成,增强了与ATP浓度有关的呼吸作用。这一过程通过cGMP信号途径调控,在这一途径中激活了PGC-1α的表达,这是线粒体生物合成和氧化磷酸化的主要调节剂。过氧化物增殖受体辅助激活剂1α是调节PPAR-α表达的关键转录因子,进而调节NRF-1和mtTFA的表达。总之,这些转录调节核酸和线粒体中编码蛋白的基因,这些蛋白涉及呼吸链和线粒体DNA转录与复制,因此,eNOS敲除小鼠抑制了线粒体的水平,减少了能量消耗,增加了脂肪合成。
NO对线粒体的活性主要是为了能量需要。线粒体是葡萄糖、脂肪酸和氨基酸氧化的重要位点,在此进行ATP的合成和一部分作为热量散失。因此,线粒体在能量平衡的调节上是至关重要的。NO可以刺激代谢活性的线粒体形成,内源和外源NO的供应都对抑制肥胖有作用。在大鼠骨骼肌中,通过cGMP途径,氰酸钠(NO供体)增加了葡萄糖、丙酮酸、棕榈酸和亮氨酸。同样地,日粮供应精氨酸给ZDF大鼠增加了PGC-1α的表达和葡萄糖脂肪酸的氧化。这些发现提供了减少脂肪的途径,更加肯定了精氨酸的药效。
4 精氨酸-NO途径在葡萄糖代谢中的应用
4.1 NO与糖元异生和糖元合成
有研究表明,NO在肝脏糖元合成中的重要作用。在肝脏中乳酸和丙酸生成葡萄糖能够被NO供体抑制,并且存在剂量依赖效应。主要机制是通过AMPK调节磷酸烯醇丙酮酸羧激酶的表达被抑制。另一方面,在肝脏细胞核3T3-L1细胞中糖元合成被NO抑制,原因在于糖元合成酶的活性减小。因此,在iNOS诱导的情况下,NO水平的提高被认为增加了肝脏中葡萄糖的释放。有趣的是,通过减小葡萄糖激酶之类的关键酶活性,NO也减少了肝脏细胞中的糖酵解。然而,NO对肝脏葡萄糖代谢的净效应可能是利用和合成过程的平衡。我们发现日粮精氨酸供应,增加了NO合成,使得ZDF鼠的血糖水平恢复正常,缓解了高血糖症。
4.2 NO与葡萄糖转运
葡萄糖的转运是通过GLUT-4到达并通过细胞膜的,这一机制是骨骼肌、心肌和脂肪组织利用葡萄糖的关键调节步骤。胰岛素是主要的调节糖类利用的激素。它调节胰岛素受体底物的磷酸化和P13K的激活。在骨骼肌中,除了胰岛素,饥饿和运动也可以刺激葡萄糖的吸收。然而,不像胰岛素信号途径,运动和饥饿对胰岛素受体磷酸化没有作用。两个不同胞内GLUT-4代谢池存在骨骼肌中,回应两种不同的机制。当被激活时,GLUT-4经过转移从胞内管泡状小体到骨骼肌细胞膜或脂肪细胞。实验研究表明,NO通过骨骼肌调节葡萄糖的转运。例如,NO供体增加的同时,还增加了葡萄糖转运到骨骼肌的运动。此运动增加了eNOS的基因表达、eNOS蛋白水平和eNOS活性和血管NO的量。相反地,NOS活性抑制剂减少了基础的和运动引起的葡萄糖转运。Roberts等报道,运动增加了肌纤膜GLUT-4的含量,l-NAME抑制了这种活性。因此,NOS抑制剂的灌胃减少了腿葡萄糖的摄入,通过L-arg的灌胃得到缓解。除了肌肉,NO还在3T3-L1脂肪细胞中通过GLUT-4转运到细胞膜,即通过非胰岛素信号途径。
NO可以调节胰岛素的效用来调节葡萄糖的转运。L-NAME消弱了胰岛素的分泌和降低了葡萄糖耐受。另一个NOS抑制剂——L-NMMA也增加了葡萄糖的摄入,包括心脏、比目鱼肌、趾长伸肌和腓肠肌。L-NMMA灌输也抑制了葡萄糖的摄入在脂肪组织、肩胛褐色脂肪、腹膜后和生殖腺的脂肪组织。近来研究表明,血浆L-NMMA水平和葡萄糖的清理成反比。3T3-L1脂肪细胞、SNP增加了葡萄糖摄取,而NO清除剂或鸟苷酸环化酶抑制剂减少了SNP调节的葡萄糖摄入到基础水平。一些研究表明,NOS抑制剂对胰岛素调节的葡萄糖转运无效。但是NO的产量在短期内不能被测量。体内外的差异通过微脉管相关理论和NO的浓度解释,这种现象仅发生在体内但是在体外没有。因此,NO在增加葡萄糖摄入所扮演的角色是血流和非血流机制。NO是主要的血管扩张剂,生理水平的增加导致了葡萄糖的运输。结果是NO合成抑制剂减少了内皮组织血流和抑制了胰岛素调节的葡萄糖摄入。
4.3 NO和糖酵解,糖氧化
除了增加葡萄糖的转运外,通过糖酵解和三羧酸循环,NO也调节葡萄糖代谢。例如,加了SNP的比目鱼肌培养,显著性增加了乳酸的释放和葡萄糖的氧化分解,并存在剂量依赖效应。高水平的NO供体不可以抑制线粒体的呼吸作用。日粮精氨酸供应增强葡萄糖的氧化分解在ZDF鼠中腹膜和附睾组织中。这些发现证明了一个观点:生理水平NO调节葡萄糖氧化。
NO对葡萄糖代谢调节机制是通过cGMP和依赖cGMP的蛋白激酶。可溶性鸟苷酸环化酶活性主要在骨骼肌和脂肪组织中。确实如此,带有NO供体的培养基进行培养很快增加了cGMP的水平,而鸟苷酸环化酶抑制剂阻止了这种效应。这种抑制剂也阻止了NO供体调节的葡萄糖转运和利用。相似的是,cGMP类似物刺激了葡萄糖代谢。在ZDF鼠上,抑制剂的水解导致了cGMP水平的增加,进而提高了葡萄糖转运和氧化分解。然而,胰岛素抵抗的ZDF鼠上,抑制剂没能增加cGMP的水平和提高葡萄糖的利用。结果表明,NO/cGMP途径在肥胖和糖尿病患者骨骼肌中发挥作用。
5 精氨酸-NO途径在脂类代谢中的作用
5.1 NO的合成和肥胖
肥胖和iNOS表达的增加以及NO的过度生产有关。皮下脂肪组织和脂肪细胞中iNOS基因的表达量比非肥胖病人的高。此外,在青春期,血NO的高水平和体脂增加密切相关。虽然eNOS的表达也被增强在肥胖病人的脂肪细胞中,在与脂类相关的代谢疾病中iNOS增加了NO的产量。在一般的肥胖和糖尿病啮齿动物模型中,相比非肥胖野生动物,ob鼠和ZDF鼠,iNOS蛋白表达在脂肪和骨骼肌中是高的。值得注意的是,iNOS抑制剂处理组合和编码iNOS基因干扰组都增加了胰岛素敏感性,借此避免了这些动物因日粮诱导的肥胖。体内实验表明,高水平NO促进了前脂肪细胞到成熟细胞的各个阶段。我们假设诱导NO合成的抑制可以抑制PPAR-γ的表达,因此抑制了脂肪细胞的增殖分化。
5.2 NO和脂肪合成,分解
脂肪组织中未酯化脂肪酸的释放对肥胖和胰岛素抵抗起着重要的作用。有研究表明,NO脂肪组织中的脂肪代谢,包括脂肪合成和分解。然而,现在的参考文献尚未明确:内源NO调节还是抑制脂肪代谢主要看NO供体的剂量类型、组织位点和胞内氧化还原状态。从这些文献中可以发现1~5 μMSNP调节脂解作用,但是25~500 μMSNP抑制了脂解作用。被脂解作用诱导的前房促尿钠排泄的多肽通过NO-cGMP途径对脂肪细胞无效。Gaud⁃iot等证实,不同NO供体对脂肪细胞的脂解作用不同,这是其抗氧化效应所致。此外,一些研究表明,NO供体增加了基础脂解作用,而抑制了异丙基肾上腺素诱导的脂解作用。体外实验表明,NO供体浓度从20 μM~2 mM,生理变化是不清晰的。高水平NO可以氧化和非酶途径抑制儿茶酚胺类物质,因此减少脂解作用速率。
虽然脂肪代谢对于外源性的NO供体的作用是变化很大的,体外实验证明生理水平的NO增加了脂解作用。NO调节瘦素对脂解作用的效用。此外,日粮精氨酸供应,增加了NO合成,调节脂解作用和脂肪酸氧化,进而影响体脂肪的减少。
5.3 NO对胆固醇过少的作用
由于胆固醇过少是一种典型的内皮紊乱的危险因素,所以有越来越多的实验通过日粮和药理学工具致力于此疾病的预防。如前所述,NO在脂肪酸代谢中起着重要作用。大量实验证明,NO供体展现出血胆固醇过少的效应通过调节脂蛋白代谢。如,NO供体的注射引起血浆中LDL水平的减少,表明NO在抑制LDL生产上起着重要作用,SNP减少了apoB的释放。相反地,用NOS饲喂大鼠,导致了血浆甘油三酯、胆固醇和VLDL以及体脂的增加。NO调节肝脏脂质代谢通过抑制脂肪酸的合成。作为结果,丙酰CoA水平是因NO而减少,激活了CPT-1的活性和调节了脂肪酸的氧化。NOS竞争抑制剂提高了血脂、LDL和VLDL,通过摄入精氨酸可起到缓解作用,因此,2%的精氨酸缓解了20%TG和LDL的合成。精氨酸组增加了脂类代谢。大量研究表明,长期饲喂精氨酸减少了腹膜后的脂肪,对其他组织无效。每天给大鼠摄入精氨酸2.5~7.5 g,血浆中的HDL增加了,收缩血压减小。因此,除了NO对上皮的有益功能外,日粮精氨酸还可以减少血浆VLDL和甘油三酯的含量。
6 结论
来自精氨酸的NO在中间代谢中起着重要的作用,NO通过iNOS过度生成导致许多病理性情况。然而,生理水平的NO有许多有益的作用,如促使葡萄糖和脂肪酸氧化的调节以及葡萄糖、TAG和LDL的合成。这些作用可能通过线粒体的生物合成和氧化磷酸化调节,还可以激活专一的转录因子信号途径实现。营养因素通过eNOS、nNOS或者NO的生物利用率增加NO的合成。同时也将增加底物氧化,能量消耗和胰岛素敏感性。相反地,这些因素也可以减少NO合成,从而导致一些疾病的形成。因为iNOS生成大量的NO,有选择的抑制NOS的形式,从而减小氧化应激和避免能量代谢的减少。若进一步研究,将涉及细胞培养,动物模型等需要提供更确定的实验事实解释精氨酸-NO途径在调节脂类合成、葡萄糖TAG合成、葡萄糖和脂肪酸的氧化分解、PGC-1α的表达以及AMPK和血红素氧合酶中的作用。此外,定义NO在褐色脂肪UCP表达,能量底物的脂肪贮藏机制,脂肪组织特有氨基酸代谢,全身能量消耗。总之,这些综合的生化分子和生理学研究,提供了新知识去设计一个新的安全的有效的途径避免肥胖还有代谢综合症。
