不同冷冻保护剂对犊牛睾丸组织冷冻效果的研究
2014-01-20王春伟洪洁赟张卫艺郭秋平胡建宏
王春伟,洪洁赟,张卫艺,吕 妍,郭秋平,赵 军,胡建宏
(西北农林科技大学动物科技学院,陕西杨凌712100)
睾丸组织的冷冻保存尤其是幼龄动物睾丸组织的冷冻保存为雄性动物生殖细胞的保存、珍稀濒危物种的保护以及人类辅助生殖等提供了新的途径[1]。冷冻睾丸组织能够避免酶解造成细胞存活率降低,机械分离破坏细胞间连接,造成细胞缺氧加重等影响[2]。由于人们对幼龄动物睾丸冷冻的机理还不甚清楚,冷冻-解冻后睾丸组织活性的变化、精原干细胞微生境的恢复能力以及影响睾丸组织冷冻效果的关键因素等仍处于探索阶段[3-4]。尽管如此,目前国内外已经开展了幼龄动物睾丸组织冷冻方面的研究。在国内,李莲军等[5]研究表明,完整小鼠睾丸冷冻后细胞复苏率低于60%,但精原干细胞能够正常贴壁、生长和分裂;王晓英[6]利用不同冷冻保护剂冷冻未成熟小鼠睾丸组织,结果发现(Dimethyl sulfoxide,DMSO)组未受损的精原细胞为71%,甘油(GLY)组为57%。朱海鲸等[7]研究表明,DMSO 和乙二醇对羊睾丸组织具有良好的冷冻保护作用,经5%~10% DMSO 冷冻保存后,羊睾丸组织总细胞活率高达65.87%。李淼等[8]研究发现,玻璃化方法冻存睾丸组织,睾丸组织特异性基因TESK1 和pgk-2表达均正常,组织形态改变较小。在国外,Avarbock等[9]首次报道,精原干细胞用常规冷冻方法长期保存后能够保持增殖和分化能力,解冻后睾丸组织中大约1/3的细胞复活;Yildiz等[10]检测了冷冻前后睾丸组织中精子发生和睾酮的生成,结果表明经DMSO 冷冻保存睾丸组织后,获得46.6%的组织存活率以及最高的睾酮水平;Paweena等[11]分析了冷冻对睾丸精子质膜和DNA以及曲细精管的损伤,质膜完整率减少了13.0%,DNA完整率减少了6.6%。纵观国内外的研究,目前对睾丸组织冷冻效果的评价主要侧重在于对冷冻前后组织形态学变化,而对睾丸组织的生化指标的研究尚没有相关报道。另外,目前对睾丸组织冷冻保存的研究主要集中在小鼠等实验动物,而关于家畜尤其是牛睾丸组织的冷冻保存未见报道。
在冷冻保存过程中,睾丸组织会产生一定量的自由基,当自由基的产生超出自身抗氧化系统的清除能力时,其毒性作用会影响睾丸的生精能力。一氧化氮(nitric oxide,NO)和一氧化氮合酶(nitric oxide synthase,NOS)广泛存在于哺乳动物的生殖系统内,NO 是一种不稳定信使小分子,具有很强的自由基氧化特征,NOS 能催化L-精氨酸合成NO[12]。郑航等[13]研究表明,大鼠睾丸组织中NO和NOS的升高是生殖细胞凋亡增加的生化机制,对各种生殖活动起重要作用;Aksoy 等[12]研究发现,过量NO 会导致动物生精障碍,造成导致不育。由此可知,NO 水平和NOS活性的变化能够反映冷冻保护剂对睾丸组织的保护效果,以及睾丸组织的冷冻损伤程度和睾丸生精能力,但有关家畜睾丸组织冷冻前后NO 水平和NOS活性的变化未见报道。
关于动物睾丸组织的冷冻保存,目前多数研究集中在渗透性冷冻保护剂对睾丸组织的冷冻效果,而非渗透性冷冻保护剂的冷冻效果未见报道,且冷冻对睾丸活性的影响机理仍不清楚。本研究通过在基础细胞培养液中添加DMSO、甘油、丙二醇、蔗糖和葡萄籽原花青素等不同冷冻保护剂,分析冷冻复苏后犊牛睾丸细胞的存活率以及睾丸组织NO 和NOS的活性,揭示影响睾丸组织冷冻效果的关键因素,旨在初步建立犊牛睾丸组织低损伤冷冻保存体系。为人类未成年男性肿瘤患者、不育症患者生育能力的恢复、动物精子发生机理、人类及动物复杂组织和器官的冷冻保存、珍稀濒危物种的保护、转基因动物研究以及人类某些遗传病的基因治疗等提供数据参考。
1 材料与方法
1.1 犊牛睾丸的获取
无菌条件下取出5~8月龄的秦川牛犊牛双侧睾丸,置于37℃含有双抗的PBS的保温杯中,在60 min内带回实验室。用酒精棉球擦洗睾丸表面,经过PBS 洗涤3 次,去除白膜后将睾丸剪碎切成1mm3大小的组织块。
1.2 冷冻保护液的配制
依次选用5种冷冻保护剂(表1),包括3 种渗透性冷冻保护剂(DMSO、GLY 和PG)和2种非渗透性冷冻保护剂(Sucrose和GSP),其中非渗透性冷冻保护剂Sucrose母液浓度为0.4g/mL(即40g Sucrose溶于100 mL PBS 中),GSP 母液浓度为0.01g/mL(即1g GSP溶于100mL PBS中)。
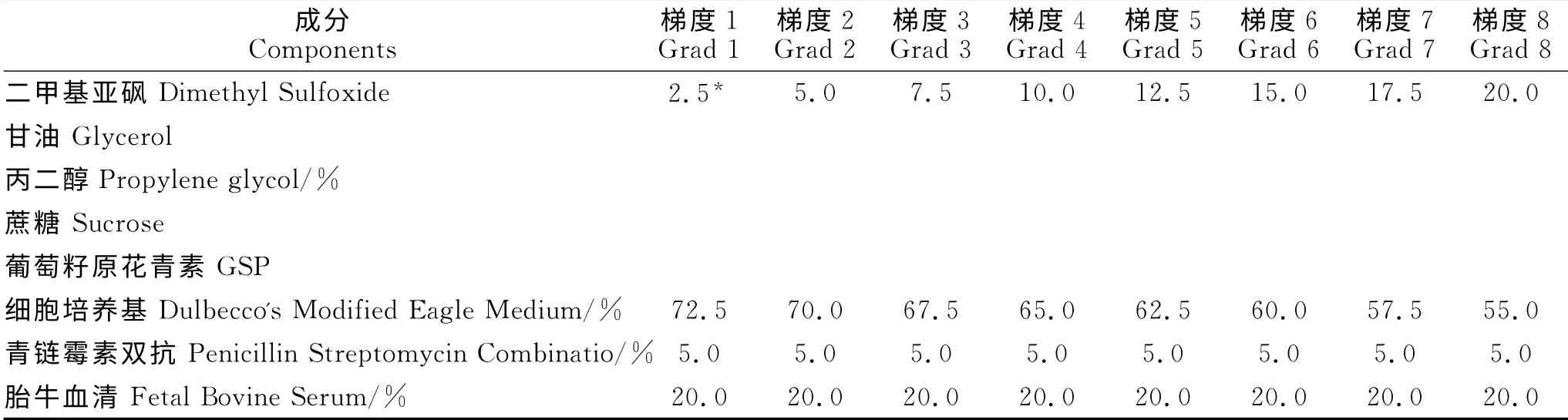
表1 犊牛睾丸组织冷冻保护剂配方Table 1 Components of cryoprotectants prescriptions of calf testicular tissue
1.3 睾丸组织的冷冻与解冻
将2mL剪碎的犊牛睾丸组织与2mL 不同冷冻保护剂按照1∶1的体积比装入5mL 冻存管中,震荡混匀,在4 ℃平衡30min后,置于-20 ℃冷冻30min,然后置于-80 ℃冷冻12h,最后投入液氮中保存。7d后从液氮罐中取出冻存管,迅速置于37 ℃的水浴锅中复温,直至睾丸组织全部融化。
1.4 睾丸组织匀浆液的制备
将复苏后的组织块转移至离心管中,1 000rpm离心5min后弃掉冷冻保护剂,用PBS 洗涤3 次。在1mL睾丸组织中加入4 mL DMEM,将其研磨制备成20%的组织匀浆液,2 500rpm、4 ℃离心10 min取上清液并分装,4 ℃冰箱保存备用。
1.5 细胞悬液的制备
将复苏后的睾丸组织用IV 型胶原酶和胰蛋白酶两步法消化成单细胞悬液。
1.6 冻存效果评价
1.6.1 细胞活率 采用台盼蓝拒染法测定细胞活率。将单细胞悬液稀释至106细胞/mL,细胞悬液与0.4%台盼蓝溶液以9∶1混合混匀。经台盼蓝染色后,立刻在倒置显微镜下计数染成蓝色及不染色细胞,死细胞被染成淡蓝色,而活细胞拒染。活细胞率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%。
1.6.2 NO 和NOS测定 按照南京建成生物公司提供的试剂盒说明书测定。
1.7 统计学处理
每个试验处理重复3次,所有结果均用平均值±标准差(ˉx±SD)表示。利用SPSS软件17.0,采用双因素方差分析和Duncan法进行多重比较,对NO、NOS和细胞活率进行统计分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同冷冻保护剂对冷冻-解冻后睾丸组织细胞活率的影响
不同冷冻保护剂对冷冻-解冻后睾丸组织细胞活率的影响见表2。由表2知,DMSO 浓度为10%时,解冻复苏后睾丸细胞活率最高,显著优于其他浓度(P<0.05),达到77%;在浓度为10%时,DMSO、PG、Sucrose和GSP 冷冻保存睾丸组织后,解冻复苏后睾丸细胞活率在组内分别达到最高,而10%DMSO 显著优于其他组(P<0.05)。含有7.5% GLY 的冷冻保护剂在组织解冻后,细胞活率在组内最高达到41%,显著高于组内其他浓度(P<0.05)但小于DMSO 和PG 组。因此,10% DMSO是冷冻睾丸组织最佳冷冻保护剂。
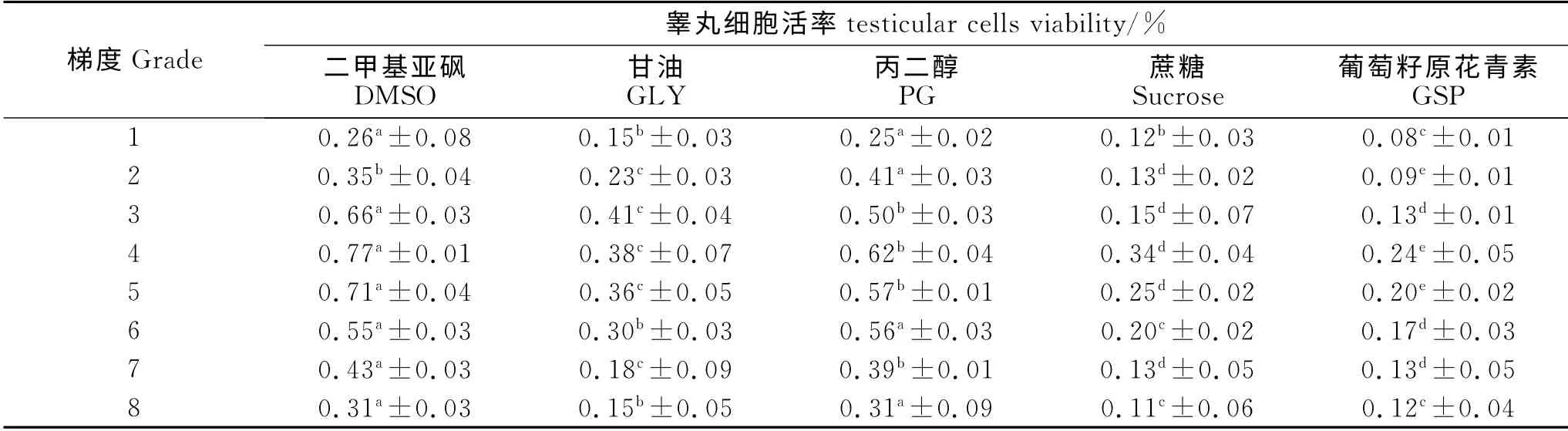
表2 不同冷冻保护剂对睾丸细胞活率的影响Table 2 Effects of different cryoprotectants on testicular cells rate
2.2 不同冷冻保护剂对睾丸组织中NO 的影响
不同冷冻保护剂对睾丸组织中NO 的影响见表3。由表3知,10% GSP 冷冻睾丸组织后NO 含量为0.49μmol/mgprot,显著低于其他组(P<0.05);当浓度为10%时,DMSO、PG、Sucrose 和GSP 的NO 水平显著低于组内其他浓度(P<0.05);10%DMSO 组与10%PG 组之间差异不显著(P>0.05);7.5% GLY 冷冻睾丸组织后NO 含量为0.54μmol/mgprot,显著低于组内其他浓度(P<0.05)。表明10% GSP抑制NO 水平能力最强。
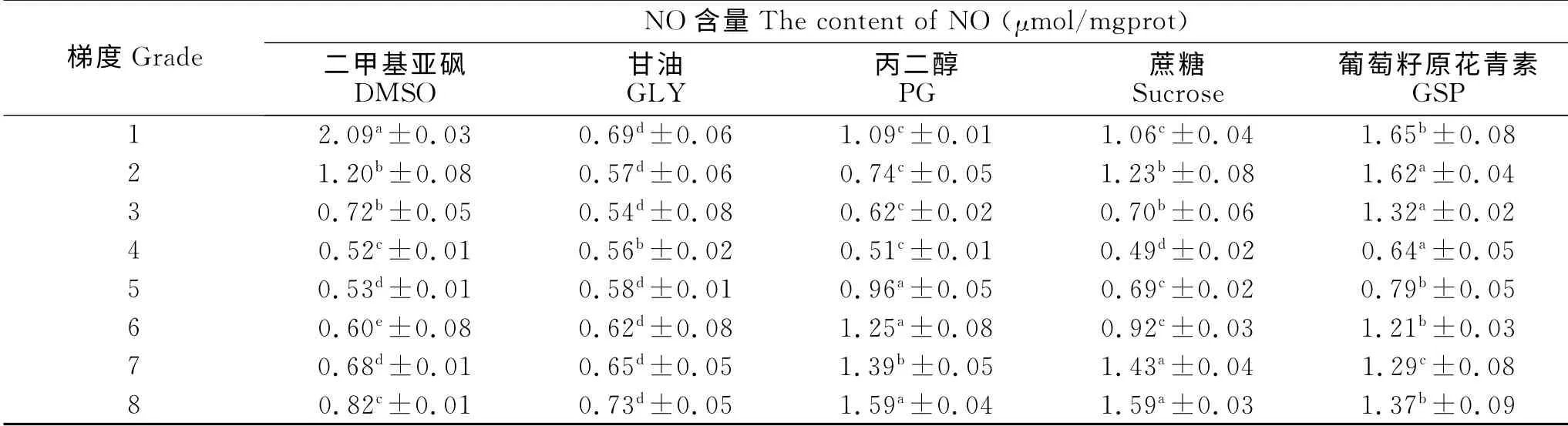
表3 不同冷冻保护剂对睾丸组织中NO 的影响Table 3 Effects of different cryoprotectants on nitric oxide of testicular tissue
2.3 不同冷冻保护剂对睾丸组织中NOS的影响
不同冷冻保护剂对睾丸组织中NOS的影响见表4。表4显示,浓度为10%时,DMSO、PG、Sucro se和GSP组的NOS活性显著地低于组内其他浓度(P<0.05);10%的GSP冷冻睾丸组织后NOS活性为0.96 U/mgprot,显著低于其他组(P<0.05);10%GSP组与10%PG 组之间没有显著性差异(P>0.05);7.5%GLY 冷冻睾丸组织后NOS活性为1.07U/mgprot,显著低于组内其他浓度(P<0.05)。结果表明,10% GSP 能够有效抑制睾丸组织中NOS活性。

表4 不同冷冻保护剂对睾丸组织中NOS的影响Table 4 Effects of different cryoprotectants on nitric oxide synthase of testicular tissue
3 讨论
3.1 不同冷冻保护剂对犊牛睾丸组织冷冻保存的影响
本研究通过检测犊牛睾丸组织冷冻保存后睾丸细胞活率、睾丸内NO 水平和NOS活性,结果表明10% DMSO 作为冷冻保护剂冷冻保存犊牛睾丸组织,解冻后细胞活率达到77%,能较好抑制NO 水平和NOS活性;10% GSP在控制NO 水平和NOS活性方面效果比10%DMSO 好,但保护睾丸细胞活率方面能力较差。因此,10% DMSO 是冷冻犊牛睾丸组织最佳浓度的保护剂,此结果与Keros等[2]和Jahnukainen等[14]的研究结果一致。
对于不同冷冻保护剂对睾丸组织冷冻的效果,Jahnukainen等[14]研究认为,睾丸组织在超低温冷冻过程的关键是冷冻保护剂的类型,不同的冷冻保护剂在冷冻效果上有很大差异,同时冷冻保护剂的浓度对冷冻效果也有很大影响。(10%蔗糖、5%和10%的DMSO 冷冻保存恒河猴睾丸组织,复苏后将睾丸组织移植到裸鼠背部皮下,结果能够启动精子发生过程,然而经过5% DMSO 冷冻睾丸后组织复苏率差)。Keros等[2]比较了DMSO 和蔗糖对人睾丸组织的冷冻保存效果,表明10% DMSO 的保存效果最好,能有效保持睾丸组织形态结构尤其是精子发生,6%蔗糖的保护作用最差,蔗糖作为冷冻保护剂时,睾丸内生精小管基底部、细胞间连接及睾丸基底严重损伤,证实DMSO 能很好的维持人睾丸组织的正常结构,适合于睾丸组织的冷冻保存。Frederickx等[15]报道,DMSO 对组织能提供较好的冷冻保护作用;Hovatta等[16]和Jezek 等[17]研究发现,DMSO 冷冻保存细胞或组织时常用的浓度是10%~20%。本研究发现,经过10% DMSO 冷冻-解冻后,犊牛睾丸细胞活率达到77%,NO 含量为0.52 μmol/mgprot,NOS活性为1.03U/mgprot,而5%DMSO 冷冻保存的犊牛睾丸组织解冻后,细胞复苏率仅35%,NO 含量为1.20μmol/mgprot,NOS活性为1.54U/mgprot。本研究结果表明,DMSO 冷冻保存犊牛睾丸组织的最佳浓度是10%,此结果与Hovatta等[16]和Jezek 等[17]的报道一致。DMSO具有较好的渗透能力以及较低的分子量,能透过细胞膜将细胞质中的水分子置换出来,平衡细胞膜两侧溶液浓度,其自身独特的化学结构不易在低温环境下形成冰晶,因而保护了细胞结构的完整性。高浓度的DMSO 导致冷冻效果较差的主要原因是对细胞造成毒性损伤和渗透损伤等[18]。在超低温冷冻保存过程中,高浓度冷冻保护剂对细胞及组织形成较大的毒性作用,在生殖细胞冷冻保存时导致染色体的异常变化,影响细胞存活和增殖。如果细胞在高溶质的溶液中时间过长,细胞膜上脂质分子会受到损伤,细胞发生渗漏,复温时大量水分进入到细胞内,造成细胞死亡。
本研究发现以GLY 作为冷冻保护剂的睾丸组织冻存效果不佳,7.5% GLY 冷冻后获得最高细胞活率为41%,其原因可能是睾丸组织内含有多种不同类型的细胞,每种细胞所适宜的保护剂不同,且GLY 渗透能力小,无法彻底渗透到睾丸组织深处,对深层细胞起不到保护作用[19]。唐立新等[19]研究发现,用PG 冷冻保存睾丸组织后,会严重损伤睾丸细胞的细胞核及染色体。本试验经10% PG 冷冻犊牛睾丸组织后,细胞活率达62%,NO 含量为0.51μmol/mgprot,NOS 活性为0.98 U/mgprot,对睾丸组织的保护能力不如DMSO 效果明显。Tamura等[20]研究表明,原花青素具有抗氧化、抗基因突变、抑菌、清除自由基、抑制脂质过氧化等作用,原花青素还可以清除活性氧,减少甚至消除氧自由基对机体组织和器官的损害作用。本研究发现,经10% GSP冷冻犊牛睾丸组织后,NO 含量为0.49 μmol/mgprot,NOS活性为0.96U/mgprot,与其他冷冻保护剂相比能显著降低NO 含量和NOS活性。脂质过氧化反应是不饱和脂肪酸氧化降解的链式反应过程,包括启动、延伸、终止三个阶段。延伸阶段产生多种自由基,终止阶段产生多种小分子物质,这些产物引起细胞功能损伤[21]。GSP 属于黄酮类物质,可以通过酚羟基与自由基反应生成稳定的半醌式自由基,终止自由基链式反应,达到减少和清除自由基的效果[22]。
3.2 梯度降温法在犊牛睾丸组织冷冻保存中的应用
在细胞和组织的冷冻保存过程中,渗透性冷冻保护剂将细胞质中的水分子置换出来以避免在细胞质中形成冰晶而刺破细胞的膜结构[23],非渗透性保护剂则在组织细胞膜外形成保护膜或利用糖类的羟基与细胞膜磷脂的磷酸根结合来置换细胞膜表明的水分子,从而防止冷冻时冰晶对细胞膜造成损伤[24]。因此,冷冻保护剂的主要成份实现以上物理或生化反应过程是发挥冷冻保护作用的前提条件,而这需要冷冻保护剂和睾丸组织有一个相互作用的过程。王丽[25]报道,由于精子中细胞质含量较少,精液直接投入液氮不会在精子细胞内形成大的冰晶;而Jahnukainen等[14]研究表明,睾丸细胞具有完整的细胞结构和大量的细胞质,若直接投入液氮中,细胞质中和细胞膜表明的水分子立刻结成冰晶而无法被置换出来,且冰晶将直接损伤细胞,同时,由于冰晶的阻隔,非渗透性冷冻保护剂无法在细胞的膜结构周围生成保护结构以发挥作用。本研究采用梯度降温法冷冻睾丸组织,将涡旋震荡混匀后的冻存管先在4 ℃冰箱中平衡3min,然后-20 ℃冰箱中平衡30min,再放入-80 ℃超低温冰箱中12h,最后投入液氮罐中保存,这样可保证冷冻保护剂有充足的时间和适宜的环境来置换细胞内的水分并生成相关保护结构以发挥其最佳效果。
本研究表明,10% DMSO 适合用于冷冻犊牛睾丸组织,可以获得较高的细胞活率,在睾丸组织冷冻时能较好保护组织降低低温损伤。10% GSP 能显著降低NO 含量和NOS活性,却不能较好的保存犊牛睾丸组织细胞。因此,保护作用较好的渗透性和非渗透性冷冻保护剂之间的配伍效应以及配伍后对睾丸组织的冷冻保存效果有待深入研究。
[1]Honaramooz Ali.Cryopreservation of testicular tissue.Current Frontiers in Cryobiology[M].Editor:II Katkov,2012:209-228.
[2]Keros V,Rosenlund B,Hultenby K,et al.Optimizing cryopreservation of human testicular tissue:comparison of protocols with glycerol,propanediol and dimethyl-sulphoxide as cryoprotectans[J].Hum Reprod,2005,20(6):1 676-1 687.
[3]Gosden R.Cryopreservation:a cold look at technology for fertility preservation[J].Fertility and Sterility,2011,96(2):264-268.
[4]Holoch P,Wald M.Current options for preservation of fertility in the male[J].Fertility and Sterility,2011,96(2):286-290.
[5]李连军,何志云.成年小鼠生精小管及睾丸的冷冻保存[J].动物医学进展,2005,26(6):72-74.
[6]王晓英.不同冷冻保护剂对未成熟小鼠睾丸组织的保护作用[D].河北石家庄:河北医科大学,2010.
[7]朱海鲸,华进联,宋文聪,等.奶山羊睾丸组织冷冻保存及复苏后精原干细胞的分离培养[J].中国兽医学报,2011,31(4):583-588.
[8]李 淼,郁丽丽,张艺宝,等.三种冷冻保护剂对新生小鼠睾丸组织冷冻效果的比较[J].中国比较医学杂志,2013,23(11):48-53.
[9]Avarbock M R,Brinster C J,Brinster R L.Reconstitution of spermatogenesis from frozen spermatogonial stem cells[J].Nat Med,1996,2:693-696.
[10]Yildiz C,Mullen B,Jarvi K,et al.Effect of different cryoprotectant agents on spermatogenesis efficiency in cryopreserved and grafted neonatal mouse testicular tissue[J].Cryobiology,2013,67(1):70-75.
[11]Paweena T,sayamon S,Grisnarong W,et al.Sperm quality and the morphology of cryopreserved testicular tissues recovered post-mortem from diverse wild species[J].Cryobiology,2013,67(2):244-247.
[12]Aksoy H,Aksoy Y.The relationship between varicocele and semen nitricoxide[J].Urol Res,2000,28(6):357.
[13]郑 航,郑新民,李世文,等.总抗氧化能力和一氧化氮合酶对大鼠隐睾生殖细胞凋亡的影响[J].中华实验外科杂志,2002,19(2):173.
[14]Jahnukainen K,Ehmcke J,Hergenrother S D,et al.Effect of cold storage and cryopreservation of immature non-human primate testicular tissue on spermatogonial stem cell potential in xenografts[J].Hum Reprod,2007,22(4):1 060-1 067.
[15]Frederickx V,Michiels A,Goossens E,et al.Recovery,survival and functional evaluation by transplantation of frozen-thawed mouse germ cells[J].Hum Reprod,2004,19(4):948-953.
[16]Hovatta O,Silye R,Krausz T,et al.Cryopreservation of human ovarian tissue using dimethlsulphoxide and propanediol-sucrose as cryoprotectants[J].Hum Reprod,1996,11(6):1 268-1 272.
[17]Jezek D,Schulze W,Kalanj-Bognar S,et al.Effects of various cryopreservation media and freezing-thawing on the morphology of rat testicular biopsies[J].Andrologia,2001,33(6):368-378.
[18]张哲平,张树明.组织深低温冻存中保护剂的应用[J].中国组织工程研究,2013,18:156-163.
[19]唐立新,江 芳,范双喜,等.比较四种冷冻保护剂对大鼠睾丸组织结构的保护作用[J].中国男科学杂志,2009,23(4):10-13.
[20]Tamura H,Yamagami A.Antioxidative activity of monoacylated anthocyanins isolated from muscat bailey agrape[J].J Agrle Food Chem,1994,42(8):1 612-1 615.
[21]Halliwell B.Vitamin C and gcnomic stability[J].Mutat Res,2001,475(1/2):29-35.
[22]曹志超,顾 翔,苏佩清.黄酮类化合物抗氧化及其机制的研究进展[J].实用临床医药杂志,2009,13(13):110-112.
[23]Chi H J,Koo J J,Kim M Y,et al.Cryopreservation of human embryos using ethyleneglycol in controlled slow freezing[J].Hum Reprod,2002,17(8):2 146-2 151.
[24]Amia L,Tainturier D,Jeanneau L,et al.Bull semen in vitro fertility after cryopreservation using egg yolk LDL:a comparison with Optidyl,a commercial egg yolk extender[J].Theriogenology,2004,61:895-907.
[25]王 丽,姜 宏.雄性生殖细胞冷冻保存研究进展[J].国际生殖健康计划生育杂志,2013(6):478-480.
