pH值对酪蛋白-葡聚糖共聚物胶束结构和性质的影响
2014-01-19夏书芹张雅婷张晓鸣贾承胜
夏书芹,张雅婷,张晓鸣,贾承胜
(江南大学食品学院,江苏 无锡 214122)
pH值对酪蛋白-葡聚糖共聚物胶束结构和性质的影响
夏书芹,张雅婷,张晓鸣,贾承胜
(江南大学食品学院,江苏 无锡 214122)
酪蛋白胶束是天然的纳米输送系统,通过美拉德反应获得的酪蛋白-葡聚糖共聚物可解决酪蛋白胶束在等电点pH值范围内溶解性和乳化性低的问题。采用荧光光谱和动态激光光散射等手段研究经超滤分离的酪蛋白-葡聚糖共聚物的聚集行为及其与pH值的关系。结果表明:酪蛋白-葡聚糖共聚物在酪蛋白质量浓度大于0.4 mg/mL时开始自组装形成胶束,形成胶束的结构具有pH值依赖性。相比于其他pH值条件,等电点附近共聚物胶束的结构最为致密且稳定性良好,空间位阻效应是维持其稳定的主要原因。乳化性质则表明,等电点附近的酪蛋白共聚物胶束的乳化活性和乳化稳定性分别提高了2.17倍和3.33倍。因此,酪蛋白-葡聚糖共聚物胶束对环境pH值的响应性可为其在营养素纳米载体领域的应用提供更加多样化的选择。
酪蛋白;美拉德反应;胶束;结构;荧光光谱
新一轮的技术革命和产业革命正深入开展,纳米技术也逐渐成为了食品工业发展的一个重要战略平台,并有望对传统食品学科产生变革性的影响。目前食品工业正在努力尝试将纳米技术用于“从农田到餐桌”的全过程,其中的一个重要分支是纳米载体系统,该技术有望减少营养素的用量、提高其吸收利用率。纳米载体系统技术在食品领域的应用主要得力于以食品级或一般认为安全材料如脂质、蛋白以及多糖替代了纳米药物领域常用的具有一定副作用的聚合物和表面活性剂[1]。酪蛋白胶束是天然的纳米输送系统[2],研究表明利用酪蛋白自组装形成的纳米胶束可以用来包埋、保护以及输送脂溶性VD2[3]及姜黄色素[4]。然而天然酪蛋白在等电点附近的pH值条件下溶解性和乳化性较差[5],这限制了其在酸性食品中的使用。通过美拉德反应获得的酪蛋白-多糖接枝共聚物具有卓越的界面性质[6],使其非常适合作为微胶囊及纳米胶囊的壁材,以保护性质敏感的营养素并达到靶向释放的目的。Pan Xiaoyun等[7]研究发现酪蛋白-葡聚糖接枝共聚物可通过疏水相互作用自组装形成以酪蛋白为核、葡聚糖为壳的球形胶束,有效地包埋疏水性的β-胡萝卜素。
分子结构和环境因素的调节对蛋白-多糖接枝共聚物聚集体的形成与演变具有重要的影响,而聚集体结构的变化可为其作为纳米载体包埋释放营养素这一功能应用上提供更加多样化的选择。然而目前的报道多将美拉德反应产物(Maillard reaction products,MRPs)作为整体研究其功能性质的改善[8-9],并未采取有效的分离措施将接枝共聚物与游离蛋白及多糖进行分离,因此单一的共聚物在分子水平上的结构、聚集特性以及结构与性质的相关性至今未得到清楚阐述。由于共聚物胶束的形态主要由疏水链段的构象、亲水链段之间的相互作用以及疏水链段与溶剂之间的界面能3种作用力决定[10],所以环境因素pH值通过在分子水平上调节共聚物链之间以及共聚物与溶剂之间的相互作用,从而使得蛋白-多糖共聚物对pH值的响应会在其结构和性质上发生相应的变化[11]。
本实验通过超滤分离出美拉德反应产物中的酪蛋白-葡聚糖接枝共聚物,基于荧光光谱及动态光散射等手段,着重分析了酪蛋白-葡聚糖共聚物胶束的形成以及pH值对胶束结构与粒径分布、带电性质的影响,并初步探索了胶束结构与乳化性的关系。以期从分子水平获得有关酪蛋白-葡聚糖共聚物自组装、以及胶束结构和乳化性在pH值响应方面的信息,旨在为酪蛋白美拉德反应产物在食品领域应用的拓宽提供指导。
1 材料与方法
1.1 材料与试剂
酪蛋白 国药集团化学试剂有限公司;葡聚糖(相对分子质量40000) 上海沪试分析仪器有限公司;芘(荧光光谱级) 美国Sigma公司;玉米油 嘉里粮油有限公司。
1.2 仪器与设备
CL20-B型冷冻离心机 上海安亭科学仪器厂;Zetasizer Nano-ZS 90型纳米粒度分析仪 英国Malvern公司;FJ200-S数显高速分散均质机 上海标本模型厂;UV-1600型紫外-可见分光光度计 上海美普达仪器有限公司;F-7000型荧光分光光度计 日本日立公司。
1.3 方法
1.3.1 酪蛋白-葡聚糖共聚物的制备
采用干法美拉德反应制备酪蛋白-葡聚糖MRPs[12]。将酪蛋白和葡聚糖(物质的量比1∶7)溶于1/15 mol/L的磷酸盐缓冲液中,搅拌,制成酪蛋白质量浓度为8 mg/mL的均匀溶液,冷冻干燥48 h。干燥后的样品磨细,过120目筛,置于培养皿中,用刺孔的铝箔封口后进行反应,反应温度为60℃,相对湿度为78%,pH值为7.0。达到反应时间后,冷却终止反应。
将酪蛋白-葡聚糖MRPs溶于水,室温下搅拌1 h后,在7 000 r/min离心30 min。取上清液调整上清液中酪蛋白质量浓度0.1 mg/mL后,用截留相对分子质量1×105的超滤膜反复超滤,收集大于相对分子质量1×105的组分冷冻干燥,即得酪蛋白-葡聚糖共聚物。
1.3.2 荧光性质的测定
1.3.2.1 同步荧光光谱测定
配制酪蛋白-葡聚糖共聚物溶液(采用考马斯亮蓝法分析蛋白含量,调整样品中酪蛋白质量浓度分别为0.2、0.4、0.6、0.8、1.0、1.5 mg/mL,pH 7),恒温静置l.0 h,激发波长和发射波长差(Δλ)分别设为60 nm和15 nm,在荧光发射和激发狭缝宽度均为5 nm的条件下,测定体系在波长280~400 nm范围内的同步荧光光谱。
1.3.2.2 内源荧光发射光谱测定
配制酪蛋白-葡聚糖共聚物和混合物溶液(酪蛋白质量浓度为1 mg/mL,pH 7),用1 mol/L HCl将溶液的pH值分别调节至2.0、3.0、4.0、4.5、5.0、6.0、7.0后,恒温静置1.0 h,在激发波长(λEx)为295 nm、荧光发射和激发狭缝宽度均为2.5 nm的条件下,测定酪蛋白在波长280~400 nm范围内的荧光发射光谱[13]。
1.3.2.3 外源荧光探针荧光发射光谱测定
以芘为荧光探针,移取10 μL储备液(芘浓度1×10-4mol/L)于试管中,用氮气吹干。移入酪蛋白-葡聚糖接枝物溶液(酪蛋白质量浓度1 mg/mL),40℃水浴中超声40 min,继续孵育24 h。芘的最终浓度为10-6mol/L。在激发波长为338 nm、荧光发射和激发狭缝宽度均为2.5 nm的条件下,测定芘在波长350~550 nm范围内的稳态荧光光谱。第1发射峰(373 nm附近)与第3发射峰(384 nm附近)的荧光强度之比值(Il/I3)可以表示芘所处微环境的极性。
1.3.3 粒径分布及Zeta电位
采用动态激光光散射法能快速简单地测定Zeta电位、粒径分布。选择配有He-Ne激光器(λ=633 nm)的Nano-ZS 90马尔文粒径分析仪分析,散射角为173°。将待测样品分别装入聚苯乙烯比色皿(折光指数1.33)和折叠毛细电解池中测定胶束平均粒径和Zeta电位,测定温度(25±0.1)℃,保温3 min。
1.3.4 乳化性质
将4 mL玉米油和12 mL酪蛋白-葡聚糖共聚物以及酪蛋白溶液(0.1 g/100 mL)混合后,10 000 r/min转速下高速分散处理1 min形成均一的乳状液,立即从底部取100 μL液体,用0.1%十二烷基硫酸钠(sodiumdodecylsulfate,SDS)稀释50倍,漩涡混合5 s,测定500 nm波长的吸光度记为A0,10 min后测吸光度记为A10[14]。按照式(1)、(2)计算乳化活性和乳化稳定性。

式中:ρ为乳状液形成前溶液中蛋白质的质量浓度/(mg/mL);I=0.01 m-2;φ为乳状液中油相体积分数(0.25);A0为0 min样品吸光度;A10为10 min样品吸光度。
1.4 数据处理
使用软件SPSS处理数据,实验结果至少重复3次取平均值,并计算标准差。使用软件Origin 8.0绘图。
2 结果与分析
2.1 酪蛋白-葡聚糖共聚物胶束的形成

图1 酪蛋白-葡聚糖共聚物同步荧光光谱Fig.1 Synchronous fluorescence spectra of casein-dextran conjugates
荧光光谱学主要是通过研究分析生物大分子本身具有的荧光发色团(称为内源荧光探针)或通过标记的外源荧光发色团(称为外源荧光探针),结合各种有关的荧光方法和技术来获得生物大分子结构、功能、相互作用等信息。具有内源荧光的物质不多,在蛋白质分子中,能发射荧光的氨基酸有色氨酸(Trp)、酪氨酸(Tyr)以及苯丙氨酸(Phe)。Trp、Tyr以及Phe由于其侧链生色基团的不同而呈现各异的荧光激发和发射光谱。因为蛋白质的荧光通常在280 nm或更长的波长被激发,而Phe在绝大多数实验条件下不被激发,所以很少能观察到Phe的发射。这样蛋白质的内源荧光主要来自Trp和Tyr残基[15]。蛋白质的荧光谱图对其所处的环境非常敏感,因此蛋白质的内源荧光可以作为研究蛋白-多糖共聚物性质的有力手段。αs1-酪蛋白的色氨酸残基位于164和199位,β-酪蛋白的色氨酸残基位于143位,这3个氨基酸皆存在于酪蛋白分子的疏水部分,因此可提供酪蛋白-葡聚糖共聚物分子自组装的重要信息[16]。色氨酸和酪氨酸的稳态发射峰发生较大的重叠,选择合适的Δλ,可得到Trp和Tyr的特征荧光光谱。当Δλ较小时,299 nm附近的荧光峰为Tyr所贡献,Δλ较大时,350 nm附近的荧光峰为Trp所贡献[17]。
酪蛋白-葡聚糖共聚物溶液在Δλ为60 nm时的同步荧光光谱如图1A所示。当体系中蛋白质量浓度在0.2~0.4 mg/mL范围时,Trp残基的发射峰荧光强度随着酪蛋白质量浓度的增加而呈近似线性的变化。当酪蛋白质量浓度大于0.4 mg/mL时,峰强度随着蛋白质量浓度的增加趋势变缓,这意味着当体系中蛋白质量浓度高于0.4 mg/mL时,共聚物在溶液中的存在状态发生了改变。而随着酪蛋白质量浓度的增加,Trp的最大发射波长(λmax)从337.2 nm红移到346.2 nm。酪蛋白-葡聚糖共聚物质量浓度较低时,主要以单分子形式存在;而由于分子具有双亲特性,因此随着质量浓度的增加,分子通过疏水相互作用、氢键作用可自组装形成胶束,从而导致了酪蛋白-葡聚糖共聚物分子中Trp残基的最大发射波长的红移以及发射强度偏离原来的线性关系递增。
图1B为酪蛋白-葡聚糖共聚物在Δλ=15 nm时的同步荧光光谱。谱图表现为Tyr的特征谱图,随着共聚物质量浓度的增加,最大发射波长由288 nm红移到299 nm,与此同时,荧光强度在0.4 mg/mL达到最大后呈现下降趋势,且在310~340 nm范围内有所增加。这表明,质量浓度低于0.4 mg/mL时,酪蛋白-葡聚糖共聚物在溶液中主要以单体形式存在;当质量浓度大于0.4 mg/mL时,酪蛋白-葡聚糖共聚物通过自组装形成聚集体,葡聚糖亲水屏障对内源荧光产生一定的屏蔽效应。
2.2 pH值对酪蛋白-葡聚糖共聚物胶束结构的影响
由于Trp位于酪蛋白分子的疏水微区[18],因此pH值对Trp残基的影响直接反映了pH值对酪蛋白-葡聚糖共聚物胶束结构的影响。图2为激发波长295 nm时,不同pH值条件下酪蛋白-葡聚糖共聚物的荧光光谱图。最大发射波长λmax是判断Trp残基所处微环境疏水度的有力参数,λmax低说明其位于疏水度高的区域。

图2 不同pH值条件下的酪蛋白-葡聚糖共聚物荧光发射光谱Fig.2 Fluorescence emission spectra of casein-dextran conjugates at different pH values

图3 不同pH值条件下酪蛋白-葡聚糖共聚物和混合物的最大发射波长(A)及荧光强度(B)BFig.3 Plots of maximum emission wavelength (A) and fluorescence intensity (B) of casein-dextran conjugates and mixtures against pH
由图3可知,在pH 3.5~5范围内λmax最低,而在pH 2~3.5范围内λmax略高,pH 6~7范围内λmax更高且随着pH值的增加而增大。在pH 3.5~5范围内,Trp残基所处的微环境疏水性最强从而导致了最低的λmax,胶束的结构最为致密。pH 2~3.5范围内,λmax略高于等电点范围,此时胶束的结构较为致密。pH 2的λmax略低于pH 3的原因是部分氨基酸残基质子化,-NH3+中质子化的H+形成氢键的能力要强于-NH2中的中性H原子,分子之间存在较强的氢键作用,导致酪蛋白-葡聚糖共聚物胶束在pH 2处的结构较为致密。pH 6~7范围内,λmax更高且随着pH值的增加而增大,该范围内胶束的结构最疏松。这是由于随着pH值的增加,酪蛋白分子上部分氨基酸的去质子化削弱了酪蛋白-葡聚糖共聚物胶束形成过程中的盐键和氢键作用,与此同时,较强的静电排斥作用导致分子间距离的增加,从而使得结构更加的疏松。pH 3.5~5范围内,与酪蛋白-葡聚糖混合物相比,酪蛋白-葡聚糖共聚物具有较低的λmax和较高的荧光强度,表明其中的Trp残基处于疏水度较高的区域,这意味着pH值接近酪蛋白的等电点时,其具有更为致密的结构。pH 2~3.5范围内,酪蛋白-葡聚糖共聚物相比于混合物有较高的λmax和较低的荧光强度,这是由于接枝的葡聚糖增加了分子之间的距离,削弱了-NH3+中质子化的H+形成氢键的能力,较强的氢键作用导致酪蛋白-葡聚糖混合物胶束的结构更致密。pH 5~7范围内,随着pH值的增加,Trp残基的λmax均呈现增加的趋势,然而酪蛋白-葡聚糖共聚物中Trp的λmax大于混合物的,这表明该pH值范围内酪蛋白接枝葡聚糖后具有比混合物更为疏松的结构。
为进一步研究pH值对共聚物胶束结构的影响,选择疏水性荧光探针芘。Il/I3值可用于衡量芘所处微环境的极性,Il/I3值越小,表明芘所处微环境的疏水性越强,因此,通过分析Il/I3随pH值发生的变化可以间接地反映胶束结构的pH值响应性。
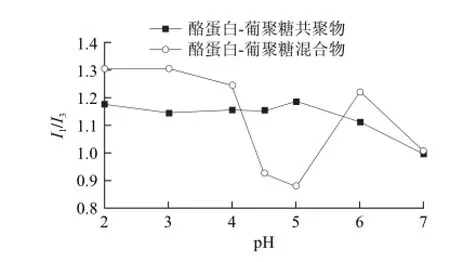
图4 不同pH值条件下的酪蛋白-葡聚糖共聚物和混合物胶束中芘的I1/I3值Fig.4 Plot of I1/I3ratio of pyrene in casein-dextran conjugates and mixtures against pH
图4 为酪蛋白-葡聚糖共聚物和混合物两种胶束体系中芘的I1/I3随着pH值发生的变化。混合物中Il/I3在pH 2~7范围内呈现明显的波动,pH 2~3.5范围内正如内源荧光的结果,此时混合物中酪蛋白胶束由于氢键作用增强因此具有较为致密的结构,因此芘分子无法插入较深的疏水微区,从而导致了较高的Il/I3。pH 4~5范围内Il/I3明显降低,且在pH 5时达到最小值,原因是pH值接近酪蛋白的等电点,分子净电荷趋于0,胶束结构由致密变得疏松后解体继而形成宏观上的聚集沉淀,从而使得Il/I3大幅度下降。pH 4~4.5和pH 5~6范围内酪蛋白胶束的解体和重新形成,导致了Il/I3大幅度的下降和上升。pH 6~7范围内,随着pH值的增加,部分氨基去质子化,静电斥力使胶束的结构变得较为疏松,因此芘分子可以插入较深的疏水区域,从而获得较低的Il/I3。
相比于混合物,酪蛋白-葡聚糖共聚物在pH 2~4范围内有略低的Il/I3,这是由于酪蛋白接枝葡聚糖后形成的屏障增加了酪蛋白分子之间的距离,削弱了氢键作用,因此形成较为疏松的结构。pH 4~5范围内,Il/I3随着pH值增加变化不明显,这表明酪蛋白-葡聚糖共聚物形成的胶束在等电点附近并没有发生类似酪蛋白胶束的解离聚集行为,这与胶束表面葡聚糖亲水性屏障发挥的空间位阻效应密切相关。当pH 值趋近于5时,净电荷趋于0,分子间斥力降低,酪蛋白分子亚基的聚集、多肽链的折叠使得共聚物反而形成了非常致密的结构,导致芘分子无法插入更深的疏水微区,相应的Il/I3有所升高。pH 5~7范围内,Il/I3随着pH值的增加而减小,这同样也归因于部分氨基去质子化,静电斥力使胶束的结构变得较为疏松,芘分子可插入较深的疏水区域。
2.3 pH值对酪蛋白-葡聚糖共聚物胶束的平均粒径与带电性质的影响
酪蛋白在溶液中多以带电单体的聚合形式存在,单体间依靠二硫键、疏水作用力、范德华力、氢键等作用力结合,粒子基本呈球形而非线状,故其平均流体力学半径最直观地反映了溶液中蛋白的结构特征[19]。酪蛋白胶束直径约为50~500 nm,平均约150 nm[20]。Zeta电位则能够从胶体粒子的微观带电特性说明胶体的稳定性[21]。图5所示为酪蛋白-葡聚糖共聚物和混合物的平均粒径(图5A)和Zeta电位(图5B)随环境溶液pH值的变化。

图5 酪蛋白-葡聚糖共聚物和混合物的平均粒径(A)及Zeta电位(B)随pH值的变化Fig.5 pH dependence of Z-average diameter (A) and Zeta potential (B) of casein-dextran conjugates and mixtures
由图5可知,在pH 2~4和pH 5~7范围内,混合物中的酪蛋白分别带有净的正电荷或者净的负电荷,带电的氨基酸残基的静电排斥和水合作用促进了酪蛋白的溶解。且随着酪蛋白所带电荷的增加,分子间静电斥力作用增强,分子间的距离增加,酪蛋白胶束的结构疏松,粒径略有增加。pH 4~5范围内,由于在等电点附近缺乏静电排斥作用,粒径显著增大至微米级并出现宏观的絮凝沉淀,酪蛋白葡聚糖混合物体系非常不稳定,超出了检测限,无法给出可靠的实验数据。在pH 4~5范围内,虽然酪蛋白-葡聚糖共聚物胶束体系的Zeta电位较小,但其平均粒径小于200 nm,未观察到聚集现象。这与亲水性的多糖增加了疏水蛋白和水分子之间的亲和作用密切相关,且葡聚糖分子有助于提高疏水蛋白之间的空间位阻,抵消缺乏静电排斥作用导致的变化,减少水中疏水蛋白之间的相互作用,从而阻止蛋白质的聚集沉淀。而且在此pH值范围内,胶束的平均粒径最小,表明酪蛋白-葡聚糖共聚物胶束结构最为致密,这与荧光光谱结果相应。比较发现,pH 4~7范围内,酪蛋白-葡聚糖共聚物Zeta电位的绝对值小于相应的混合物,这是由于葡聚糖接枝到酪蛋白上后,高度水合的葡聚糖导致了酪蛋白-葡聚糖接枝共聚物溶液的Zeta电位值减小[22]。
2.4 酪蛋白-葡聚糖共聚物的乳化性质

图6 酪蛋白-葡聚糖共聚物和混合物的乳化活性(A)及乳化稳定性(B)随pH值的变化Fig.6 pH dependence of emulsifying ability (A) and emulsion stability (B) of casein-dextran conjugates and mixtures
蛋白类大分子在纳米乳等纳米载体中的主要作用是降低油水界面张力、形成牢固的乳化膜、对难溶性营养素的增溶作用。由图6可知,在pH 2~7范围内,酪蛋白-葡聚糖混合物的乳化活性和乳化稳定性均呈现先下降后上升的趋势,在等电点处达到最小值。在pH 4.5条件下,酪蛋白-葡聚糖共聚物的乳化活性和乳化稳定性分别达到221.7 m2/g和12.56 min,为混合物的3.17倍和4.33倍,这表明酪蛋白接枝葡聚糖后的结构变化明显改善了等电点pH值范围内酪蛋白的表面活性。这可以从两方面来解释:一方面,研究发现蛋白分子的柔韧性、表面疏水性和溶解性与乳化能力有一定关系,其中蛋白分子的柔韧性被认为可能是决定蛋白乳化性质最重要的因素[23]。在酪蛋白-葡聚糖共聚物为乳化剂的乳状液中,接枝后酪蛋白分子pH值变化至等电点处使原有的结构有所变化,分子能够在乳化过程中快速移动到油水界面,降低了界面张力,而且能快速在界面展开重排,在油水界面更容易采用较适宜的构象,从而发挥较好的乳化作用。另一方面,乳化活性受溶解性质影响[24],接枝蛋白表面亲水性的葡聚糖有利于胶束的形成,糖分子对酪蛋白有保护作用。疏水性蛋白吸附在油相表面,而共价连接的大量亲水性的葡聚糖插入水相中,其在乳化颗粒表面形成的乳化膜有一定的厚度和黏弹性,形成了空间稳定层阻止油滴的聚合,赋予等电点处酪蛋白-葡聚糖共聚物较高的乳化稳定性。
3 结 论
酪蛋白-葡聚糖共聚物溶液中,当酪蛋白质量浓度大于0.4 mg/mL时,分子开始自组装形成胶束。形成的胶束在pH 2~7范围内均可保持结构的相对稳定,且结构对环境pH值具有响应性。共聚物胶束的结构在pH 3.5~5范围内最为致密,pH 2~3.5范围内较为致密,pH 5~7范围内最疏松。pH 3.5~5范围内胶束结构的稳定性良好,葡聚糖亲水屏障赋予的空间位阻效应是维持该范围内胶束稳定的主要因素。同时,酪蛋白接枝葡聚糖后结构的变化明显改善了等电点处酪蛋白的乳化活性和乳化稳定性。
[1] HUANG Qingrong, RU Hailong, RU Qiaomei, et al. Bioavailability and delivery of nutraceuticals using nanotechnology[J]. Journal of Food Science, 2009, 75(1): 50-57.
[2] WALSTRA P. Casein sub-micelles: do they exist? [J]. International Dairy Journal, 1999, 9(3): 189-192.
[3] ELZOGHBYL A O, ABO EL-FOTOH W S, ELGINDY N A, et al. Casein-based formulations as promising controlled release drug delivery systems[J]. Journal of Controlled Release, 2011, 153: 206-216.
[4] ESMAILI M, GHAFFARI S M, MOOSAVI M Z, et al. Beta caseinmicelle as a nano vehicle for solubility enhancement of curcumin; food industry application[J]. Food Science and Technology, 2011, 44(10): 2166-2172.
[5] POST A E, ARNOLD B, WEISS J, et al. Effect of temperature and pH on the solubility of caseins: environmental influences on the dissociation of α(S)- and β-casein[J]. Journal Dairy of Science, 2012, 95(4): 1603-1616.
[6] KATO A, RYUSUKE M. Functional casein-polysaccharide conjugates prepared by controlled dry heating[J]. Bioscience Biochemitry, 1992, 56(4): 567-571.
[7] PAN Xiaoyun, YAO Ping, JIANG Ming, et al. Simultaneous nanoparticle formation and encapsulation driven by hydrophobic interaction of casein-graft-dextran and β-carotene[J]. Colloid Interface Science, 2007, 315(2): 456-463.
[8] 庄海宁, 冯涛. 美拉德反应合成蛋白-多糖复合物及其应用[J]. 粮食与油脂, 2007(12): 4-7.
[9] ETZEL M R, BUND T. Monoliths for the purification of whey proteindextran conjugates[J]. Journal of Chromatography A, 2011, 1218(17): 2445-2450.
[10] SUI Zhijie, JABERJ A, SCHLENOFF J B. Polyelectrolyte complexes with pH-tunable solubility[J]. Macromolecules, 2006, 39(23): 8145-8152.
[11] HENRY S M, ELSAYED M E, PIRIE C M, et al. pH-Responsive poly(styrene alt maleic anhydride) alkylamide copolymers for intracellular drug delivery[J]. Biomacromolecules, 2006, 7(8): 2407-2414.
[12] 李丽, 夏书芹, 张晓鸣, 等.基于SDS 增溶分析复合物胶束中辅酶Q10的含量[EB/OL].[2010-06-18](2012-12-18). http://www.paper. edu.cn/index.php/default/releasepaper/content/201006-435.
[13] SAHU A, KASOJU N, BORA U, et al. Fluorescence study of the curcumincasein micelle complexation and its application as a drug nanocarrier to cancer cells[J]. Biomacromolecules, 2008, 9(10): 2905-2912.
[14] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 718-723.
[15] SILVA S V, MALCATA F X. Caseins as source of bioactive peptides[J]. International Dairy Journal, 2005, 15(1): 1-15.
[16] 刘燕. 酪蛋白胶束结构与功能特性的研究[D]. 扬州: 扬州大学, 2007.
[17] SAHU A, KASOJU N, BORA U, et al. Fluorescence study of the curcumincasein micelle complexation and its application as a drug nanocarrier to cancer cells[J]. Biomacromolecules, 2008, 9(10): 2905-2912.
[18] SEMO E, KESSELMAN E, DANINO D, et al. Casein micelle as a natural nano-capsular vehicle for nutraceuticals[J]. Food Hydrocolloids, 2007, 21(5/6): 936-942.
[19] NARAMBUENA C F, AUSAR F S. Aggregation of casein micelles by interactions with chitosans: a study by Monte Carlo simulations[J]. Journal of Agricultural and Food Chemistry, 2005, 53(2): 459-463.
[20] GEBHARDT R, TAKEDA N, KULOZIK U, et al. Structure and stabilizing interactions of casein micelles probed by high pressure light scattering and FTIR[J]. The Journal of Physical Chemistry, 2011, 115(10): 2349-2359.
[21] BOUZID H, RABIUER B M, PAUGAM L, et al. Impact of zeta potential and size of caseins as precursors of fouling deposit on limiting and critical fluxes in spiral ultrafdtration of modified skim milks[J]. Journal of Membrane Science, 2008, 314(1/2): 67-75.
[22] PAN Xiaoyun, MU Minfang, YAO Ping, et al. Micellization of casein-graft-dextran copolymer prepared through maillard reaction[J]. Biopolymers, 2006, 81: 29-38.
[23] PALLAR˚S I, VENDRELL J, AVILÉ S, et al. Amyloid fibril formation by a partially structured intermediate state of α-chymotrypsin[J]. Journal of Molecular Biology, 2004, 342(1): 321-331.
[24] JIMENEZ C L, LOPEZ F R. Study on β-lactoglobulin glycosylation with dextran: effect on solubility and heat stability[J]. Food Chemistry, 2005, 93(4): 689-695.
Effect of pH on the Structure and Property of Casein-Dextran Conjugate Micelles
XIA Shu-qin, ZHANG Ya-ting, ZHANG Xiao-ming, JIA Cheng-sheng
(College of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Casein micelle, as a natural nano-capsular vehicle for nutraceuticals, has the properties of low solubility and emulsifying ability at pH near the isoelectric point. Casein-dextran conjugates via Maillard reaction are expected to overcome these problems. In this work, the aggregation behavior and pH dependence of casein-dextran conjugates separated through ultrafiltration were explored by using fluorescence spectroscopy and dynamic light scattering. The results showed that casein-dextran conjugates began to self-assemble when the concentration of casein exceeded 0.4 mg/mL. The conjugated micelles had a compact structure or a relatively loose structure under different pH conditions. The structures of micelles at pH near the isoelectric point were the most compact, and presented a good stability due to the steric hindrance. Meanwhile, the emulsifying activity and emulsion stability of the conjugated micelles were increased by 2.17 and 3.33 times at pH near the isoelectric point, respectively. Therefore, the pH dependence of casein-dextran conjugate micelles might provide more choices for their use in the field of nutraceutical nanocarriers.
casein; Maillard reaction; micelles; structure;fluorescence spectroscopy
TS255.5
A
1002-6630(2014)05-0037-06
10.7506/spkx1002-6630-201405008
2013-01-17
“十二五”国家科技支撑计划项目(2011BAD23B04);江苏高校优势学科建设工程资助项目
夏书芹(1979—),女,副教授,博士,研究方向为食品科学。E-mail:sqxia@jiangnan.edu.cn
