反复冻融对兔背最长肌肉品质特性和微观结构的影响
2014-01-18孙金辉王晓香尚永彪彭增起
张 丹,孙金辉,王晓香,尚永彪,2,3,*,彭增起
(1.西南大学食品科学学院,重庆 400715;2.农业部农产品贮藏保鲜质量安全评估实验室(重庆),重庆 400715;3.重庆市特色食品工程技术研究中心,重庆 400715;4.南京农业大学食品科技学院,南京 210095)
反复冻融对兔背最长肌肉品质特性和微观结构的影响
张 丹1,孙金辉1,王晓香1,尚永彪1,2,3,*,彭增起4
(1.西南大学食品科学学院,重庆 400715;2.农业部农产品贮藏保鲜质量安全评估实验室(重庆),重庆 400715;3.重庆市特色食品工程技术研究中心,重庆 400715;4.南京农业大学食品科技学院,南京 210095)
研究反复冻融对兔肉品质特性和微观结构的影响。兔背最长肌置于-40℃条件下冷藏7 d,取出并自然解冻后,测定兔肉的解冻损失、pH值、色泽、蒸煮损失、剪切力、蛋白质溶解度、肉糜流变学性质及微观结构等。结果显示:随着冻结-解冻次数的增加,兔背最长肌肉的pH值、剪切力和溶解度都显著降低(P<0.05);解冻损失和蒸煮损失显著增加(P<0.05),肌肉保水性下降;亮度(L*)和黄度(b*)逐渐增加,红度(a*)显著降低,表明肌肉反复冻融后失去了鲜肉应有的颜色;G’在加热过程中也逐渐降低,兔肉蛋白形成凝胶的能力减弱;微观结构发生明显变化,肌内膜破裂、肌束间空隙增大、结构松散等。反复冻融导致兔肉的品质下降,微观结构受到破坏。
兔肉;反复冻融;品质特性;流变学性质;微观结构
冷冻是最方便、有效的贮藏原料肉的方法之一[1],肉制品加工厂生产时采用的原料主要是冻肉,冻肉的品质对加工出品率、产品质量有显著的影响[2]。冷冻肉的品质主要取决于冷冻技术和解冻技术,因为,在冷冻过程中肉内部形成大小不一的冰晶,会对细胞膜和组织结构造成机械伤害;解冻时导致汁液流失,营养成分丧失等,从而降低其品质[3]。此外,在现实生产过程中,由于冷链没有完全形成,在多次的周转、运输和贮藏过程中,肉品会经历反复的冻结和融化,更加剧了对肉品质的影响。国内外一些学者已经注意到反复冻融对肌肉品质的不利影响,但目前的研究主要集中在水产品上,如Boonsumrej等[4]研究了虾肉随冻融次数的增加,肌肉蛋白溶解度降低、肌纤维间间隙增大、剪切力增加等。反复冻融对兔背最长肌肉品质影 响的研究还未见报道。
我国全国各地都有兔肉的屠宰生产,但主要加工和消费地区在川渝两地。屠宰后,兔肉通常要经历屠宰场冷冻后运输到当地中转库、当地中转库冻藏后运输到异地中转库、异地中转库冻藏后运输到深加工厂、深加工厂加工前再解冻使用,反复冻融次数有可能高达4~6次。研究反复冻融对兔肉品质和微观结构的影响,旨在为兔肉的加工和冷链物流技术的进步提供科学依据。
1 材料与方法
1.1 材料与试剂
实验原料为活的雄性伊拉兔(4只),饲养周期2.5个月,平均体质量约2.3 kg,购自西南大学养兔场。
磷酸氢二钠、EDTA、氯化钠、牛血清白蛋白(bovine serum albumin)、氢氧化钠、硫酸铜、甘油、戊二醛、甲醛、四氧化锇、乙醇,均为分析纯,来自成都科龙化工试剂厂。
1.2 仪器与设备
DF8517超低温冰箱 韩国Ilshin公司;PHS-4C+酸度计 成都世纪方舟科技有限公司;UltraScan PRO测色仪 美国Hunter Lab公司;TA. XT2i物性测定仪 英国Stable Micro System公司;5810台式高速离心机 德国Eppendorf公司;XHF-D高速分散器 宁波新芝生物科技股份有限公司;4K-15冷冻离心机 德国Sigma公司;722-P可见分光光度计 上海现科仪器有限公司;HR-1流变仪 美国TA公司;S-3400N扫描电镜 日本日立公司。
1.3 方法
1.3.1 样品预处理
将4只活兔击晕、屠宰后,取其背最长肌并切成3 cm左右的长条,分别用自封塑料袋密封后置于4 ℃冰箱中冷却24 h,全过程于45 min内完成。将原料肉分为2组,第一组为对照组,冻融次数0次;第二组,将样品放入40 ℃冰箱冻藏,7 d后取出,自然解冻至中心温度为0~4 ℃,全过程为完成一次冻融。按上述第二组方法共反复冻融5次,每次取样1袋,分别测定冻融0、1、3、5次的解冻损失、pH值、色泽、蒸煮损失、剪切力、蛋白质溶解度、肉糜流变学性质及微观结构等指标。
1.3.2 解冻损失的测定
解冻损失由解冻前后肉(分别用滤纸擦去表面的水分)的质量变化来计算。

1.3.3 pH值的测定
按GB/T 9695.5—2008《肉与肉制品pH测定》[5]的方法进行测定。
1.3.4 兔背最长肌颜色的测定
肉样的颜色用色差仪测定,每完成一次冻融测定肉样的亮度(L*)、红度(a*)和黄度(b*)。L*表征肉的光泽度,a*和b*表征肉的新鲜度。
1.3.5 蒸煮损失测定
将样品准确称质量并放入标记好的蒸煮袋中,然后置于沸水中煮制,控制样品肌肉中心温度达到70 ℃时,取出并用滤纸擦去表面水分后精确称质量。蒸煮损失由蒸煮前后肉的质量变化来计算。

1.3.6 剪切力的测定
参照夏秀芳等[1]的测定方法。将熟制的样品肉冷却至0~4 ℃,用圆形取样器沿着样品肉肌纤维的方向旋转取样,取样位置距离肉样边缘应不小于5 mm,且临近的2个样品的取样边缘间距也不应少于5 mm。然后采用TA. XT2i物性测定仪测定,选用HDP-BSW探头,进刀速率为10 mm/s,进刀距离为25 mm,测定时必须垂直肌纤维的方向进行切割。
1.3.7 肌原纤维蛋白溶解度测定
1.3.7.1 肌原纤维蛋白的提取
肌原纤维蛋白的提取参照Xiong YoulingL.[6]的方法并稍加改进。剔除解冻后肉样的脂肪和结缔组织,精确称取一定量的肉样,用绞肉机将兔肉绞成2 mm大小的肉粒,并加入肉样质量4倍体积的0.05 mol/L磷酸缓冲液(0.1 mol/L NaCl、5 mmol/L EDTA,pH 7.0),然后高速匀浆1 min,接着离心15 min(2000×g,4 ℃)后倒掉上清液,重复以上步骤两次;加入4倍体积的0.1 mol/L NaCl溶液,高速匀浆30 s,离心15 min(2 000×g,4 ℃)后倒掉上清液;再加入8倍体积0.1 mol/L NaCl溶液,混匀后用4层纱布过滤,调整混合溶液的pH值为6.25,最后离心15 min(2 000×g,4 ℃),倒出上清液,沉淀即为肌原纤维蛋白。
1.3.7.2 蛋白质含量的测定
采用双缩脲法[6]进行测定。
1.3.7.3 蛋白质溶解度的测定
参照并适当调整Kingsley等[7]的方法。配制2 mg/mL的肌原纤维蛋白溶液(取一定量提取的肌原纤维蛋白,溶于100 mL 0.6 mol/L的NaCl溶液中,搅拌并使其溶解完全),离心15 min(5 000×g,4 ℃),用双缩脲法测定上清液的蛋白质含量。

1.3.8 兔肉糜流变学性质测定
取2~3 g肉糜进行流变学性质的测定,上样后调节流变仪载样上下板之间的距离为1 mm,两平板边缘用凡士林涂抹,防止水分蒸发。按程序对样品进行加入升温,升温温度范围为10~90 ℃,升温速率为1 ℃/min,自动记录兔肉糜在加热过程中的储能模量(G’,弹性模量)随温度变化的曲线。
1.3.9 兔肉微观结构分析
参照并适当调整Haga等[8]的样品处理方法。将兔肉切成0.5 cm3左右的小块,用0.1 mol/L磷酸缓冲液(pH 7)配制的2.5%戊二醛和4%甲醛混合溶液(1∶1,V/V)在4 ℃条件下预固定处理24 h;用0.1 mol/L,pH 7的磷酸缓冲液漂洗3次,每次30 min;再将肉样放入用0.1 mol/L的磷酸缓冲液(pH 7)配制的1%四氧化锇溶液在4 ℃中固定2 h,用蒸馏水漂洗3次;最后分别用体积分数为30%、50%、70%、90%和100%的乙醇梯度脱水,干燥后经高真空离子溅射镀膜机喷金后用电子显微镜进行扫描观察并拍照。
1.4 统计分析
所有实验均重复测定3次,用Excel 2003对所得数据进行统计分析并作图,用SPSS(Tukey HSD)进行显著性分析。
2 结果与分析
2.1 反复冻融对兔背最长肌pH值的影响

图1 反复冻融对兔肉pH值的影响Fig.1 Effect of repeated freeze-thaw cycles on the pH of rabbit meat
由图1可知,随着冻融次数的增加,兔肉pH值呈先上升后下降的趋势。未经过冻融的兔肉pH值为6.25,这与张崟等[9]用兔肉和羊肉验证国标规定的肉与肉制品pH值的测定中所测得的兔肉pH值相同。冻融5次后,兔肉pH值降到5.98,与未经冻融处理的兔肉相比差异性显著(P<0.05),冻融后pH值降低主要是因为在反复冻融过程中,肌糖原在无氧条件下发生降解,从而产生乳酸;三磷酸腺苷(ATP)也分解产生磷酸肌酸等酸性物质[10]。随着反复冻融次数的增加和冻藏时间的延长,乳酸和磷酸积累而导致pH值下降[11]。pH值与肉的新鲜程度、保水性和色泽等品质有密切的联系,当pH值从7.0下降到5.0时,肉的保水性也随之降低[10],这与实验中兔肉保水性下降的结果一致。
2.2 反复冻融对兔背最长肌颜色的影响

表1 反复冻融对兔肉颜色的影响Table 1 Effect of repeated freeze-thaw cycles on the color of rabbit meat
由表1可知,随着冻融次数的增加,兔肉的亮度(L*)值不断增加(P<0.05);红度(a*)值显著减小(P<0.05);黄度(b*)值逐渐增大,但冻融3次后和5次后相比变化不显著(P>0.05)。结果表明:反复冻融后,兔肉品质越来越差,肉色越发偏黄,这与樊金山等[12]研究快速冷却对兔肉背最长肌肉品质中色泽变化趋势的影响结果相同。
畜禽冻融过程中颜色变化的原因比较复杂,一般认为肉颜色的变化主要是因为脂肪氧化和肌红蛋白结合状态的改变引起的,红度(a*)值下降一方面是因为在反复冻融过程中,水分丢失的同时也导致了色素相关物质流失;另一方面是因为冻融后pH值降低(酸物质增多),催化氧合肌红蛋白氧化,导致高铁肌红蛋白大量积累所导致;L*(亮度)值和b*(黄度)值的上升主要和脂肪氧化有关[1,13]。
2.3 反复冻融对兔背最长肌保水性的影响

图2 反复冻融对兔肉解冻损失的影响Fig.2 Effect of repeated freeze-thaw cycles on the thawing loss of rabbit meat
由图2可知,随着冻融次数增加,兔肉的解冻损失、蒸煮损失显著增大(P<0.05)。兔肉冻融1次的解冻损失为4.85%;反复冻融5次后的解冻损失达到15.38%。解冻损失增加表明兔肉保水性(water holding capacity,WHC)下降,WHC作为评定肉品质的重要指标之一,直接影响肉的风味、色泽、质地和凝结性等。公认优质猪肉的保水性应>76%,解冻损失<8.0%[1],兔肉经反复冻融后的水分损失远大于猪肉优质肉的要求;保水性下降主要是因为兔肉在反复冻融过程中,冰晶不断形成和消失,使细胞膜和组织结构受到机械损害,解冻时细胞中的营养成分、可溶性蛋白和水分逐渐流失[14],最终导致兔肉的保水性下降。
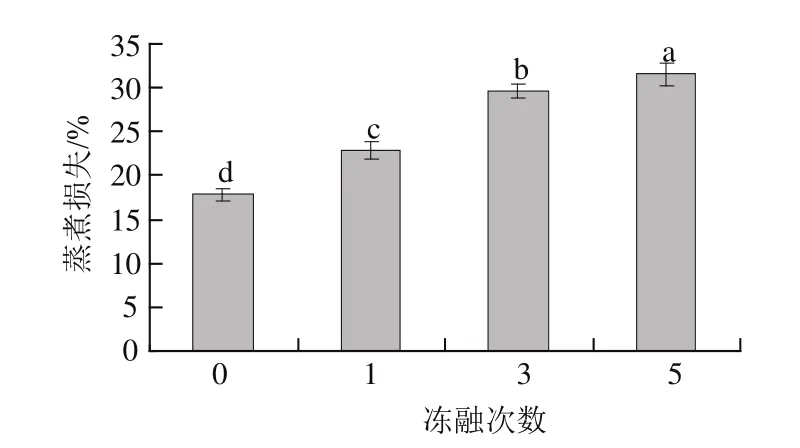
图3 反复冻融对兔肉蒸煮损失的影响Fig.3 Effects of repeated freeze-thaw cycles on the cooking loss of rabbit meat
由图3可知,新鲜兔肉的蒸煮损失为16.76%,反复冻融5次后兔肉的蒸煮损失高达30.47%,表明冻融前后蒸煮损失差异显著(P<0.05)。蒸煮损失也表明兔肉WHC下降,品质降低。主要是由于蒸煮 后肌肉的蛋白质变性,促进了肌球蛋白和肌动蛋白的结合,从而使肌原纤维收缩,导致保水性降低[15]。
2.4 反复冻融对兔背最长肌剪切力的影响

图4 反复冻融对兔肉剪切力的影响Fig.4 Effect of repeated freeze-thaw cycles on the shear force of rabbit meat
由图4可知,新鲜兔肉的剪切力为2.25 kg,经1次冻融后,剪切力有所上升(P>0.05);而后剪切力显著下降(P<0.05),反复冻融5次后剪切力下降到1.57 kg。剪切力值的变化与冻融次数有关,其变化趋势与戚君等[13]和Shanks等[16]对羊肉和牛肉的相关品质研究中所得结果基本一致。冻融1次后,剪切力明显上升可能是因为冷冻融解后保水性下降而导致肌肉收缩,使肌原纤维排列更加紧密,从而导致剪切力增加;而后剪切力下降,是因为冻融次数增加,冰晶反复形成和消失,使细胞膜和组织结构不断受到机械损害而导致肌原纤维结构降解,从而使兔肉肌肉质构变软[17-18],反复冻融后肌肉细胞失水、兔肉间隙增大,也会导致剪切力降低[19]。
2.5 反复冻融对兔肉肌原纤维蛋白溶解度的影响
由图5可知,兔肉肌原纤维蛋白溶解度随冻融次数的增加而呈下降趋势(P<0.05),第5次冻融后下降了27.94%。Benjakul等[20]研究发现鳕鱼在反复冻融5次后,盐溶蛋白溶解度下降约50%。因实验材料等不同,使得有的研究与本实验结果在数值上有一定差别,但总体变化趋势和结论是一致的。反复冻融使蛋白质的空间结构发生改变,使得蛋白质之间的作用增强,产生二硫键、氢键和疏水键等,从而导致蛋白质和水分子间的作用力减弱,蛋白质溶解度下降,肉的加工性能变差[20]。

图5 反复冻融对兔肉肌原纤维蛋白溶解度的影响Fig.5 Effect of repeated freeze-thaw cycles on the solubility of myofibrillar protein of rabbit meat
2.6 反复冻融对兔肉糜流变学性质的影响
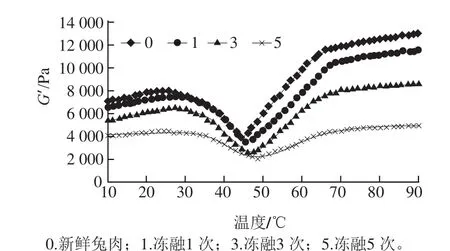
图6 反复冻融兔肉糜在加热过程中G’的变化Fig.6 Change in G’ of rabbit meat paste after repeated freeze-thaw cycles during thermal gelation
储能模量(G’)是衡量蛋白凝胶能力的一个重要指标,G’值高意味着凝胶能力强。由图6可知,反复冻融后的兔肉糜的G’值比新鲜兔肉糜的G’值明显降低,但新鲜兔肉和反复冻融几次后的G’值的变化趋势基本一致,这与王良玉等[21]研究带鱼鱼糜流变性、黄莉等[22]研究冷冻水饺肉馅肌原纤维蛋白流变性和邵懿[23]研究的冷冻竹荚鱼凝胶特性等的变化趋势结果相似。
在26 ℃以下G’值缓慢升高,可能是因为肌球蛋白结构发生变化,初步形成较弱的三维网络结构[23]。在46 ℃左右G’值最小,主要是因为维持网状结构的氢键在加热过程中大量断裂[24];蛋白质的变性破坏了最初形成的较弱的网状结构[25]及内源性蛋白酶被激活,蛋白质发生水解[26]。随后凝胶强度继续增加,直到65 ℃左右增加的趋势变得缓慢,是因为变性的蛋白质凝聚最终形成了稳定的、不可逆的、三维网状结构的凝胶。本实验结果表明反复冻融降低了肉糜形成凝胶的能力,冻融次数越多,影响愈大。
2.7 反复冻融对兔背最长肌肉微观结构的影响

图7 反复冻融对兔肉微观结构的影响(×50000)Fig.7 Effect of repeated freeze-thaw cycles on the microstructure of rabbit meat (× 500)
兔背最长肌反复冻融后肌纤维显微结构如图7所示,新鲜兔背最长肌肉的肌纤维排列较整齐且紧密,纤维间间隙较小;经过1、3、5次反复冻融后,肌纤维组织结构发生明显变化:肌纤维明显收缩、肌束间空隙明显增大,肌内膜破裂、肌束形状扭曲等。特别是经过第5次冻融后,肌纤维边界不清、排列混乱、结构松散等。这与夏秀芳[1]、阿依木古丽[27]等的研究结果一致。结果表明,反复冻融严重影响兔肉的品质。
3 结 论
随着兔肉背最长肌冻融次数的增加,肌肉的pH值、剪切力和溶解度都显著降低(P<0.05);解冻损失和蒸煮损失显著增加(P<0.05),表明肌肉保水性下降;亮度(L*)和黄度(b*)逐渐增加,红度(a*)显著降低,表明肌肉反复冻融后失去了新鲜肉应有的颜色;G’在加热过程中也随冻融次数的增加而逐渐降低,兔肉蛋白形成凝胶的能力减弱;微观结构发生明显变化,肌内膜破裂、肌束间空隙增大、结构松散、肌纤维严重断裂等。
由于反复冻融会导致肌肉结构和特性的变化,降低肉的品质特性(保水性、颜色等)和加工特性(溶解度、凝胶能力)等;且反复冻融次数越多,对品质特性的影响越大。所以,在兔肉的储运过程中应尽可能地减少温度的波动、减少反复冻融的频率和程度;同时,建议加工企业在选购兔肉原料时,要调查兔肉原料的来源和运输、周转过程,尽可能避免选用反复冻融的原材料。
[1] 夏秀芳, 孔宝华, 郭园园, 等. 反复冷冻-解冻对猪肉品质特性和微观结构的影响[J]. 中国农业科学, 2009, 42(3): 982-988.
[2] BERTRAM H C, ANDERSEN R H, ANDERSEN H J. Development in myofibrillar water distribution of two pork quality during 10-month freezer storage[J]. Meat Science, 2007, 75(1): 128-133.
[3] HANSEN E, JUNCHER D, HENCKEL P, et al. Oxidative stability of chilled pork chops following long term freeze storage[J]. Meat Science, 2004, 68(3): 479-484.
[4] BOONSUMREJ S, CHAIWAN ICHSIRI S, TANTRATIAN S, et al. Effects of freezing and thawing on the quality changes of tiger shrimp (Penaeus monodon) frozen by air-blast and cryogenic freezing[J]. Journal of Food Engineering, 2007, 80(1): 292-299.
[5] 中华人民共和国卫生部. GB/T 9695.5—2008 肉与肉制品pH测定[S].北京: 中国标准出版社, 2008.
[6] XIONG YoulingL.. A comparison of the rheological characteristics of different fraction of chicken myofibrillar proteins[J]. Journal of Food Biochemistry, 1993, 16(4): 217-227.
[7] KINGSLEY K A, XIONG Y L, KWAKU A. Influence of salt and pH on the solubility and structural characteristics of transglutaminasetreated wheat gluten hydrolysate[J]. Food Chemistry, 2008, 107(3): 1131-1137.
[8] HAGA S, OHASHI T. Heat induced gelation of a mixture of myosin B and soybean protein[J]. Agricultural and Biological Chemistry, 1984, 48(4): 1001-1007.
[9] 张崟, 王卫. 样品处理方法对肉的pH值测定结果影响[J]. 农产品加工: 学刊, 2012(10): 141-142.
[10] 周光宏. 畜产品加工学[M]. 北京: 中国农业出版社, 2002: 54-55.
[11] QI J, LI C B, CHEN Y J, et al. Changes in meat quality of ovine longissimus dorsi muscle in response to repeated freeze and thaw[J]. Meat Science 2012, 92(4): 619-626
[12] 樊金山, 黄明, 汤春辉, 等. 快速冷却对兔肉背最长肌肉品质的影响[J].食品科学, 2012, 33(8): 274-278.
[13] 戚军. 反复冻融对羊肉品质的影响研究[D]. 南京: 南京农业大学, 2009: 49.
[14] 李金平, 李春保, 徐辛莲, 等. 反复冻融对牛外脊肉品质的影响[J].江苏农业学报, 2010, 26(2): 406-410.
[15] FAROUK M M, WIELICZKO K J, MERTS I. Ultra-fast freezing and low storage temperatures are not necessary to maintain the functional properties of manufacturing beef[J]. Meat Science, 2004, 66(1):171-179.
[16] SHANKS B C, WULF D M, MADDOCK R J. Technical note: the effect of freezing on Warner-Blatzler shear force values of beef longissimus steaks across several post-mortem aging periods[J]. Journal of Animal Science, 2002, 80(8): 2122-2125.
[17] POMRAT S, SUMATE T. Changes in the ultrastructure and texture of prawn muscle (Macrobrachuim rosenbergii) during cold storage[J]. LWT-Food Science and Technology, 2007, 40(10): 1747-1754.
[18] MARTINO M N, ZARITZKY N E. Ice crystal size modifications during frozen beef storage[J]. Journal of Food Science, 1988, 53(6): 1631-1637.
[19] PAN B S, YEH W T. Biochemical and morphological changes in grass shrimp (Penaeus monodon) muscle following freezing by air blast and liquid nitrogen methods[J]. Journal of Food Biochemistry, 1993, 17(3): 147-160.
[20] BENJAKUL S. BAUER F. Physicochemical and enzymatic changes of cod mu scle proteins sub jected to different freeze-thaw cycles[J]. Journal of the Science of Food and Agriculture, 2000, 80(8): 1143-1150.
[21] 王良玉, 何明祥, 庞杰, 等. 魔芋葡甘聚糖凝胶体系对带鱼鱼糜流变及质构特性的影响[J]. 西南大学学报: 自然科学版, 2013, 35(6): 88-94.
[22] 黄莉, 孔保华, 夏秀芳, 等. 脂肪添加量和冻藏时间对冷冻水饺肉馅肌原纤维蛋白氧化和凝胶特性的影响[J]. 食品科学, 2013, 34(4): 261-266.
[23] 邵懿. 冷冻竹夹鱼凝胶特性的研究[D]. 青岛: 中国海洋大学, 2008: 38-39.
[24] EGELANDSDAL B, FRETHEIM K, SAMEJIMA K. Dynamic rheological measurements on heat induced myosin gels: effect of ionic strength, protein concentration and addition of adenosine triphosphate or pyrophosphate[J]. Journal of the Science of Food and Agriculture, 1986, 37(9): 915-926.
[25] BENJAKUL S, VISESSANGUAN W, SRIVILAI C. Gel properties of bigeye snapper surimi as affected by setting and porcine plasma proteins[J]. Journal of Food Quality, 2001, 24(5): 453-472.
[26] MONTEJANO J G, HAMANN D D, LANIER T C. Thermally induced gelation of selected communited muscle systems-rheological changes during processing, final strengths and microstructure[J]. Journal of Food Science, 1984, 49(6): 496-505.
[27] 阿依木古丽, 蔡勇, 陈士恩, 等. 冻融对早胜牛肉品质及微细结构的影响[J]. 畜牧兽医学报, 2011, 42(3): 375-380.
Effects of Freeze-Thaw Cycle on the Quality Properties and Microstructure of Rabbit Muscle
ZHANG Dan1, SUN Jin-hui1, WANG Xiao-xiang1, S HANG Yong-biao1,2,3,*, PENG Zeng-qi4
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Quality and Safety Risk Assessment Laboratory of Products Preservation (Chongqing), Ministry of Agriculture, Chongqing 400715, China; 3. Chongqing Special Food Programme and Tec hnology Research Center, Chongqing 400715, China; 4. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
The purpose of this study was to research the effects of freeze-thaw cycle on the quality properties and microstructure of rabbit muscle. The rabbit longissimus dorsi was frozen for 7 d at - 40 ℃ and then allowed to naturally thaw. The thawing loss (TL), pH, color, cooking loss (CL), shear force (SF) protein solubility, rheological properties and microstructure of rabbit meat were studied. The results showed that with increasing the number of freeze- thaw cycles, the pH, SF and protein solubility were significantly decreased (P < 0.05), while TL and CL were increased sig nificantly (P < 0.05). L* (lightness) and b* (yellowness) rose gradually, whereas a* (redness) declined significantly (P < 0.05). G’also declined gradually during the heating process. The microstructure was altered obviously, as indicated by endomysial breakdown, increased space between fibers, loose structure, and so on. After repeated freeze-thaw cycles, the quality properties of rabbit meat declined and the microstructure of muscle was damaged seriously.
rabbit; freeze-thaw cycle; quality properties; rheological properties; microstructure
TS251
A
1002-6630(2014)07-0038-05
10.7506/spkx1002-6630-201407008
2013-12-16
公益性行业(农业)科研专项 (201303144);国家现代农业(兔)产业技术体系建设专项(CARS-44-D-1)
张丹(1990—),女,硕士研究生,研究方向为食品微生物。 E-mail:zhangdan023@foxmail.com
*通信作者:尚永彪(1964—),男,教授,博士,研究方向为农产品加工。E-mail:shangyb64@sina.com
