桑色素对黄嘌呤氧化酶活性的抑制作用
2014-01-18王亚杰张国文
王亚杰,张国文*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
桑色素对黄嘌呤氧化酶活性的抑制作用
王亚杰,张国文*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
在磷酸盐缓冲体系(pH 7.5)中,利用紫外光谱法、荧光光谱法和圆二色谱法,结合分子模拟技术研究了桑色素对黄嘌呤氧化酶(xanthine oxidase,XO)活性的抑制机理。结果表明:桑色素是一种有效的可逆性混合型抑制剂,其半数抑制浓度(IC50)和抑制常数(Ki)分别为1.35×10–5mol/L和1.21×10–5mol/L;桑色素通过疏水作用力与XO形成基态复合物导致XO内源荧光的猝灭,并诱导XO的二级结构发生改变;分子模拟结果进一步证实桑色素主要通过疏水作用力结合到 XO的活性中心,与Phe914、Phe649、Phe1009、Leu648、Leu1014和Leu873等主要氨基酸发生作用。推测桑色素进入XO的疏水腔,阻碍了底物黄嘌呤进入XO活性中心并影响了XO活性中心的形成,从而抑制了XO对黄嘌呤的催化活性。
桑色素;黄嘌呤氧化酶;抑制动力学;结合性质;光谱技术;分子模拟
黄嘌呤氧化酶(xanthine oxidase,XO)是体内核酸代谢中重要的酶,能催化次黄嘌呤和黄嘌呤生成尿酸[1]。当体内XO活性过高,会引起尿酸生成过多,过高的尿酸将导致高尿酸血症,进而引发痛风[2]。痛风已成为继糖尿病之后的第二大代谢性疾病,这种疾病已被联合国列为21世纪 20大顽症之一[3]。最新的流行病学研究表明,由于生活水平不断提高、饮食结构的不合理和生活节奏的加快,我国痛风的发病率逐年上升,已高于世界平均水平[3]。由于XO是人体内产生尿酸过程中的一种关键性酶,因而将XO作为作用靶点,抑制其活性成为了临床治疗痛风的主要途径。目前,别嘌呤醇是用于临床治疗痛风的主要药物,由于会引起过敏、肝肾损伤及骨髓抑制等不良反应,这在一定程度上限制了其临床应用[4]。因此,研究开发新的XO抑制剂是一项重要的课题。
桑色素(morin)是一种存在于洋葱、番石榴叶和海藻等植物中的黄酮类化合物[5],具有抗炎、抗菌、抗病毒和抗肿瘤等生物活性[6-8]。有文献报道桑色素对XO具有良好的抑制活性[9],但其与XO的结合性质和抑制机理尚不明确。因此,本实验利用紫外、荧光和圆二色谱等光谱方法并结合分子模拟技术探测桑色素与XO的结合作用及其抑制XO活性的分子机理,以期为桑色素作为XO抑制剂的开发应用提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
桑色素(分析级,纯度≥98%),购于阿拉丁试剂有限公司,用pH 7.5的磷酸盐缓冲液配制成浓度为5.0×10-3mol/L的贮备液(含10%二甲基亚砜)。
牛乳黄嘌呤氧化酶(EC 1.17.3.2,酶活力35.7 U/mL,用pH 7.5的磷酸盐缓冲液现配现用)、黄嘌呤和别嘌呤醇 美国Sigma公司;其他试剂均为分析纯,实验用水为超纯水。
UV-2450型紫外-可见分光光度计 日本岛津公司;F-7000型荧光光度计 日本日立公司;MOS-450型圆二色谱仪 法国Bio-Logic公司;pHS-3C型酸度计 上海雷磁仪器厂。
1.2 方法
1.2.1 桑色素对XO的抑制作用
参考Yan Jiakai等[10]的实验方法,将7.5×10-8mol/L XO和不同浓度的桑色素于37 ℃条件下孵化2.5 h,放至室温后加入一定浓度(5.0×10-5mol/L)的底物黄嘌呤,测定295 nm波长处的光密度值,计算含不同浓度桑色素体系中XO的相对活性。
固定底物浓度(5.0×10-5mol/L),测定不同浓度桑色素条件下,酶活力(用’OD295nm表示,下同)随XO浓度的变化,根据其相关性判断桑色素对XO的抑制可逆性。
固定XO浓度(7.5×10-8mol/L),测定不同浓度桑色素条件下,’OD295nm随底物浓度的变化,以Lineweaver-Burk双倒数方程作图,判断桑色素对XO的抑制类型,并计算抑制常数(Ki)。
1.2.2 桑色素与XO作用的荧光光谱和圆二色谱研究
在2 mL反应体系中,固定XO浓度,逐次加入一定体积(5 øL/次)桑色素溶液,混合均匀后静置5 min,分别扫描XO和桑色素-XO体系的荧光光谱(激发波长为280 nm,激发和发射狭缝均为5 nm)。
在190~250 nm波长范围内,分别测定不同浓度比的桑色素-XO体系的圆二色谱。通过在线Dichroweb软件(http://dichroweb.cryst.bbk.ac.uk/html/home.shtml)计算与桑色素作用前后XO的二级结构含量。
1.2.3 分子 模拟
根据文献[11]下载XO的晶体模型(PDB ID: 3ETR),并利用Chem3D Ultra 8.0软件获得桑色素的3D结构。通过AutoDock4.2软件结合Lamarckian Genetic Algorithm算法[12]进行处理分析。
2 结果与分析
2.1 桑色素对XO的抑制率

图1 桑色素对XO的抑制作用Fig.1 Inhibitory effect on XO of morin
如图1所示,随着桑色素的加入,XO的相对活性不断降低,桑色素对酶的抑制作用呈现一定的浓度依赖关系;桑色素和别嘌呤醇(阳性对照)的IC50分别为1.35×10–5mol/L和1.79×10–6mol/L,表明桑色素对XO具有一定的抑制效果,其IC50与Yu Zhifeng等[9]得到的IC50值为(1.80±0.25)×10–5mol/L一致。
2.2 桑色素对XO的抑制类型分析

图2 桑色素对XO的抑制可逆性Fig.2 Inhibitory reversibility of morin on XO
由图2可逆性实验结果可知,不同浓度桑色素存在下,’OD295nm与XO浓度变化为线性关系且都经过原点,表明桑色素对XO的抑制作用是可逆的[13]。
根据Lineweaver-Burk双倒数方程作图(图3)得一组相交于第二象限的直线,桑色素的存在引起酶的Km值增大,Vm值减小,表明桑色素对XO抑制类型为混合抑制[14]。以直线的斜率和截距对桑色素浓度作图(图3插图),均呈现良好的线性关系,表明桑色素在XO上只有一个结合位点[15]。计算出Ki和抑制系数(α)分别为1.21×10–5mol/L和1.94。

图3 桑色素对XO的抑制类型Fig.3 Inhibitory type of morin on XO
2.3 桑色素猝灭XO的荧光光谱
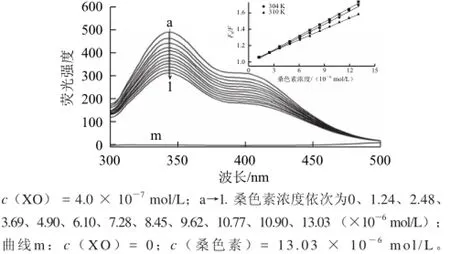
图4 桑色素-XO体系的荧光猝灭图和Stern-Volmer图Fig.4 Fluorescence quenching spectra and Stern-Volmer plot (inset) of morin-XO system
图4 显示XO在342 nm波长处有一强的荧光发射峰(主要由色氨酸和酪氨酸产生)。随着溶液中桑色素浓度不断增加,XO的荧光峰强度逐渐降低,但峰的位置没有发生移动,表明桑色素与XO发生了相互作用,但对色氨酸和酪氨酸微环境的极性没有明显的影响[16]。

表1 不同温度下桑色素-XO体系的猝灭常数(Ksv)、结合常数(Ka)、结合位点数(n)及热力学参数Table 1 Quenching constant (Ksv), association constant (Ka), the number of binding sites (n) and thermodynamic parameters of morin-XO system at different temperatures
根据Stern-Volmer及其修正方程[17]:F0/F = 1+Kqτ0[Q] = 1+Ksv[Q],F0/(F0-F) = (1/”aKa[Q])+1/”a,lg[(F0-F)/F]= lgKb+nlg[Q],分别求得3 个温度(298、304、310 K)条件下的猝灭常数(Ksv)、结合常数(Ka)和结合位点数(n),列于表1中。Ksv随着温度的升高而减小且猝灭速率常数Kq值远大于生物分子的最大扩散速率常数值(2×1010L/(mol·s))[18],表明桑色素对XO荧光猝灭为形成桑色素-XO复合物的静态猝灭过程。不同温度下结合位点数n≈1,表明桑色素在XO上存在唯一的结合位点,与抑制类型分析结果一致。
由热力学关系式:l g Ka=-’H/2.3 0 3 R T+’S/2.303R,’G = ’H-T’S,求得焓变(’H)、熵变(’S)和生成自由能变(’G),结果如表1所示。’G<0,表明桑色素与XO的作用过程是一个Gibbs自由能降低的自发过程,’H>0、’S>0,表明桑色素与XO的结合是一个吸热和熵驱动过程[19],疏水作用力是桑色素与XO结合的主要驱动力[20]。
2.4 桑色素对XO二级结构的影响
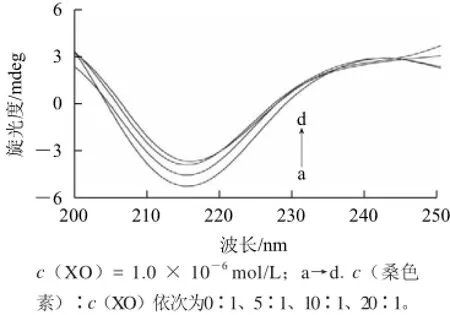
图5 桑色素-XO体系的圆二色谱图Fig.5 CD spectra of morin-XO system
图5 显示XO在216 nm波长处有明显的负峰(β-折叠特征峰)[21],当加入桑色素后峰强度减小(向零水平移动),但峰位置未发生变化,表明桑色素诱导XO结构发生一定的变化。通过在线SELCON3程序计算出XO与桑色素作用前后的二级结构含量(表2)。桑色素的加入引起XO的α-螺旋和β-转角含量有稍许升高,而β-折叠和无规则卷曲含量显示一定的降低,表明桑色素与XO结合导致XO的二级结构更加紧密,抑制了酶活性中心的形成[10]。

表2 桑色素存在下XO的二级结构含量Table 2 Secondary structure contents of XO in the presence of morin
2.5 分子模拟
为了直观地展现桑色素与XO的结合模式和空间结构,利用分子模拟技术进行分析。图6A是进行100次分子对接所产生的39 个结合区域(能量簇),每个柱形表示在该区域结合的次数,其中结合次数最多的区域结合可能性最大,且结合能量越低复合物结构越稳定,因此将结合次数最多(27 次)且结合能最低(-3.66 kcal/mol)时的结合姿态作为桑色素与XO结合的分析模型,如图6B所示。桑色素分子进入XO的疏水空腔,其B环插入到疏水性氨基酸残基Phe914、Phe1014和Phe649之间,与它们形成π—π共轭体系,这在XO识别配体过程中起重要作用[22]。此外,桑色素的苯并呋喃环与活性中心(含Mo区域)周围的其他主要氨基酸残基Ser1075、Pro1076、Asn768、Lys771、Leu648和Leu1014等发生作用。表明桑色素主要通过疏水作用力与活性中心附近的氨基酸残基发生作用,这与热力学分析结果一致。

图6 桑色素与XO的分子对接Fig.6 The molecular docking of morin and XO
3 结 论
实验结果表明,桑色素是一种可逆的混合型抑制剂,其半数抑制浓度和抑制常数分别为1.35×10–5mol/L和1.21×10–5mol/L。桑色素进入XO的疏水腔,通过疏水作用力与XO活性中心周围的主要氨基酸残基发生作用,并诱导XO的二级结构发生改变。推测桑色素进入XO的疏水腔,占据了底物黄嘌呤进入活性中心的通道,并使XO的结构更加紧密不利其形成活性中心,从而有效地抑制了XO对黄嘌呤的催化活性。
[1] 展鹏, 刘涛, 刘新泳. 以黄嘌呤氧化酶为靶点的新型非嘌嘌呤类抗痛风及高尿酸血症药物研究进展[J]. 中国药物化学杂志, 2012, 22(5): 403-415.
[2] 陆明, 张岭, 王茵. 高尿酸血症的发病机制以及黄酮类膳食对其干预作用[J]. 中国预防医学杂志, 2012, 13(8): 632-634.
[3] 王春辉, 李松. 黄嘌呤氧化酶抑制剂的研究进展[J]. 国外医学:药学分册, 2006, 33(5): 351-354.
[4] SORBERA L A, REVEL L, RABASSEDA X. Treatment of g out and hyperuricemia xanthine oxidase inhibitor[J]. Drugs Future, 2001, 26(1): 32-38.
[5] MENDOZA-WILSON A M, SANTACRUZ-ORTEGA H, BALANDR˘N-QUINTANA R R. Relationship between structure, properties, and the radical scavenging activity of morin[J]. Journal of Molecular Structure, 2011, 995(1): 134-141.
[6] PANHWAR Q K, MEMON S, BHANGER M I. Synthesis, characterization, spectroscopic and antioxidation studies of Cu (II)-morin complex[J]. Journal of Molecular Structure, 2010, 967(1): 47-53.
[7] MAKRIS D P, ROSSITER J T. Hydroxyl free radical-mediated oxidative degradation of quercetin and morin: a preliminary investigation[J]. Journal of Food Composition and Analysis, 2002, 15(1): 103-113.
[8] WOŹNICKA E, KOPACZ M, UMBREIT M, et al. New complexes of La (Ⅲ), Ce (Ⅲ), Pr (Ⅲ), Nd (Ⅲ), Sm (Ⅲ), Eu (Ⅲ) and Gd (Ⅲ) ions with morin[J]. Journal of Inorganic Biochemistry, 2007, 101(5): 774-782.
[9] YU Zhifeng, FONG W P, CHENG C H K. The dual actions of morin (3, 5, 7, 2’, 4’-pentahydroxyflavone) as a hypouricemic agent: uricosuric effect and xanthine oxidase inhibitory activity[J]. Journal of Pharmacology and Experimental Therapeutics, 2006, 316(1): 169-175.
[10] YAN Jiakai, ZHANG Guowen, HU Yuting, et al. Effect of luteolin on xanthine oxidase: inhibition kinetics and interaction mechanism merging with docking simulation[J]. Food Chemistry, 2013, 141(4): 3766-3773.
[11] NONGONIERMA A B, MOONEY C, SHIELDS D C, et al. Inhibition of dipeptidyl peptidase IV and xanthine oxidase by amino acids and dipeptides[J]. Food Chemistry, 2013, 141(1): 644-653.
[12] MORRIS G M, GOODSELL D S, HALLIDAY R S, et al. Automated docking using a Lamarckian genetic algorithm and an empirical binding free energy function[J]. Journal of Computational Chemistry, 1998, 19(14): 1639-1662.
[13] 龚盛昭. 肉桂腈抑制酪氨酸酶活性的动力学研究[J]. 食品科技, 2012, 36(12): 10-13.
[14] FUKUNARI A, OKAMOTO K, NISHINO T, et al. Y-700 [1-[3-cyano-4-(2, 2-dimethylpropoxy) phenyl]-1H-pyrazole-4-carboxylic acid]: a potent xanthine oxidoreductase inhibitor with hepatic excretion[J]. Journal of Pharmacology and Experimental Therapeutics, 2004, 311(2): 519-528.
[15] WANG Zhijiang, LEE J, SI Yuexiu, et al. Toward the inhibitory effect of acetylsalicylic acid on tyrosinase: integrating kinetics studies and computational simulations[J]. Process Biochemistry, 2013, 48(2): 260-266.
[16] GUO Xingjia, JING Kui, GUO Chuang, et al. The investigation of the interaction between oxybutynin hydrochloride and bovine serum albumin by spectroscopic methods[J]. Journal of Luminescence, 2010, 130(12): 2281-2287.
[17] LU Yan, WANG Gongke, LU Xiumin, et al. Molecular mechanism of interaction between norfloxacin and trypsin studied by molecular spectroscopy and modeling[J]. Spectrochimica Acta Part A, 2010, 75(1): 261-266.
[18] LAKOWICZ J R. Principles of fluorescence spectroscopy[M]. 3rd ed. New York: Springer, 2006: 277-285.
[19] ZHANG Guowen, CHEN Xiuxia, GUO Jinbao, et al. Spectroscopic investigation of the interaction between chrysin and bovine serum albumin[J]. Journal of Molecular Structure, 2009, 921(1): 346-351.
[20] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry, 1981, 20(11): 3096-3102.
[21] HADIZADEH M, KEYHANI E, KEYHANI J, et al. Functional and structural alterations induced by copper in xanthine oxidase[J]. Acta Biochimica et Biophysica Sinica, 2009, 41(7): 603-617.
[22] TUNG Y T, HSU C A, CHEN C S, et al. Phytochemicals from Acacia confusa heartwood extracts reduce serum uric acid levels in oxonateinduced mice: their potential use as xanthine oxidase inhibitors[J]. Journal of Agricultural and Food Chemistry, 2010, 58(18): 9936-9941.
Inhibition Effect of Morin on Xanthine Oxidase Activity
WANG Ya-jie, ZHANG Guo-wen*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
The inhibition mechanism of morin on xanthine oxidase (XO) in phosphate buffer (pH 7.5) was investigated by UV-vis absorption, fluorescence and circular dichroism spectroscopy combined with molecular simulation technique. The results showed that morin could be a good reversible XO inhibitor in a mixed-type manner with an inhibitory oncentrationleading to a 50% loss in the activity (IC50) and an inhibition constant (Ki) of 1.35 × 10–5mol/L and 1.21 × 10–5mol/L,respectively. Strong fluorescence quenching and secondary str ucture changes of XO were observed due to the formation of a complex with morin. The results from molecular simulation have further confirmed that morin was mainly bound to the active site of XO where it interacted with some primary amino acid residues such as Phe914, Phe649, Phe1009, Leu648, Leu1014, Leu873, etc. by hydrophobic force. It could be concluded that morin inhibited XO catalytic activity by entering into XO’s hydrophobic cavity, blocking the insertion of substrate xanthine and influencing the formation of active center.
morin; xanthine oxidase; inhibition kinetics; binding characteristics; spectroscopic techniques; molecular simulation
TS207.3
A
1002-6630(2014)13-0143-04
10.7506/spkx1002-6630-201413027
2014-05-09
国家自然科学基金地区科学基金项目(31060210);江西省自然科学基金项目(20142BAB204001);
食品科学与技术国家重点实验室项目(SKLF-ZZB-201305;SKLF-ZZA-201302;SKLF-KF-201203)
王亚杰(1988—),男,硕士,研究方向为功能食品开发与利用。E-mail:1025579088@qq.com
*通信作者:张国文(1966—),男,教授,博士,研究方向为食品安全与食品化学。E-mail:gwzhang@ncu.edu.cn
