低温真空膨化与自然干制对红枣抗氧化活性的影响
2014-01-18杜丽娟冀晓龙许芳溢杨世龙
杜丽娟,冀晓龙,许芳溢,杨世龙,王 敏*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
低温真空膨化与自然干制对红枣抗氧化活性的影响
杜丽娟,冀晓龙,许芳溢,杨世龙,王 敏*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
目的:研究低温真空膨化和自然干制对红枣抗氧化成分及活性的影响,为生产加工优质枣产品和低温真空膨化技术在红枣加工方面应用提供科学依据。方法:以矮化密植枣树所得枣果为材料,采用Folin-Ciocalteu与NaNO2-Al(NO3)3法测定总酚、总黄酮含量;通过DPPH自由基清除率、ABTS+·清除能力、总还原力和抗亚油酸过氧化能力等指标表征枣果抗氧化能力;采用高效液相色谱法对酚类化合物进行定性定量分析。结果:红枣经膨化后总酚含量显著增加,而总黄酮未发生明显变化,自然干制使总酚、总黄酮含量显著降低。膨化枣DPPH自由基清除能力和总还原力显著优于鲜枣和自然干制枣,自然干制处理使红枣ABTS+•清除能力和β-胡萝卜-亚油酸抗氧化活性显著低于膨化枣与鲜枣。膨化枣中总酚、总黄酮和抗氧化能力显著高于自然干制枣。干制处理使枣果中酚类化合物组成发生明显变化,膨化枣中没食子酸、对羟基苯甲酸、咖啡酸、对香豆酸、阿魏酸、芦丁、肉桂酸和槲皮素的含量最高。相关性研究表明鲜枣与干制枣中抗氧化活性与总酚、总黄酮显著相关。结论:低温真空膨化枣含有丰富的酚类化合物与最高抗氧化能力,且加工时间短,口感酥脆香甜。综上所述,低温真空膨化技术可作为一种可用于规模化干制枣的现代化加工技术。
枣;低温真空膨化;高效液相色谱;抗氧化能力;酚类物质
枣(Zizyphus jujube Mill.)属于鼠李科枣属植物,是我国的特色果品之一,其栽培历史悠久,种植面积广泛[1]。枣不仅营养丰富,味美香甜,同时又是补中益气、养血安神、缓和药性的常用中药,是天然药食同源的果品[2]。枣含有较丰富的糖、氨基酸、矿物质、蛋白质等营养成分,且富含酚类化合物,能有效保护组织免受自由基引起的氧化损伤,可清除自由基、抗老化、抑制脂质过氧化、防止心血管疾病和抑制癌细胞等[3]。
鲜枣季节性强,贮藏期短,极易腐烂,造成极大的资源浪费。为了延长鲜果货架期,常采用自然晾晒方式干制果品。在自然晒干过程中,由于阳光直射,造成果品褐变、形状皱缩、功能性物质大量损失等[4],而且晾晒过程中其干燥参数不可控制,极易受天气状况影响而导致枣霉变、腐烂,给枣农带来极大的经济损失。因此,合理的干燥方式对枣保藏和销售极其重要,因其可改变食物结构,赋予新风味,干燥产品体积小、质量轻,便于储运。根据Gao Qinghan等[5]的研究结果表明:微波和冷冻干燥是枣果的最佳干燥技术,分别有较高的酚类化合物与总酚含量。但在红枣实际加工中,微波技术由于高成本和操作等问题未能实现枣规模化生产,冷冻干燥枣果所需时间长且成本高昂。此外,枣含糖量极高,冷冻干燥产品存在易吸潮、货架期短等不足之处,基于以上原因,还未真正投入到枣连续化成产过程中。
本实验采用低温真空膨化技术干制红枣,是一种快速而且成本较为低廉的新型果蔬干燥技术。该技术能够生产出类似冷冻干燥的产品,并有复水性高,复水速度快、色香味保存好等优点[6]。苹果、马铃薯等部分果蔬食品在国外已实现连续化、规模化生产。在我国有关低温真空膨化果蔬脆片的研究大多集中在工艺优化方面,而对膨化处理对枣中抗氧化物质的影响却鲜见报道。为此,本实验以矮化密植枣树所得梨枣为材料,以鲜枣为对照,比较膨化干制和传统自然干制对枣中总酚、总黄酮、酚类物质组成及抗氧化能力的影响,旨在为低温真空膨化技术在枣干制方面的应用提供依据,为生产优质的膨化产品提供新思路。
1 材料与方法
1.1 材料与试剂
成熟梨枣采摘于陕西榆林米脂县银州镇孟岔村山地枣示范基地矮化密植枣园,采摘后预冷并运至0~4 ℃冷库中储藏。
芦丁、槲皮素、儿茶素、表儿茶素、没食子酸、原儿茶酸、对羟基苯甲酸、绿原酸、香草酸、咖啡酸、对香豆酸、阿魏酸、鞣花酸、肉桂酸、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-双(3-乙基-苯并噻唑啉-6-磺酸)(2,2-azinobis-(3-ethylbenzthiazoline-6-sulfonate),ABTS)、福林酚试剂 美国Sigma公司;吐温-40 德国默克公司;无水甲醇、无水乙醇、盐酸、Al(NO3)3、NaOH、NaNO2、Na2CO3等均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
HH-4水浴锅 国华电器有限公司;JD400-3电子分析天平 沈阳龙腾电子有限公司;ESB-300实验室均质机 上海易勒机电设备有限公司;KDC-40低速离心机、HC-2516高速离心机 科大创新股份有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;KQ-700DE型数控超声波清洗器 昆山市超声仪器有限公司;UV-1240分光光度计 日本岛津公司;高效液相色谱仪 美国Waters公司。
1.3 方法
1.3.1 红枣的干制处理
1.3.1.1 膨化处理
参照毕金峰[7]的方法加以改进,具体步骤如下:挑选大小均一的红枣,清除表面杂质,手工去核,切成厚度约为5 mm空心枣圆片,浸没在0.2%柠檬酸溶液中30 min,沥干后使用预干机使水分含量达到约为30%。均湿数小时,均一平铺于膨化罐的钢丝托盘上,密封膨化罐。在开启真空泵之前,通过管道通入热蒸汽使罐温达到约90 ℃,通过空气压缩机使罐内的压力达到0.2 MPa,20 min后开启泄压阀,原料瞬间膨化并抽真空,迅速将蒸汽管道中通入冷却水使其温度降至80 ℃,抽空2.5 h(-0.098 MPa),然后通入冷却水将温度降至20~25 ℃持续5~10 min,打开通气阀门,恢复常压后开罐取出样品,包装。
1.3.1.2 晒干处理
根据Gao Qinghan等[5]并稍做修改,将新鲜枣随机分成若干份,称重后置于白色托盘中,白天置于室外曝于阳光下,晚上放置于室内,直至水分含量约为22%。
1.3.2 抗氧化物质的提取
将样品破碎,分别称取适量鲜枣和干制枣,按照1∶50(m/V)加入80%甲醇溶液,均质后超声提取30 min,提取液 3 500 r/min离心15 min,收集上清液,重复提取3 次,合并上清液。45 ℃旋转蒸干,纯甲醇溶解残余并定容到10 mL,得样品提取液,分装于离心管中,-18 ℃保存备用,用于测定总酚、总黄酮和抗氧化活性。
1.3.3 总酚含量的测定
总酚含量的测定按Guo Xudan等[8]方法,取125 μL稀释后的抗氧化提取液与500 μL蒸馏水混合后加入125 μL Folin-Ciocalteu试剂。充分混匀在室温下放置6 min,然后加入1.25 mL 7%碳酸钠溶液及1 mL蒸馏水,涡旋混匀置于暗处反应90 min,于760 nm波长处测定吸光度。样品总酚含量以每克样品干基(dry weight,DW)中含有相当没食子酸(gallic acid,GAE)的毫克数(mg GAE/g DW)表示。
1.3.4 总黄酮含量的测定
总黄酮的测定参照于金刚等[9]方法。取一定量的样品提取液与200 μL 5% NaNO2溶液混匀,避光反应6 min,然后加入200 μL 10% Al(NO3)3溶液混合后静置6 min,再加入2 mL 4% NaOH溶液,最后加入蒸馏水使反应液体积为5 mL,混匀后置于室温下避光反应15 min,于510 nm 波长处测定吸光度。以芦丁为标准品,样品总黄酮含量以每克样品干基中所含芦丁的当量毫克数表示(mg 芦丁当量/g DW)。
1.3.5 抗氧化活性的测定
1.3.5.1 DPPH自由基清除能力的测定
参照Wu Chunsen等[10]方法,取1 mL稀释样品液与1 mL DPPH甲醇溶液混合摇匀,室温避光反应30 min后,于517 nm波长处测定吸光度。以Trolox为标准品,样品的DPPH自由基清除能力以100 g样品干基中所含Trolox的当量毫摩尔数表示(mmol Trolox当量/100 g DW)。
1.3.5.2 ABTS+•清除能力的测定
参照Gao Qinghan等[11]的方法进行测定,将25 mL 5 mol/L ABTS溶液与1.5 g二氧化锰混合均匀,在室温下放置30 min,以制备ABTS+•储备液。用pH 7.4的磷酸缓冲液将ABTS+•溶液调至在734 nm波长处吸光度(A734nm)为0.7的工作液。取200 μL稀释提取液与3.0 mL ABTS+•溶液迅速混匀后测定A734nm值。以Trolox为标准品,样品的ABTS+•清除能力以100 g样品干基中所含Trolox的当量毫摩尔数表示(mmol Trolox当量/100 g DW)。
1.3.5.3 总还原力的测定
参照徐元元等[12]方法进行测定,取1 mL稀释后的提取液与2 mL 0.2 mol/L磷酸缓冲液(pH 6.6)和2 mL 1%铁氰化钾混合,于50 ℃水浴反应20 min,快速冷却,再加入2 mL 10% 三氯乙酸终止反应,振荡1 min,混匀。取2 mL反应液,加入0.4 mL 0.1% FeCl3,在加入2 mL蒸馏水,暗处反应30 min于700 nm波长处测定吸光度。以VC为标准品,样品总还原力以100 g样品干基中所含VC的当量毫克数表示(mg VC当量/100 g DW)。
1.3.5.4 β-胡萝卜素-亚油酸体系
参照Shahidi等[13]的方法测定,将2.0 mg β-胡萝卜素、45 mg亚油酸、350 mg吐温-40用氯仿溶解定容至10 mL,形成β-胡萝卜素-亚油酸乳化体系,避光保存。取2 mL上述溶液于圆底烧瓶中,45 ℃旋转蒸干,然后用富氧水定容至100 mL。将100 μL提取液与4 mL上述反应介质液混合,50 ℃水浴反应60 min,在470 nm波长处测定吸光度。空白组为无β-胡萝卜素溶液,对照组为用80%甲醇代替提取液。重复测定3 次,结果用抗氧化系数(antioxidant activity coeffi cient,AAC)表示。

式中:As60为样品反应体系60 min时的吸光度;Ac60为对照反应体系60 min时的吸光度;Ac0为对照反应体系0 min时的吸光度。
1.3.6 酚类物质分析
HPLC法分析样品的制备:方法同于抗氧化物质提取,测试前用0.45 μm针头式过滤器过滤。
色谱条件[5]:Waters Symmetry C18柱(4.6 mm× 150 mm,5 μm),紫外检测波长:280 nm;柱温:30 ℃,进样量:10 μL,流速:0.8 mL/min,流动相A:甲醇,流动相B:超纯水(用磷酸调节pH值为2.6)。梯度洗脱程序:0 min,15% A;15~25 min,25% A;65 min,75% A;70 min,15% A。
1.4 数据统计与分析
数据统计分析采用DPS数据处理系统所有样品进行3次重复,实验数据采用±s表示。
2 结果与分析
2.1 不同干制方式对红枣中总酚和总黄酮含量的影响
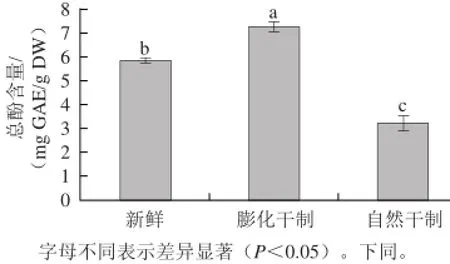
图1 干制方式对红枣中总酚含量的影响Fig.1 Effect of drying methods on the content of total phenolics in dried jujubes
由图1可知,膨化处理后枣果中总酚含量不仅没有下降,反而显著增加(P<0.05)。自然晒干使红枣中总酚含量显著减少(P<0.05),损失将近45%。
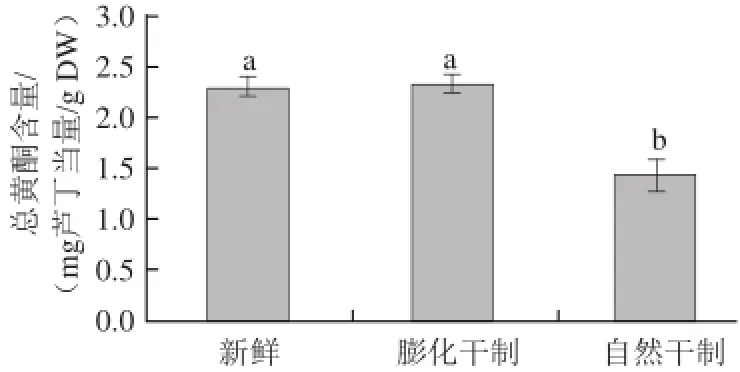
图2 干制方式对红枣中总黄酮含量的影响Fig.2 Effect of drying methods on the content of total flavonoids in dried jujubes
由图2可知,干制处理对红枣中总黄酮的影响与总酚有相似的趋势,膨化枣与鲜枣总黄酮之间无显著差异(P>0.05),自然晒干引起总黄酮显著下降(P<0.05),其损失率为37%。两种不同干制方式之间存在显著差异(P<0.05),膨化枣中总酚、总黄酮含量比自然晒干枣高38%和55%。结果表明膨化处理使红枣中总酚含量显著增加,对总黄酮含量无显著性影响(P>0.05),而自然干制处理导致总酚、总黄酮大量损失。
2.2 抗氧化能力的比较
2.2.1 不同干制方式对红枣DPPH自由基清除能力的影响
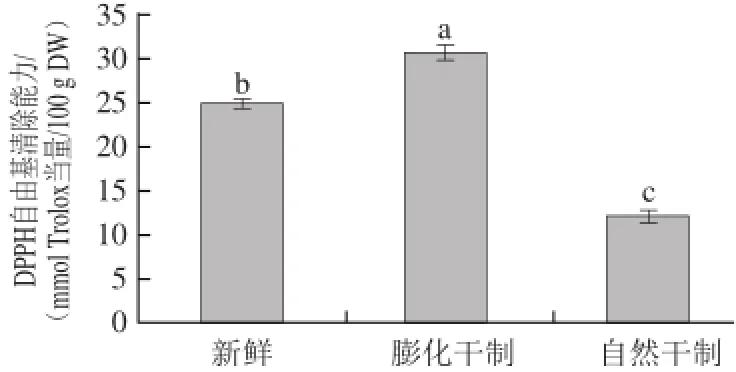
图3 干制方式对红枣DPPH自由基清除能力的影响Fig.3 Effect of drying methods on DPPH radical scavenging capacity of dried jujubes
由图3可知,鲜枣与干制枣DPPH自由基清除能力在12.23~30.61 mmol Trolox当量/100 g DW之间。红枣经膨化后清除自由基能力显著增加(P<0.05),与鲜枣相比,增加了23%。而自然干制使红枣清除自由基能力显著降低(P<0.05)。可见,膨化干制枣的DPPH自由基清除能力显著高于鲜枣与自然干制枣(P<0.05)。
2.2.2 不同干制方式对红枣ABTS+•清除能力的影响

图4 干制方式对红枣ABTS+·清除能力的影响Fig.4 Effect of drying methods on ABTS radical scavenging capacity of dried jujubes
由图4可知,膨化枣提取物清除能力最强,高达7.79 mmol Trolox当量/100g DW,鲜枣次之,自然干制枣最弱。在ABTS+•清除能力中膨化枣与鲜枣之间无显著差异(P>0.05),而自然干制使枣果ABTS+•清除能力显著下降(P<0.05),其降低了54%。研究结果表明,膨化枣与鲜枣有相近的ABTS+•清除能力,而膨化枣ABTS+•清除能力比自然干制枣高56%。
2.2.3 不同干制方式对红枣总还原力的影响

图5 干制方式对红枣总还原能力的影响Fig.5 Effect of drying methods on reducing power of dried jujubes
由图5可知,鲜枣和干制枣的总还原力在235.52~509.98 mg VC当量/100 g DW范围内变化。低温真空膨化处理导致总还原力显著增强(P<0.05),而自然干制使总还原力显著降低(P<0.05),相比于鲜枣总还原力下降47%。膨化枣的总还原力较鲜枣与自然干制枣分别高14%和54%。
2.2.4 不同干制方式对红枣β-胡萝卜素-亚油酸抗氧化活性的影响
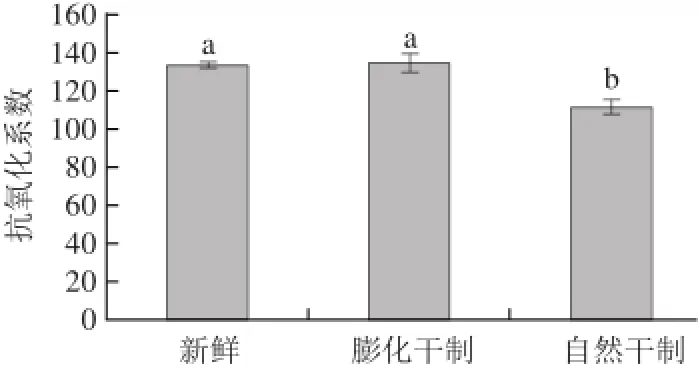
图6 干制方式对红枣抗氧化活性的影响Fig.6 Effect of drying methods on AAC value of dried jujubes
如图6所示,红枣经膨化后AAC与鲜枣无显著性差异(P>0.05),而自然干制导致其含量显著降低(P<0.05)。本结果表明,膨化干制枣的β-胡萝卜素-亚油酸抗氧化活性较鲜枣和自然干制枣均高出17%。
2.3 不同干制方式红枣中抗氧化物质的组成分析
HPLC方法根据各标准品的保留时间和峰面积可以定性及定量分析得到酚类物质种类、含量,因而相对于分光光度法而言能提供更精准深入的信息[14]。所检测的14 种酚类物质的混合标准品色谱图如图7所示。鲜枣和干制红枣提取物的多酚类物质如表1所示,鲜枣与干制红枣中酚类物质含量和组成有很大差别,干制方式的不同也会导致酚类化合物组成、含量不同。
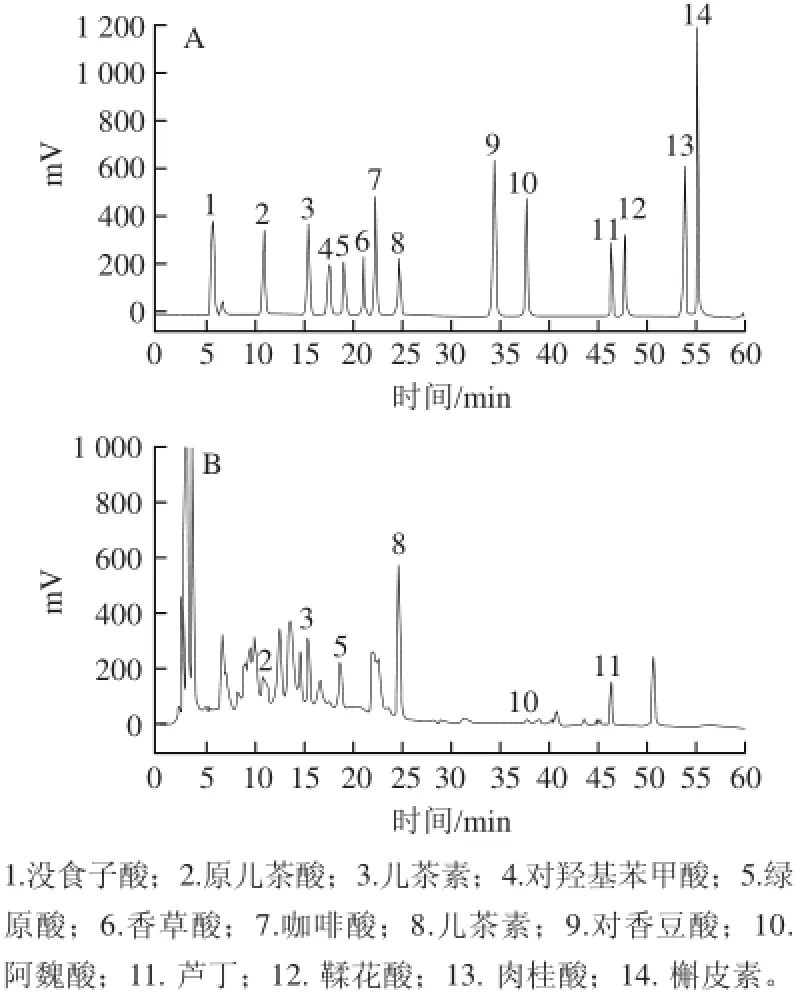
图7 多酚标准品(A)和新鲜红枣的多酚化合物(B)HPLC色谱图Fig.7 HPLC profiles of phenolic standards (A) and fresh jujubes (B)
鲜枣中检测到4 种黄酮类化合物,其中表儿茶素、儿茶素和芦丁是鲜枣中主要的黄酮类物质,其含量占已检测到多酚总量的57%、13%和16%。鲜枣中表儿茶素、儿茶素含量可高达49.26 μg/g DW和10.84 μg/g DW,膨化处理显著减低了表儿茶素、儿茶素的含量(P<0.05),而两者都未在晒干枣中检测到。但低温真空膨化干燥对芦丁、槲皮素则有不同的影响,膨化枣中芦丁与槲皮素的含量显著高于鲜枣果(P<0.05),其芦丁含量是晒干枣的4倍,而槲皮素在晒干枣中未检测到。
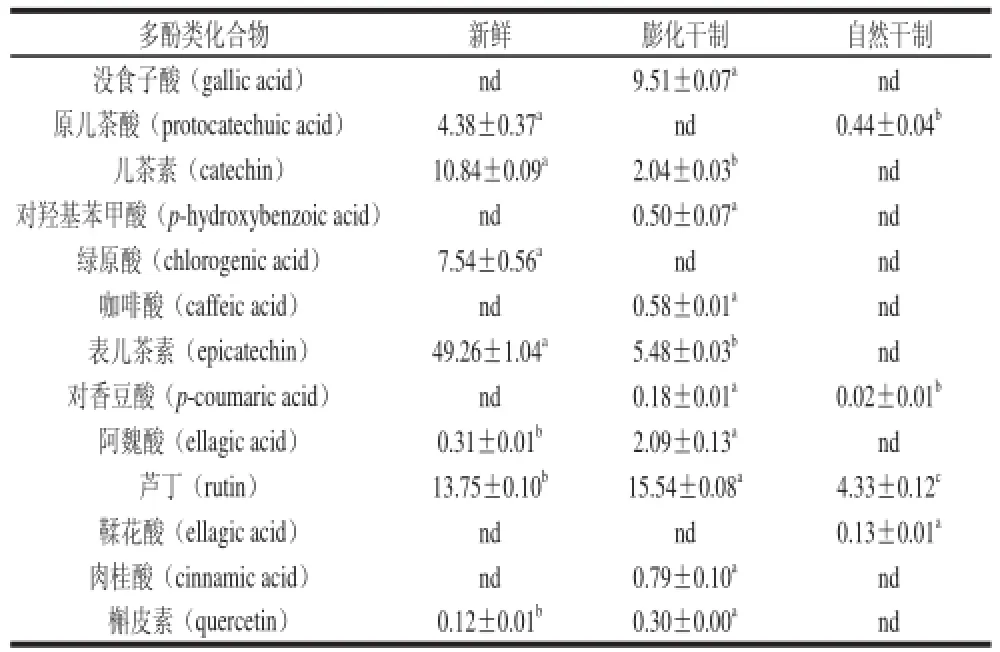
表1 不同干制方式下红枣中多酚化合物组成及含量(x ±s,n=3)Table 1 Contents of phenolic compounds in fresh fruits and dried fruits obtained from two drying methods (x ±s,n=3) øg/g DW
鲜枣和干制枣中已检测到9 种酚酸,包括羟基苯甲酸(没食子酸、原儿茶酸、对羟基苯甲酸),羟基肉桂酸(咖啡酸、对香豆酸、肉桂酸和阿魏酸),鞣花酸和绿原酸。阿魏酸在鲜枣中含量相对较低,经膨化处理后其含量显著增加(P<0.05),与鲜枣相比,它的含量提高了574%,而在晒干中未检测到。晒干处理显著降低枣果中原儿茶酸的含量且损失了90%。对香豆酸仅在干制枣中检测到,其在膨化枣中的含量是晒干枣的9 倍。没食子酸、对羟基苯甲酸、咖啡酸和肉桂酸仅在膨化枣中检测到,含量在0.50~9.51 μg/g DW之间。
2.4 相关性分析

表2 总酚、总黄酮含量与抗氧化能力之间的线性相关性Table 2 Linear correlations between antioxidant properties and either total phenolics or flavonoid contents
由表2可知,样品总酚、总黄酮含量均与抗氧化活性呈现显著性相关,总酚与DPPH自由基的清除能力、还原力高度相关,相关系数均为0.99,总黄酮与其相关系数分别为0.96和0.98。总黄酮与ABTS+•的清除能力、β-胡萝卜素-亚油酸体系抗氧化能力显著相关,相关系数可达0.99。说明样品中总黄酮与总酚是枣果抗氧化能力的主要成分。
3 结论与讨论
酚类物质是枣中重要的功效成分,是天然的抗氧化物质。与自然界中公认的富含多酚水果例如苹果(74.0 mg GAE/100 g FW)、红葡萄(80.3 mg GAE/100 g FW)、柿子(112.1 mg GAE/100 g FW)、樱桃(114.6 mg GAE/100 g FW)、番石榴(194.1 mg GAE/100 g FW)、番荔枝 (405.4 mg GAE/100 g FW)相比较,红枣含有更高的多酚含量(275.6~541.8 mg GAE/100 g FW)[11,15]。多酚具有抗氧化、抗肿瘤、抗动脉粥样硬化以及防止冠心病等多种生理功能,主要与其清除自由基能力有关,可通过单电子转移和对金属离子的络合方式清除自由基,还能够结合过氧自由基阻止氧化过程中连锁反应的传播[16-17]。本实验研究得出红枣经膨化干制后,总酚含量显著增加而总黄酮含量略微增加,而晒干枣含有最低的总酚、总黄酮含量。膨化处理被认为是一种有效提取抗氧化物质的前处理方式[18]。这是因为枣在膨化过程中压力突然下降导致水分蒸发,形成多孔结构,有利于提取溶剂的渗透从而导致多酚物质提取率升高。An等[19]报道膨化红参的提取率(41.1~48.2 g/100 g)高于非膨化红参(29.7~45.7 g/100 g)。此外,膨化过程中的高温使鲜枣中多酚氧化酶失活从而避免酚类物质在干制过程中的降解。在自然干制过程中,鲜枣中一些降解酶如多酚氧化酶未立即灭活,因此会在枣完全晒干之前降解多酚化合物,而且自然干制的气候因素会导致多酚物质不均一降解[20]。
抗氧化活性研究表明,膨化枣具有最强的清除DPPH自由基、ABTS+•的能力、总还原力和抑制β-胡萝卜素-亚油酸褪色能力,且与鲜枣和自然干制枣之间存在明显差异。这与膨化枣含有较高的总酚和总黄酮有关,相关性研究也表明总酚和总黄酮与4种抗氧化能力呈现显著相关。膨化枣有最高的抗氧化能力与非酶褐变有关如美拉德反应,此反应产物有很强的抗氧化能力[21]。此外,没食子酸、对羟基苯甲酸、咖啡酸和肉桂酸强抗氧化物质仅在膨化枣中检测到,其高的抗氧化能力可能与这些酚类化合物有关。然而,晒干枣中总酚和总黄酮含量最少,这就相应的导致抗氧化能力相对弱。研究表明一些慢性疾病,像脑功能障碍、癌症、心脏病和免疫力下降均与由代谢产生的自由基导致细胞损伤有关,抗氧化剂能够在自由基攻击细胞和生物靶目标之前稳固和灭活自由基[22]。因此在这些疾病预防方面有重要功效[23]。鲜枣中活性物质有众多生理功效,而膨化枣食用更加方便,且保持较高的抗氧化活性。
用液相检测到鲜枣中富含表儿茶素、儿茶素和芦丁,三者含量占多酚化合物含量的12%~59%。其中表儿茶素和儿茶素之和占到71%,这与于金刚等[9]报道的结果一致。膨化处理使枣中儿茶素和表儿茶素损失率高达81%和89%。但在晒干枣中却未检测到。儿茶素和表儿茶素属于黄烷3-醇类物质,普通加工处理如发酵、烘烤和焙烤都会导致其含量的降低[24]。膨化干燥使槲皮素含量显著增加,其原因可能是热处理能够使槲皮素糖苷降解从而导致槲皮素含量的升高。槲皮素对人体有一定的保健功能性,研究表明槲皮素具有抗突变、抗增殖、抗炎和心血管保护等生理功能[25]。芦丁对由毛细血管退化引起的高血压及出血性疾病有着辅助治疗作用,并且可以降低患动脉粥样硬化的风险[26],膨化枣中芦丁含量可高达14.55 μg/g DW,显著高于晒干枣和鲜枣。酚酸具有很重要的保健功能,其结果表明膨化枣含有种类丰富的酚酸,其可能与膨化处理有助于结合态酚酸的释放有关,因枣中大多数酚酸以糖苷键合态和甲醇不溶性的形式存在[27]。适当的热处理促进结合态酚酸释放,从而提高酚类化合物的利用率。
总而言之,红枣经膨化后总酚含量显著升高,总黄酮含量保持稳定,抗氧化能力增强,多酚的组成及含量发生明显变化,与鲜枣和自然干制枣相比,膨化枣含有丰富的酚类化合物。且食用方便,口感酥脆香甜,低温真空膨化技术是优良的干制枣技术而且可规模化生产加工枣。
[1] 鲁周民, 刘坤, 闫忠心, 等. 枣果实营养成分及保健作用研究进展[J].园艺学报, 2010, 37(12): 2017-2024.
[2] 樊保国. 枣果的功能因子与保健食品的研究进展[J]. 食品科学, 2005, 26(9): 587-591.
[3] 王毕妮. 红枣多酚的种类及抗氧化活性研究[D]. 杨凌: 西北农林科技大学, 2011.
[4] SLATNAR A, KLANCAR U, STAMPAR, et al. Effect of drying of figs (Ficus carica L.) on the contents of sugars, organic acids, and phenolic compounds[J]. Journal of Agricultural and Food Chemistry, 2011, 59(21): 11696-11702.
[5] GAO Qinghan, WU Chunsen, WANG Min, et al. Effect of Drying of Jujubes (Ziziphus jujuba Mill.) on the contents of sugars, organic acids, α-tocopherol, β-carotene, and phenolic compounds[J]. Journal of Agricultural and Food Chemistry, 2012, 60(38): 9642-9648.
[6] 毕金峰, 魏益民. 果蔬变温压差膨化干燥技术研究进展[J]. 农业工程学报, 2008, 24(6): 308-312.
[7] 毕金峰. 果蔬低温高压膨化干燥关键技术研究[D]. 北京: 中国农业科学院, 2005.
[8] GUO Xudan, WU Chunsen, MA Yujie, et al. Comparison of milling fractions of tartary buckwheat for their phenolics and antioxidant properties[J]. Food Research International, 2012, 49(1): 53-59.
[9] 于金刚, 王敏, 李援农, 等. 不同滴灌制度对梨枣抗氧化活性的影响[J].食品科学, 2011, 32(1): 39-44.
[10] WU Chunsen, GAO Qinghan, GUO Xudan, et al. Effect of ripening stage on physicochemical properties and antioxidant profiles of a promising table fruit “pear-jujube” (Zizyphus jujuba Mill.) [J]. Scientia Horticulturae, 2012, 148: 177-184.
[11] GAO Qinghan, WU Pute, LIU Jiaren, et al. Physico-chemical properties and antioxidant capacity of different jujube (Ziziphus jujuba Mill.) cultivars grown in loess plateau of China[J]. Scientia Horticulturae, 2011, 130(1): 67-72.
[12] 徐元元, 国旭丹, 贺丽霞, 等. 常见6种杂粮与2种主粮的抗氧化活性比较研究[J]. 食品科学, 2012, 33(7): 20-25.
[13] SHAHIDI F, DESILVA C, AMAROWICZ R. Antioxidant activity of extracts of defatted seeds of niger (Guizot ia abyssinica) [J]. Journal of the American Oil Chemists’ Society, 2003, 80(5): 443-450.
[14] ALVAREZ JUBETE L, WIJINGAARD H, ARENDT E K, et al. Polyphenol composition and in vitro antioxidant activity of amaranth, quinoa buckwheat and wheat as affected by sprouting and baking[J]. Food Chemistry, 2010, 119(2): 770-778.
[15] FU Li, XU Botao, XU Xiangrong, et al. Antioxidant capacities and total phenolic contents of 62 fruits[J]. Food Chemistry, 2011, 129(2): 345-350.
[16] LI Jinwei, DING Shaodong, DING Xiaolin. Comparison of antioxidant capacities of extracts fro m fi ve cultivars of Chinese jujube[J]. Process Biochemistry, 2005, 40(11): 3607-3613.
[17] ROBB INS R J. Phenolic acids in foods: an overview of analytical methodology[J]. Jo urnal of Agricultural and Food Chemistry, 2003, 51(10): 2866-2887.
[18] KUROSUMI A, SASAKI C, KUMADA K, et al. Novel extraction method of antioxidant compounds from Sasa palmata (Bean) Nakai using steam explosion[J]. Process Biochemistry, 2007, 42(10): 1449-1453.
[19] AN Y E, AHN S C, YANG D C, et al. Chemical conversion of ginsenosides in puffed red ginseng[J]. LWT - Food Science and Technology, 2011, 44(2): 370-374.
[20] LIM Y Y, MURTIJAYA J. Antioxidant properties of Phyllanthus amarus extracts as affected by different drying met hods[J]. LWT -Food Science and Technology, 2007, 40(9): 1664-1669.
[21] MANZOCCO L, CALLIGARIS S, MASTROCOLA D, et al. Review of non-enzymatic browning and antioxidant capacity in processed foods[J]. Trends in Food Science & Technolo gy, 2000, 11(9): 340-346.
[22] ATOUI A K, MANSOURI A, BOSKOU G, et al. Tea and herbal infusions: their antiox idant activity and phenolic profile[J]. Food Chemistry, 2005, 89(1): 27-36.
[23] LU Yinrong, YEAP FOO L. Antioxidant activities of polyphenols from sage (Salvia offi cinalis)[J]. Food Chemistry, 20 01, 75(2): 197-202.
[24] PAYNE M J, HURST W J, MILLER K, et al. Impact of fermentation, drying, roasting, and Dutch processing on epicatechin and catechin content of cacao beans and cocoa ingredients[J]. Journal of Agricultural and Food Chemistry, 2010, 58(19): 10518-10527.
[25] LIM C G, KOFFAS A G, MATTNEO S. Bioavailability and recent advances in the bioactivity of flavonoid an d stilbene compounds[J]. Current Organic Chemistry, 2010, 16(14): 1727-1751.
[26] FABJAN N, RODE J, KOSIR I J, et al. Tartary buckwheat (Fagopyrum tataricum Gaertn.) as a source of di etary rutin and quercitrin[J]. Journal of Agricultural and Food Chemistry, 2003, 22(21): 6452-6455.
[27] WANG Binni, LIU Haifeng, ZHENG Jianbin, et al. Di stribution of phenolic acids in different tissues of jujube and their antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2011, 59(4): 1288-1292.
Effect of Explosion Puffing and Sun-Drying on Antioxidants in Chinese Jujubes
DU Li-juan, JI Xiao-long, XU Fang-yi, YANG Shi-long, WANG Min*
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Objective: To investigate the effects of explosion puffing and sun-drying on the composition of phenolic compounds and their antioxidant activity in Chinese jujubes. Methods: The total phenolics and flavonoids contents were measured by Folin-Ciocalteu and NaNO2-Al(NO3)3assays. Antioxidant properties were evaluated by DPPH and ABTS free radical scavenging, reducing power and β-carotene-linoleic acid emulsion assays. Phenolic compounds were qualitatively and quantitatively analyzed by high-performance liquid chromatography (HPLC). Results: The contents of total phenolics were significantly increased by explosion puffing, while no obvious change in the content of total flavonoids was observed in puffed jujubes. In contrast, these components revealed a marked decrease in sun-dried jujubes. The DPPH free radical scavenging capacity and reducing power of puffed jujubes were significantly superior to those of the fresh and sun-dried counterparts. The ABTS free radical scavenging and antioxidant activity coefficient (AAC) as determined using β-carotenelinoleic acid of sun-dried jujubes were significantly lower than those of the fresh and puffed ones, and no significant difference between fresh and puffed jujubes was observed. The total phenolics, flavonoids contents and antioxidant activity of puffed jujubes were markedly higher that those of sun-dried samples. The composition of phenolic compounds in Chinese jujubes were obviously changed after drying treatments. The contents of gallic acid, p-hydroxybenzoic acid, caffeic acid, p-coumaric acid, ferulic acid, rutin, cinnamic acid and quercetin revealed the highest levels in puffed jujubes. The antioxidant activity of the jujube was significantly correlated with the contents of total phenolics and flavonoids. Conclusion: Puffed jujubes contain the most abundant phenolic compounds and possess the highest a ntioxidant activity. The processingtime is short. Moreover, the products are fragrant, sweet and crisp. Therefore, explosion puffing as a feasible and innovative technology can be developed as a drying method for Chinese jujubes.
jujubes; explosion puffing; high-performance liquid chromatography; antioxidant activity; phenolics
TS255
A
1002-6630(2014)13-0081-06
10.7506/spkx1002-6630-201413015
2013-08-01
“十一五”国家科技支撑计划项目(2007BAD88B05)
杜丽娟(1989—),女,硕士研究生,研究方向为食品科学。E-mail:bibojuanjuan@163.com
*通信作者:王敏(1967—),女,教授,博士,研究方向为食品营养与安全及西部药食兼用植物资源开发利用。
E-mail:wangmin20050606@163.com
