新鲜与干制柑橘皮果胶物化特性比较分析
2014-01-18王小银殷军艺谢明勇
王小银,李 精,殷军艺,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
新鲜与干制柑橘皮果胶物化特性比较分析
王小银,李 精,殷军艺,谢明勇*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
以柑橘皮为原料,分析、比较新鲜柑橘皮果胶(fresh citrus pectin,FCP)与干制柑橘皮果胶(dried citrus pectin,DCP)的物化特性差异。采用传统酸法结合金属螯合剂(六偏磷酸钠)分别从新鲜、干制柑橘皮中提取得到果胶FCP、DCP,测定FCP和DCP的物化特性参数,包括水分、灰分、酸不溶灰分和蛋白含量等基本理化指标,以及半乳糖醛酸含量、酯化度、胶凝度、分子质量和表观黏度等果胶品质评价指标。结果表明:FCP与DCP的基本理化性质相差不大,FCP半乳糖醛酸含量、酯化度、胶凝度和分子质量分别为77.29%、67.5%、179.8和158.8 kD,而DCP对应的 值依次为74.98%、66.7%、153和109.1 kD,FCP表观黏度值高于DCP。新鲜和干制柑橘皮果胶品质存在一定差异,特别是作为果胶品质重要参考指标的胶凝度,FCP要高于DCP,而这可能与FCP的分子质量较高有关,但两者的半乳糖醛酸含量和酯化度均符合果胶品质的国家标准GB25533—2010《食品安全国家标准 食品添加剂》要求。
新鲜柑橘皮;干制柑橘皮;果胶;物化特性
果胶是一类广泛存在于植物细胞壁内初生壁和细胞中层的杂多糖[1],是高等植物细胞壁的重要组成部分,分为水溶性和水不溶性两种。在植物细胞壁中,果胶主要与纤维素、半纤维素、木质素等共价结合形成原果胶,是植物的一种结构物质,对维持植物的结构和硬度起着至关重要的作用,除此之外,果胶还能够调节细胞的渗透性及pH值。果胶在植物细胞壁中含量最高,约占35%[2]。目前,用于生产商品果胶的原料主要是柑橘和苹果皮渣。此外,也有大量研究从豆腐柴叶、香蕉皮、向日葵、甘薯及薜荔子等副产物中提取果胶,不过这些原料的研究目前还仅限于实验室的基础研究。
中国是柑橘种植大国,可是对于柑橘皮渣的综合利用远低于其他国家,尚处于起步阶段。全国每年要产生柑橘皮渣在500万 t以上,除极少量用于加工橘皮酱、柑橘皮饮料等产品外,基本上没得到充分利用,从而造成严重的资源浪费[3-4]。目前,人们对柑橘皮的综合开发利用关注越来越多,如何变废为宝,将废弃的柑橘皮资源得到充分的价值挖掘成为亟待解决的难题。柑橘皮占柑橘果重的25%~40%,柑橘皮中含有许多的功能成分,其中果胶是主要的化学成分之一,约占20%[5]。目前,柑橘皮是商品果胶生产的主要原料之一,从柑橘皮中得到的果胶具有良好的乳化、增稠、稳定和胶凝作用,常用于食品、纺织、医药、化妆品等领域[6-7]。
柑橘皮中的化学成分含量和其理化性质会随着贮藏时间的延长和贮藏条件的不同而发生变化。温明霞等[8]以温州蜜柑橘为材料研究发现,随着贮藏时间的延长,柑橘皮的失重率严重降低。胡笑安等[9]对石门蜜柑、湘西椪柑和江永香柚分别在干皮常温、鲜皮-18 ℃和-40 ℃贮藏进行总果胶含量和酯化度的测定,发现总果胶含量和酯化度都发生了显著变化。与此同时,胡笑安等[10]研究发现尾张温州蜜橘在贮藏过程中,总果胶含量在上述3个贮藏条件下的变化都呈下降趋势,水溶性果胶含量都呈上升趋势,酯化度总体是下降的。王鸿飞[11]和Sharma[12]等的研究表明不同贮藏条件下柑橘皮果胶的含量和品质都会发生变化。上述研究结果表明,柑橘皮的化学成分在不同的贮藏条件和贮藏过程中发生变化,柑橘皮中得到的果胶的物理性质和品质也相应发生差异性变化。故本实验以新鲜柑橘皮和干制保存7 d后的柑橘皮为原料,采用盐酸结合六偏磷酸钠的方法分别提取得到新鲜柑橘皮果胶(fresh citrus pectin,FCP)和干制柑橘皮果胶(dried citrus pectin,DCP),测定了两种果胶的基本理化性质,并比较了两者在果胶品质上的差异性,旨在为工业果胶提取的原料选择提供理论参考。
1 材料与方法
1.1 材料与试剂
柑橘皮:南昌市售柑橘,剥皮得新鲜柑橘皮,将其中一部分新鲜柑橘皮置于40 ℃烘箱烘干并贮藏7 d,得干制柑橘皮。
盐酸、氢氧化钠、无水乙醇、蔗糖、磷酸、六偏磷酸钠、咔唑、三氟乙酸、硝酸钠、硫酸钾、硫酸铜、硼酸等均为国产 分析纯。
1.2 仪器与设备
ARES-G2流变仪(配有40 mm平板夹具) 美国TA公司;Agilent 1200系列液相色谱仪 美国Agilent Technologies公司;CT3质构分析仪 美国Brookfield公司;KjeltecTM8400型凯式定氮仪 丹麦FOSS公司;TU-1900双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;FE 20 pH计、AL 104 型电子天平 上海梅特勒-托利多仪器公司;Milli-Q超纯水仪 美国Millipore公司。
1.3 方法
1.3.1 原料处理
称取新鲜柑橘皮600 g,干制柑橘皮200 g,切成小块,粉碎、混匀。将柑橘皮粉加入沸水中加热5~8 min,使果胶酶失活,防止果胶降解[13];置于流水中漂洗,进一步除去色素、苦味和糖分等,漂洗至沥液近无色为止,最后挤干。
1.3.2 果胶提取
把已处理好的柑橘皮放入水中,料液质量比为1∶20,加入0.3%的六偏磷酸钠,用0.3 mol/L HCl调整pH值为2,于95 ℃恒温搅拌提取1 h,重复提取2 次。用纱布趁热过滤,合并两次提取得到提取液,55 ℃条件下真空旋转蒸发浓缩至原来体积的1/5。用NaOH调pH值至3,加入浓缩后滤液体积2 倍的95%乙醇沉淀1 h,4 800 r/min离心10 min,用70%与90%的酸性乙醇各洗1 次。所得果胶于55 ℃真空干燥24 h至恒质量,称质量,得到新鲜柑橘皮果胶(FCP)和干制柑橘皮果胶(DCP)。
1.3.3 果胶物化特性分析
1.3.3.1 成分分析
水分含量参照GB 5009.3—2010《食品安全国家标准食品中水分的测定》中的直接干燥法进行测定;灰分总量参照GB 5009.4—2010《食品安全国家标准 食品中灰分的测定》中所述方法进行测定;酸不溶灰分含量参照GB 25533—2010《食品安全国家标准 食品添加剂》中所述方法;蛋白质含量参照GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》自动凯式定氮仪法进行测定。
1.3.3.2 半乳糖醛酸含量
采用硫酸咔唑法[14]分别测定两种柑橘皮果胶溶液中半乳糖醛酸含量。以测得的半乳糖醛酸吸光度为纵坐标、半乳糖醛酸质量浓度为横坐标制作标准曲线,取两次测定的样品的平均数计算出相应的果胶含量。
1.3.3.3 酯化度测定
采用皂化法测定果胶酯化度[15-16]。取0.2 g果胶置于250 mL锥形瓶中,加入100 mL 蒸馏水使果胶完全溶解,再向该溶液中加入3 滴酚酞,并用0.1 mol/L NaOH滴定,至滴定终点所用NaOH体积记为V1。随后向该溶液中加入20 mL 0.5 mol/L NaOH,室温下搅拌反应2 h。继续向该溶液加入20 mL 0.5 mol/L HCl,过量HCl用0.1 mol/L NaOH滴定,至滴定终点所消耗 NaOH 体积记为V2。果胶酯化度计算见公式(1)。
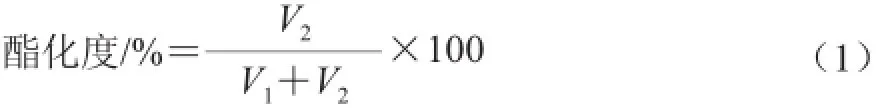
1.3.3.4 胶凝度测定
采用Bender氏破碎压力法[17]测定果胶的胶凝度。具体方法如下:称取0.3 g果胶置于250 mL烧杯中,加入蒸馏水31 mL,待果胶完全溶解后加入白砂糖35.7 g使之溶化并加热浓缩至54.7 g。在60 mm×30 mm 的称量瓶中加入0.8 mL 12.5%柠檬酸水溶液,然后将果胶糖液全部倒入称量瓶中,用玻棒迅速搅拌均匀后罩上一支稍大烧杯,并在(25±3) ℃条件下静置保温24 h,小心将果冻从杯中取出,调向装入杯中。CT3质构分析仪测定果冻的TPA质构分析,探头:TA/10;测试速率:0.5 mm/s;返回速率:0.5 mm/s。

式中:G为果胶胶凝度等级;m1为制作果冻时所用的蔗糖质量/g;m2为制作果冻时所用的果胶质量/g;Y为果冻强度/(g/cm2);0.979和40.5为回归系数。
1.3.3.5 分子质量的测定
果胶分子质量的确定采用高效液相排阻色谱法[18]:配有Agilent 1200系列液相系统和2 个检测器(660 nm的BI-MwA多角度激光散射器和示差检测器),色谱柱为PL aquagel-OH MIX(300 mm×7.5 mm,8 μm);用含有0.1 mol/L硝酸钠和0.02%叠氮钠的作为洗脱液,流速0.8 mL/min。用洗脱液配制1 mg/mL样品溶液,进样前先用0.45 μm滤膜过滤除杂。用葡聚糖标准品(Mw=48 600 kD、分子质量分布系数为1.36、折光指数为0.148 mL/g)进行系统校正,折光指数为0.146 mL/g,分别测定样品的分子质量。
1.3.3.6 表观黏度分析
分别配制1% FCP与1% DCP溶液,采用ARES G2流变仪测定样品溶液的表观黏度随剪切速率的变化。测试条件:40 mm平行板夹具(不锈钢材质);稳态速率扫描;温度:20 ℃;剪切速率范围:0.1~1 000 s-1;Gap值为0.5 mm。
2 结果与分析
2.1 水分、灰分、酸不溶灰分和蛋白质含量
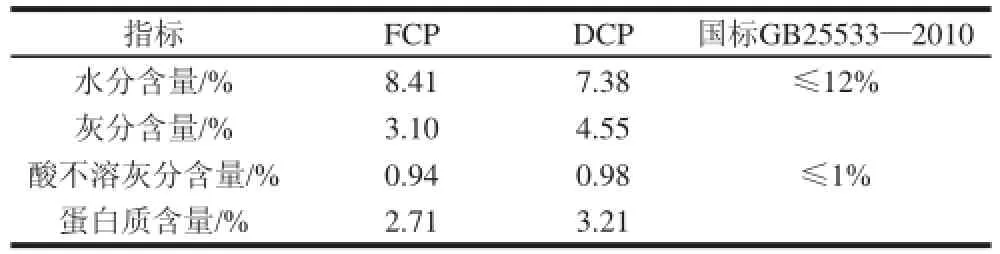
表1 FCP与DCP基本理化性质Table 1 Physico-chemical properties of FCP and DCP
由表1可知,DCP的灰分、酸不溶灰分和蛋白质含量均比FCP高,DCP的水分含量低于FCP,但总体而言,FCP和DCP两种果胶的这4 个理化指标相差不大。FCP和DCP两种果胶的水分含量分别为8.41%和7.38%,酸不溶灰分分别为0.94%和0.98%,得到的两种果胶均符合GB25533—2010标准的技术要求。
2.2 果胶品质分析
2.2.1 半乳糖醛酸含量
果胶的主要成分是部分甲酯化的α-(1,4)-D-聚半乳糖醛酸,在硫酸的作用下会水解成半乳糖醛酸,通过显色反应测定样品中半乳糖醛酸含量。半乳糖醛酸含量在10~90 μg/mL范围内具有良好的线性关系,回归方程为:y=0.005 7x-0.037 2(R2=0.997 7)。实验测得FCP和DCP中半乳糖醛酸含量分别为77.29%和74.98%,FCP的半乳糖醛酸含量高于DCP。两者的半乳糖醛酸含量均大于65%,符合GB25533—2010的技术要求。
2.2.2 酯化度和胶凝度
FCP和DCP的酯化度分别为67.5%和66.7%,通常酯化度高于50%的果胶被称为高甲氧基果胶,低于50%的果胶被称为低甲氧基果胶,所以FCP和DCP均属高甲氧基果胶。同时,FCP和DCP的胶凝度分别为179.8和153.0,这表明新鲜柑橘皮经过烘干后经提取所得果胶的胶凝度低于新鲜柑橘皮直接提取所得果胶的胶凝度。
2.3 分子质量的测定

图1 FCP与DCP的高效液相排阻色谱图Fig.1 HPSEC chromatograms of FCP and DCP
如图1所示,洗脱体积在7~9 mL处各果胶在HPSEC图中都出现单一的对称峰,在洗脱体积10~12 mL处出现一些小分子的杂峰,表明用此法提取得到的果胶的分子质量分布较为集中,少部分果胶主链或支链可能发生了一定程度的水解。同时,对比FCP与DCP 的图谱发现,DCP在洗脱体积为10 mL处出现一较大的区域,这可能是因为干制柑橘皮在保存的过程中发生了部分降解。通过计算得到FCP与DCP的主要组分平均分子质量分别为158.8 kD和109.1 kD。
2.4 表观黏度
如图2所示,FCP和DCP两种果胶溶液的表观黏度都随着剪切速率的增加而下降,表现出剪切变稀的现象。在任一特定的剪切速率条件下,FCP的表观黏度都要比DCP要大,如在剪切速率为10 s-1时,FCP和DCP溶液的表观黏度分别为0.16 Pa·s和0.08 Pa·s,这可能是因为FCP的分子质量比DCP的更大。

图2 FCP和DCP溶液的表观黏度-剪切速率曲线Fig.2 Apparent viscosity-shear rate curves of FCP and DCP solutions
3 结论与讨论
本实验中DCP与FCP相比较,水分、灰分、酸不溶灰分和蛋白质含量均未发生明显的变化,其中水分和酸不溶灰分含量均符合GB25533—2010标准技术要求。两种果胶的基本理化性质相差不大,表明经干燥处理后提取得到的柑橘皮果胶DCP结构未发生显著变化。
FCP和DCP的半乳糖醛酸含量分别为77.29%和74.98%,均比梅新等[19]所提取的半乳糖(73.28%)含量更高,说明两种果胶的纯度更高。两种柑橘果胶的半乳糖醛酸含量均大于65%,达到了GB25533—2010标准要求,提取的果胶质量较好,这表明柑橘皮是生产果胶的有效资源,能够满足于果胶的商业化生产。张雪等[20]描述指出柑橘皮果胶酯化度为70%~80%。但笔者的结果与此并不相同,新鲜柑橘皮果胶和干制柑橘皮果胶的酯化度分别为67.5%和66.7%。虽然两种果胶的酯化度值不属于70%~80%的范畴,但均符合GB25533—2010标准要求。果胶的酯化度和相对分子质量影响果胶凝胶特性,酯化度决定着果胶形成凝胶的速度,分子质量决定着果胶的凝胶强度[21]。FCP与DCP胶凝度分别为179.8和153.0,分子质量分别为158.8 kD和109.1 kD。DCP分子质量比FCP小,而FCP与DCP的酯化度无差异变化,这表明DCP胶凝度小于FCP是由于果胶分子质量降低的结果,干制柑橘皮果胶的主链和一些支链可能发生了降解。果胶的流变学特性也受分子质量的影响,其中黏度是分子质量的一种量度,分子质量越大,黏度就会越高[22]。流变测试表明,1% FCP与1% DCP为假塑性流体,在相同剪切速率下,FCP表观黏度比DCP大,这与FCP分子质量更高的结果相一致。此外,FCP和DCP两种果胶溶液的表观黏度都随着剪切速率的增加而下降,表现出剪切变稀的现象。
以上实验结果表明,FCP与DCP的两种果胶基本理化性质相差不大,FCP和DCP品质都符合GB25533—2010要求。但FCP胶凝度和表观黏度大于DCP,表明FCP果胶品质要优于DCP。但是考虑到产品稳定性、运输成本、贮藏以及季节变化的影响,鲜柑橘皮不适用于商业果胶的长期工业生产,所以往往以干制灭酶的柑橘皮进行大批量的果胶生产为主。
[1] NOVOSEĽSKAYA I L, VOROPAEVA N L, SEMENOVA L N, et al. Trends in the science and applications of pectins[J]. Chemistry of Natural Compounds, 2000, 36(1): 1-10.
[2] VORAGEN A G J, COENEN G J, VERHOEF R P, et al. Pectin, a versatile polysaccharide present in plant cell walls[J]. Structural Chemistry, 2009, 20(2): 263-275.
[3] 蔡文, 谭兴和, 张喻, 等. 柑橘皮果胶提取与分离方法的研究进展[J].食品与机械, 2011, 27(2): 161-164.
[4] 单杨. 中国柑橘工业的现状, 发展趋势与对策[J]. 中国食品学报, 2008, 8(1): 1-8.
[5] 单杨. 中国果品加工产业现状及发展趋势[J]. 北京工商大学学报:自然科学版, 2012, 30(3): 1-12.
[6] 温志英, 刘焕云. 柑橘加工废料综合利用现状及发展前景明[J]. 食品研究与开发, 2008, 29(11): 162-166.
[7] 陈仕俏, 赵文红, 白卫东. 我国柑橘的发展现状与展望[J]. 农产品加工, 2008, 3(3): 21-22.
[8] 温明霞, 石学根, 王鹏, 等. 不同大小温州蜜柑果实贮藏期枯水的生理特征研究[J]. 浙江农业学报, 2013, 25(1): 59-63.
[9] 胡笑安. 不同贮藏条件下柑橘皮中果胶变化的研究[D]. 长沙: 湖南农业大学, 2012.
[10] 胡笑安, 谭兴和, 王锋, 等. 不同贮藏条件下柑桔皮中果胶含量及酯化度的变化[J]. 食品与机械, 2011, 27(6): 212-214.
[11] 王鸿飞, 李和生, 谢果凰, 等. 橘皮中果胶提取技术的试验分析[J].农业机械学报, 2005, 36(3): 82-85.
[12] SHARMA H, BHATIA S, ALAM M S. Studies on pectin extraction from kinnow peel and pomace[J]. Journal of Research, 2013, 50(3/4): 128-130.
[13] 夏天添. 橙皮果胶提取工艺及其理化性质研究[D]. 南昌: 南昌大学, 2012.
[14] 徐汶, 王光辉, 王存文, 等. 咔唑比色法测定豆腐柴叶果胶含量的研究[J]. 食品与机械, 2006, 22(3): 133-135.
[15] 胡笑安, 谭兴和, 张喻, 等. 柑橘果皮果胶含量与性质的测定方法[J].农产品加工: 学刊, 2011(9): 94-97.
[16] PINHEIRO E R, SILVA I M D A, GONZAGA L V, et al. Optimization of extraction of high-ester pectin from passion fruit peel (Pasiflora edulits flavicarpa) with citric acid by using response surface methodology[J]. Bioresource Technology, 2008, 99: 5561-5566.
[17] 张火云. 从柑橘皮中提取果胶工艺条件研究[J]. 食品研究与开发, 2010, 31(9): 59-61.
[18] FISHMAN M L, CHAU H K, KOLPAK F, et al. Solvent effects on the molecular properties of pectins[J]. Journal of Agricultural and Food Chemistry, 2001, 49(9): 4494-4501.
[19] 梅新, 木泰华, 郭庆. 甘薯果胶的乳化特性研究[J]. 中国农业科学, 2010, 43(13): 2759-2766.
[20] 张雪, 王斌. 柑橘皮果胶的提取工艺研究[J]. 现代食品科技, 2006, 22(3): 144-145.
[21] PIRIYAPRASARTH S, SRIAMORNSAK P. Flocculating and suspending properties of commercial citrus pectin and pectin extracted from pomelo (Citrus maxima) peel[J]. Carbohydrate Polymers, 2011, 83(2): 561-568.
[22] METHACANON P, KRONGSIN J, GAMONPILAS C. Pomelo (Citrus maxima) pectin: effects of extraction parameters and its properties[J]. Food Hydrocolloids, 2014, 35: 383-391.
Comparative Analysis of Physico-chemical Properties of Pectin from Fresh and Dried Citrus Peel
WANG Xiao-yin, LI Jing, YIN Jun-yi, XIE Ming-yong*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
In this study, the physico-chemical properties of fresh citrus pectin (FCP) and dried citrus pectin (DCP) were analyzed and compared. FCP and DCP were prepared from fresh and dried citrus peel by traditional acid method with metal chelators (sodium hexametaphosphate). Then, their physico-chemical properties parameters were determined including moisture, ash content, acid insoluble ash content, protein content, and pectin quality evaluation indexes such as galacturonic acid content, esterification degree, gelation degree, relative average molecular weight and apparent viscosity. The results showed that both pectins had no significant difference in physico-chemical properties. Galacturonic acids content, esterification degree, gelation degree and relative average molecular weight of FCP were 77.29%, 67.5%, 179.8 and 158.8 kD, respectively, and those of DCP were 74.98%, 66.7%, 153 and 109.1 kD, respectively. Apparent viscosity of FCP was higher than that of DCP. An obvious difference between both in quality was observed. Especially, FCP had a higher gelation degree as an important indicator of pectin quality than DCP. This was probably due to the higher molecular weight of FCP. However, the esterification degree and galacturonic acid content of both pectins met the requirements of the national standard for pectin quality. Therefore, dried citrus peel is more suitable for commercial pectin production for storage and season reasons.
fresh citrus peel; dried citrus peel; pectin; physico-chemical properties
TS255.3
A
1002-6630(2014)13-0066-04
10.7506/spkx1002-6630-201413012
2014-06-18
“十二五”国家科技支撑计划项目(2012BAD33B06)
王小银(1991—),男,硕士研究生,研究方向为食品科学。E-mail:18870098134@163.com
*通信作者:谢明勇(1957—),男,教授,博士,研究方向为食品化学、食品营养与安全。E-mail:myxie@ncu.edu.cn
