温度和质量浓度对茶多酚水溶液稳定性的影响
2014-01-18马梦君胡文卿傅丽亚罗理勇
马梦君,胡文卿,傅丽亚,罗理勇,2,曾 亮,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学茶叶研究所,重庆 400715)
温度和质量浓度对茶多酚水溶液稳定性的影响
马梦君1,胡文卿1,傅丽亚1,罗理勇1,2,曾 亮1,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学茶叶研究所,重庆 400715)
从色差、透光率、吸光度、pH值、电位和儿茶素含量变化探讨质量浓度和温度对茶多酚水溶液稳定性的影响。结果表明:不同质量浓度和温度贮存的茶多酚溶液稳定性差异都较大,其变化趋势主要表现为灭菌、贮存过程中,茶多酚溶液的亮度、透光率逐渐下降,溶液色泽和吸光度逐渐加深和增大,儿茶素含量和pH值呈现显著下降,且茶多酚质量浓度越高变化趋势越明显;25 ℃贮存时,色差、透光率、吸光度、pH值和儿茶素含量的变化程度均明显高于4 ℃贮存时;茶多酚溶液的电位绝对值随着质量浓度的增加逐渐减小,说明质量浓度低的茶多酚溶液较稳定。从变化趋势可判断出茶多酚质量浓度为400~800 mg/L,4 ℃贮存时,茶多酚稳定性相对较好,更适合保存和开发利用茶多酚。
茶多酚;稳定性;质量浓度;温度
作为世界性三大无醇饮料之一的茶叶,被誉为21世纪的饮料,并以其天然、营养、保健的特点备受世人青睐,成为世人最受欢迎的饮品之一[1-8]。茶多酚(tea polyphenols,TP)是茶叶中的特有成分及最重要的功能因子,约占茶叶干质量的18%~36%[9]。TP按其化学结构可以分为黄烷醇类(儿茶素)、黄酮(黄酮醇)、花青素、酚酸(缩酚酸)4类,其中儿茶素约占TP总量的70%,主要包括表儿茶素(epigallocatechin,EC)、表儿茶素没食子酸酯(epicatechingallate,ECG)、表没食子儿茶素(epigallocatechin,EGC)和表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)。
茶多酚不仅是一种新型的天然抗氧化剂,还具有明显的抗衰老、清除自由基,去脂减肥,降低血糖、血脂和胆固醇,预防心血管疾病,抑制肿瘤细胞等生理功能[10-15],在食品加工、医药、日用化工等领域具有重要的应用。虽然茶多酚具有多种生物活性功能,但是在碱性和中性条件下极不稳定,易氧化聚合形成新物质,从而使得茶多酚氧化,降低其生物活性;或使得富含茶多酚的茶汤浑浊,汤色不亮。茶多酚溶液在灭菌、贮存过程中,会出现汤色变黄,甚至是变红的现象,这对茶饮料或富含茶多酚的产品造成不良的感官影响。本实验研究了不同质量浓度茶多酚在不同温度贮存条件下的变化情况,从色差、透光率、吸光度、pH值、电位和儿茶素含量变化探讨茶多酚溶液的稳定性,以期为保存茶多酚提取物,以及进一步开发利用含茶多酚的产品(饮料、食品、日化品、茶粉等)提供理论基础。
1 材料与方法
1.1 材料与试剂
茶多酚(咖啡碱<0.5%) 长沙华诚生物科技有限公司。
表没食子儿茶素((-)-epigallocatechin,EGC)、儿茶素(catechin,C)、表没食子儿茶素没食子酸酯((-)-epigallocatechingallate,EGCG)、表儿茶素(L-epicatechin,EC)、没食子儿茶素没食子酸酯((-)-gallocatechingallate,GCG)、表儿茶素没食子酸酯((-)-epicatechingallate,ECG)标准品 成都普瑞法科技开发有限公司;甲醇、冰乙酸(色谱纯) 重庆滴水实验仪器有限公司;超纯水 美国Millipore公司。
1.2 仪器与设备
LC-20A高效液相色谱、UV-2450紫外-可见分光光度计 日本岛津公司;PWC124分析天平 上海京工实业有限公司;PHS-3C pH计 上海精科实业有限公司;UltraScan PRO测色仪 美国Hunter Lab公司;TOMY ES-315高压灭菌锅 上海艾高德生物科技有限公司;ZEN3690 Zeta电位分析仪 英国Malvern公司。
1.3 方法
1.3.1 溶液制备
配制4 个质量浓度(400、800、1 200、1 600mg/L)的茶多酚溶液,每个质量浓度罐装3瓶作为原液,测定其吸光度、透光率、色差、儿茶素各单体和电位的变化。其余采用121 ℃、10 min灭菌,封口,冷却,分别放置室温(25 ℃)和低温(4 ℃)贮存观察。在0、5、10、20 、30 d取出进行分析,测定其吸光度、透光率、色差和儿茶素各单体的变化。每个样品做3 组平行。
1.3.2 物理性状测定
吸光度测定:在425 nm条件下,用紫外-可见分光光度计测定吸光度(A425nm)值,蒸馏水做空白[16];透光率测定:在640 nm条件下,用紫外-可见分光光度计测定透光率(T640nm/%),蒸馏水做空白[17];pH值测定:室温下,用已校正过的PHS-3C pH计检测每个样品的pH值;电位测定:室温下,采用ZEN3690 Zeta电位仪检测不同质量浓度茶多酚溶液的电位值;色差测定:室温下,用UltraScan PRO测色仪测定每个样品颜色的L、a、b值。其中L代表明度,a代表红绿色程度,正值表示红色程度,负值表示绿色程度;b代表黄蓝色度,正值表示黄色程度,负值表示蓝色程度[18]。
1.3.3 儿茶素混合标准品的测定
样品用0.45μm微孔滤膜过滤,滤液采用高效液相色谱检测。
色谱柱:Hypersil BDS C18柱(250 mm×4.6 mm,5 μm);流速:0.9 mL/min;检测波长:278 nm;柱温:35 ℃;进样量:10 μL;流动相:A:2%冰乙酸水溶液;B:纯甲醇,TP采用梯度洗脱,梯度见表1。
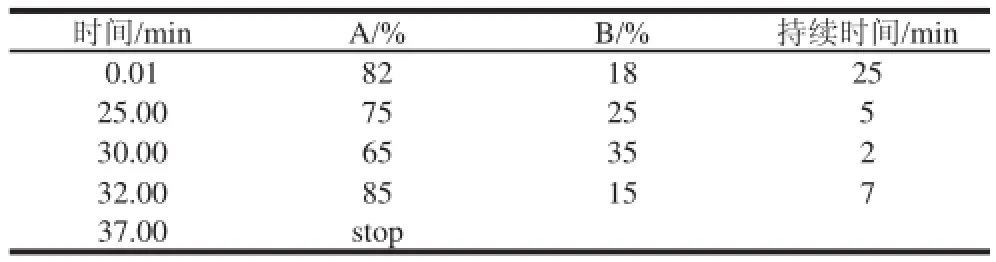
表1 儿茶素各组分检测梯度洗脱表Table1 Linear gradient elution of catechin components
在上述色谱条件下进行检测,得到儿茶素混合标准品的高效液相色谱(high performance liquid chromatography,HPLC)图,见图1。
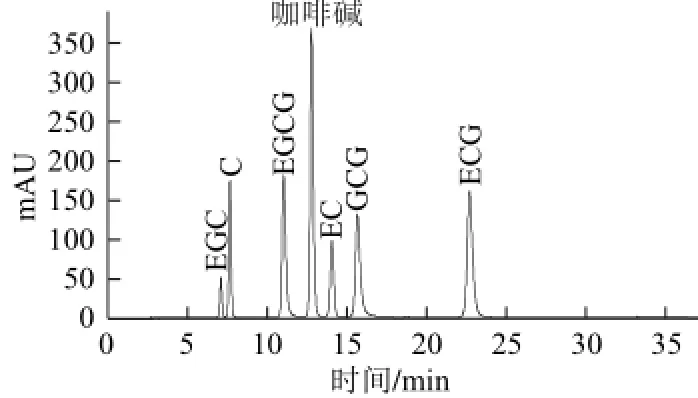
图 1200μgg//mmLL混标色谱图Fig.1 Chromatogram of 200 μg/mL mixed standard
1.4 数据处理
2 结果与分析
2.1 不同质量浓度茶多酚溶液色差变化
由表2可知,不同质量浓度的茶多酚溶液经高温灭菌后,色差a、b值都有显著上升,色差L值显著下降;经高温贮存后,色差b值都有显著上升,色差a值和L值显著下降,而低温贮存变化不明显。不同质量浓度茶多酚溶液的色差变化差异较大。121 ℃灭菌10min后,随着茶多酚质量浓度的升高,色差L、a、b值变化趋势越来越明显,其中质量浓度为1 600 mg/L的茶多酚溶液的色差L、a、b值比灭菌前分别降低6%和升高49%、78%。25 ℃贮存过程中,400 mg/L的茶多酚溶液L值在30d内没有显著变化,a值在前10 d有所下降后趋于稳定,b值在第30天有所上升;800 mg/L的茶多酚随着时间的延长,L值发生了显著的变化,10、20、30d之间的变化均呈现显著差异性,a值、b值在第30天有显著上升;1 200 mg/L的茶多酚溶液L值在前20天内没有变化,30 d后显著上升,a值、b值没有显著变化;1 600 mg/L的茶多酚溶液L值在前5d内显著下降。随着茶多酚质量浓度的升高,色差L、a、b值变化趋势也是越来越明显,这可能是由于茶多酚浓度越高越不稳定,越容易受温度的影响发生氧化。
而4 ℃贮存30 d后,质量浓度为4 00 mg/L和800 mg/L的茶多酚溶液L值均无显著性变化,1 200 mg/L和1 600 mg/L的茶多酚溶液L值略有下降。在贮存过程中,1 200 mg/L的茶多酚溶液色差L值还略有上升,主要是由长期静置,部分悬浮物聚合下沉导致的。

表2 不同质量浓度茶多酚水溶液在不同贮存温度下色差随时间的变化Table2 Changes in color parameters of different concentrations of tea polyphenol solution during storage at different temperatures
2.2 不同质量浓度茶多酚溶液透光率变化
在640 nm波长测定的透光率可以用来描述茶汤的浑浊度[17]。由图2可知,不同质量浓度的茶多酚溶液经高温灭菌后,透光率显著下降;经高低温贮存后,透光率显著下降,高温下降程度更大。不同质量浓度茶多酚溶液的透光率变化差异较大。121 ℃灭菌10 min后,随着茶多酚质量浓度的升高,其中4 个质量浓度的茶多酚溶液的透光率都有显著下降,比灭菌前分别降低0.8%、4.5%、7.0%和10.1%。25 ℃贮存过程中,随着茶多酚质量浓度的升高,透光率降低趋势也是越来越明显,这可能是由于质量浓度越高,儿茶素类物质自动氧化越快,生成醌类物质[9],导致溶液的浑浊度增加,透光率下降。而4 ℃贮存过程中,透光率也有显著下降,但是没有25 ℃降低的明显,质量浓度为800 mg/L的茶多酚溶液在4 ℃贮存5 d后略有上升,可能是由于长期静置,部分悬浮物聚合下沉导致的。
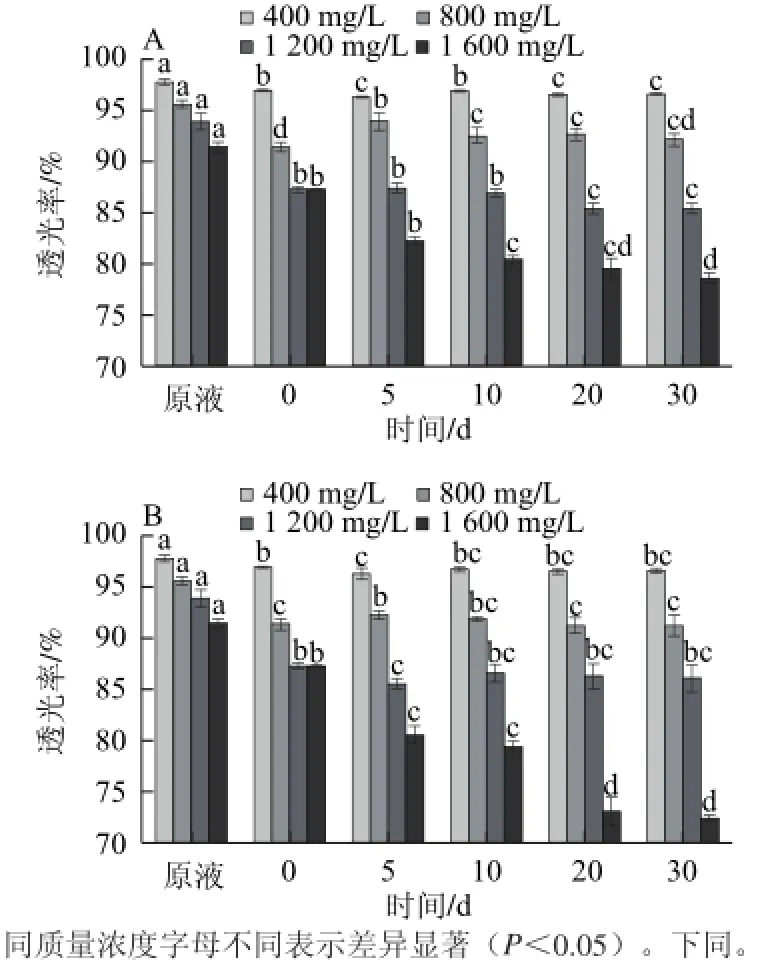
图2 不同质量浓度茶多酚水溶液在4℃(A)和25℃(B)条件下透光率随时间的变化Fig.2 Transmittance changes of different concentrations of tea polyphenol solution during storage at 4 (A) and 25 ℃(B)
2.3 不同质量浓度茶多酚溶液吸光度变化
由于茶多酚的自动氧化产物醌类物质在425 nm波长处有最大吸收峰[16],425 nm条件下吸收峰越大,说明茶多酚的氧化程度越强。由图3可知,不同质量浓度的茶多酚溶液经高温灭菌后,425 nm波长吸光度显著上升;经高低温贮存后,425 nm条件下吸光度显著上升,高温贮存变化更明显。不同质量浓度茶多酚溶液的透光率变化差异较大。121 ℃灭菌10 min后,随着茶多酚质量浓度的升高,425 nm波长吸光度增加幅度增大。25 ℃贮存期间,400 mg/L和800 mg/L的茶多酚溶液425 nm波长吸光度无明显变化,而1 200 mg/L和1 600 mg/L的茶多酚溶液的吸光度显著增加。茶多酚质量浓度越大,上升趋势越明显。4 ℃贮存期间400 mg/L和800 mg/L的茶多酚溶液425 nm波长吸光度无明显变化,而1 200 mg/L和1 600 mg/L的茶多酚溶液的吸光度显著增加,增加幅度比25 ℃贮存小。

图3 不同质量浓度茶多酚水溶液分别在4 ℃(A)和25 ℃(B)条件下吸光度随时间的变化Fig.3 Absorbance changes of different concentrations of tea polyphenol solution during storage at 4 (A) and 25 ℃(B)
2.4 不同质量浓度茶多酚溶液儿茶素各组分和总量的变化

图4 不同质量浓度茶多酚水溶液儿茶素总量分别在4 ℃(A)和25 ℃(B)条件下随时间的变化Fig.4 Changes in total catechin content in different concentrations of tea polyphenol solution during storage at 4 (A) and 25 ℃ (B)
由表3和图4可知,不同质量浓度茶多酚溶液经高温灭菌后,儿茶素组分发生不同程度的变化,C和GCG含量提高,EC含量无明显变化,ECG、EGC、EGCG含量及儿茶素总量下降;经高、低温贮存后,儿茶素各组分含量及儿茶素总量都有明显下降。高温灭菌后,不同质量浓度茶多酚溶液儿茶素组分含量变化趋势相似,变化幅度比较接近。 其中,EGCG含量显著下降,GCG含量显著上升,这主要是由于高温导致EGCG异构化生成GCG。因为表型儿茶素结构中的两个较大基团-B环和-OR’在C环平面的同一侧,分子较不稳定,顺式(表)儿茶素尤其是EGCG易发生异构化作用,转化为反式儿茶素GCG,表明高温导致了其异构化作用。25℃贮存后,不同质量浓度茶多酚溶液的儿茶素各组分含量以及儿茶素总量都有显著下降。茶多酚质量浓度越大,下降趋势越明显。
而4℃贮存后,400mg/L的茶多酚溶液EGCG含量无明显变化,随着茶多酚质量浓度增加,EGCG下降趋势越明显。400mg/L和800mg/L的茶多酚溶液总儿茶素含量无明显变化;1200mg/L和1600mg/L的茶多酚溶液的总儿茶素含量显著下降,分别降低了10.9%、9.2%,而在高温贮存时分别降低了18.3%、12.1%,显然,低温贮存下降幅度没有高温贮存明显。总的来说,随着茶多酚含量的升高,高低温贮存后,儿茶素组分含量下降幅度呈逐渐增大的趋势。这主要是由于在灭菌及贮存过程中,儿茶素特别是酯型儿茶素发生异构化或者氧化分解反应引起的[19]。

表3 不同质量浓度茶多酚水溶液在不同贮存温度下儿茶素组分含量随着时间的变化Table3 Changes in catechin contents in different concentrations of tea polyphenol solution during storage at different temperatures mg/L
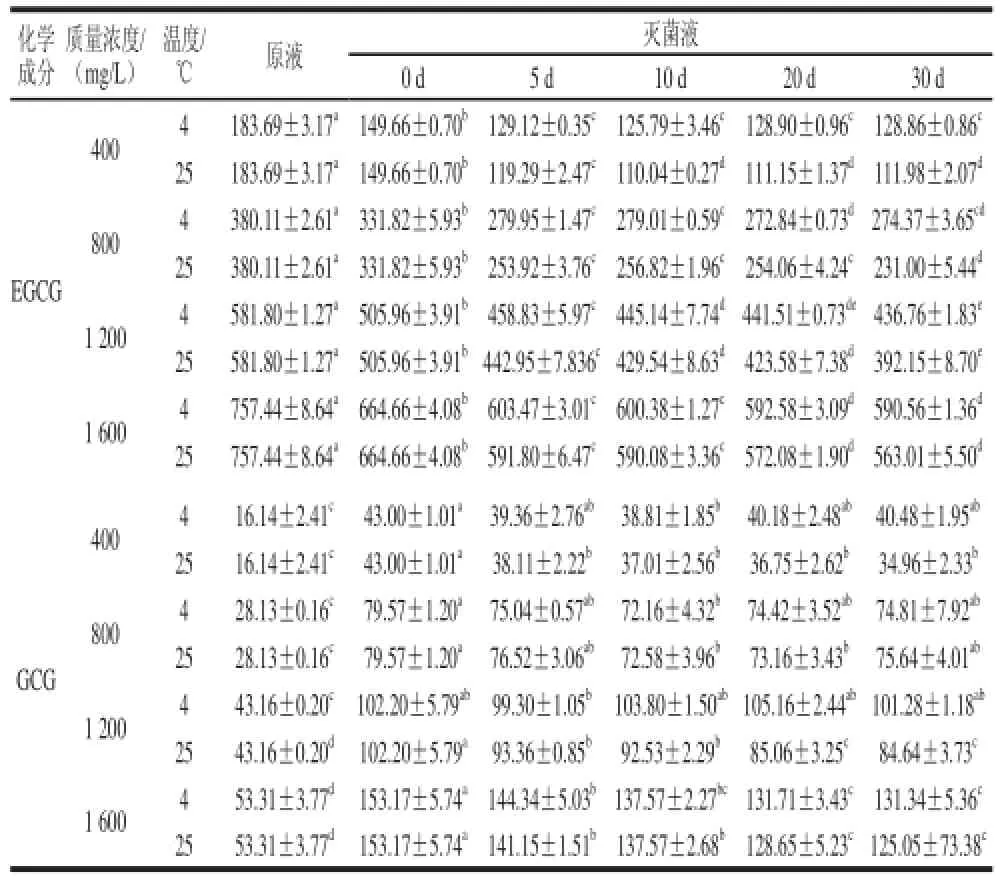
续表3 mg/L
2.5 不同质量浓度茶多酚溶液pH值变化

图5 不同质量浓度茶多酚水溶液pH值分别在分别在4 ℃(A)和25 ℃(B)条件下随时间的变化Fig.5 pH changes of different concentrations of tea polyphenol solution during storage at at 4 (A) and 25 ℃ (B)
由图5可知,不同质量浓度的茶多酚溶液经高温灭菌后,pH值都有显著下降;这是由于在灭菌过程中,儿茶素类发生氧化生成没食子酸[18]。经高低温贮存后,pH值的变化呈现一定的波动。高温灭菌后,不同质量浓度的茶多酚溶液的pH值变化相似。而高低温贮存后,不同质量浓度的茶多酚溶液pH值差异较大。
2.6 不同质量浓度茶多酚溶液电位变化
Zeta电位是对颗粒之间相互排斥或吸引力的强度的度量。分子或分散粒子越小,Zeta电位(正或负)越高,体系越稳定,即溶解或分散可以抵抗聚集。反之,Zeta电位(正或负)越低,越倾向于凝结或凝聚,即吸引力超过了排斥力,分散被破坏而发生凝结或凝聚。不同质量浓度的茶多酚溶液的Zeta电位见图6。不同质量浓度茶多酚溶液电位差异较大。400 mg/L茶多酚溶液电位绝对值最大,溶液最稳定,其次是800 mg/L。1 200、1 600 mg/L溶液电位绝对值相对较小,较不稳定。
3 讨 论
本实验从吸光度、透光率、色差、pH值、电位和儿茶素单体变化研究了温度和浓度对茶多酚溶液稳定性的影响,结果表明茶多酚溶液在灭菌、贮存过程中,透光率显著下降,吸光度显著上升,这主要是由于儿茶素类物质在常温下会发生自动氧化,生成醌类物质[9,19]。茶多酚在灭菌、贮存过程中,pH值、儿茶素总量及酯型儿茶素含量下降,这主要是由于在灭菌及贮存过程中,儿茶素特别是酯型儿茶素发生异构化或者氧化分解反应引起的[20]。茶多酚质量浓度越大,儿茶素发生异构化或氧化分解的现象越明显,这主要是由于茶多酚浓度越大,H2O2的产生量也越高,更容易诱导主要儿茶素降解[21-22]。不同温度贮存茶多酚溶液时,室温贮存(25 ℃)的变化趋势明显大于低温贮存(4 ℃)这主要是由于温度越高,儿茶素的氧化分解越快。以茶多酚水溶液变化为理论基础,本实验室将分别构建茶多酚-咖啡碱、茶多酚-蛋白质、咖啡碱-蛋白质、茶多酚-咖啡碱-蛋白质理论模型,体系化研究绿茶茶乳酪的形成机理;并研究各种物质对茶乳酪形成的影响,提出降低绿茶茶饮料乳酪形成的方法。
[1] WEISBURGER J H. Tea and health: a historical perspective[J]. Cancer Letters, 1997, 114 (1/2): 315-317.
[2] KHAN N, MUKHTAR H. Tea polyphenols for health promotion[J]. Life Sciences, 2007, 81(7): 519-533.
[3] WANG H, PROVAN G J, HELLIWELL K. Tea flavonoids: their functions, utilisation and analysis[J]. Trends in Food Science & Technology, 2000, 11(4/5): 152-160.
[4] WU C D, WEI G X. Tea as a functional food for oral health[J]. Nutrition, 2002, 18(5): 443-444.
[5] HO C T, LEE C Y, HUANG M T, et al. Phenolic compounds in food and their effects on health[M]. American: ACS Publications, 1992: 102-117.
[6] WEISBURGER J H, CHUNG F L. Mechanisms of chronic disease causation by nutritional factors and tobacco products and their prevention by tea polyphenols[J]. Food and Chemical Toxicology, 2002, 40(8): 1145-1154.
[7] BARBOSA D S. Green tea polyphenolic compounds and human health[J]. Journal für Verbraucherschutz und Lebensmittelsicherheit, 2007, 2(4): 407-413.
[8] RIO D D, STEWART A J, MULLEN W, et al. HPLC-MSnanalysis of phenolic compounds and purine alkaloids in green and black tea[J]. Journal of Agricultural and Food Chemistry, 2004, 52(10): 2807-2815.
[9] 宛晓春. 茶叶生物化学[M]. 北京: 中国农业出版社, 2008.
[10] YANG C S, LAMBERT J D, SANG S. Antioxidative and anticarcinogenic activities of tea polyphenols[J]. Archives of Toxicology, 2009, 83(1): 11-21.
[11] LI K, SHI X, YANG X, et al. Antioxidative activities and the chemical constituents of two Chinese teas, Camellia kucha and C. ptilophylla[J]. International Journal of Food Science & Technology, 2012, 47(5): 1063-1071.
[12] MITRA K, SHIN J A, LEE J H, et al. Antioxidative activities of mao feng tea (Camellia spp.) and kamtae (Ecklonia cava) extracts and their effects on structured lipid from corn and perilla oil[J]. Food Science and Biotechnology, 2011, 20(5): 1399-1406.
[13] BHATTACHARYA U, MUKHOPADHYAY S, GIRI A K. Comparative antimutagenic and anticancer activity of three fractions of black tea polyphenols thearubigins[J]. Nutrition and Cancer, 2011, 63(7): 1122-1132.
[14] FUJIMURA Y, UMEDA D, YAMADA K. The impact of the 67 kDa laminin receptor on both cell-surface binding and anti-allergic action of tea catechins[J]. Archives of Biochemistry and Biophysics, 2008, 476(2): 133-138.
[15] 叶小燕, 黄建安, 刘仲华. 茶叶减肥作用及其机理研究进展[J]. 食品科学, 2012, 33(3): 308-312.
[16] SHPIGELMAN A, ISRAELI G, LIVNEY Y D. Thermallyinduced protein-polyphenol co-assemblies: beta lactoglobulinbased nanocomplexes as protective nanovehicles for EGCG[J]. Food Hydrocolloids, 2010, 24(8): 735-743.
[17] 阎守和, 金盾. 茶多酚-生物碱的聚沉与转溶[J]. 茶叶, 1981(2): 27-30.
[18] 许勇泉, 刘平, 陈根生, 等. 茶多酚浓度对绿茶饮料稳定性的影响研究[J]. 茶叶科学, 2011, 31(6): 525-531.
[19] 马宁, 濮少杰, 李锋, 等. 茶多酚脂质体的制备[J]. 食品科学, 2012, 33(20): 16-20.
[20] WANG L F, KIM D M, LEE C Y. Effects of heat processing and storage on flavanols and sensory qualities of green tea beverage[J]. Journal of Agricultural and Food Chemistry, 2000, 48(9): 4227-4232.
[21] AKAGAWA M, SHIGEMITSU T, SUYAMA K. Production of hydrogen peroxide by polyphenols and polyphenols-rich beverages under quasi-physiological conditions[J]. Bioscience, Biotechnology and Biochemistry, 2003, 67(12): 2632-2640.
[22] AOSHIMA H, AYABE S. Prevention of the deterioration of polyphenol-rich beverages[J]. Food Chemistry, 2007, 100(1): 350-355.
Effect of Concentration and Temperature on the Stability of Tea Polyphenols in Aqueous Solution
MA Meng-jun1, HU Wen-qing1, FU Li-ya1, LUO Li-yong1,2, ZENG Liang1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Tea Research Institute, Southwest University, Chongqing 400715, China)
The stability of tea polyphenols in aqueous solution as a function of concentration and temperature was investigated with respect to the changes in color difference, transmittance, absorbance, pH values, zeta potential and catechins contents. The results showed that the stability of tea polyphenols greatly varied with different concentrations and temperatures. During the sterilization and storage, aqueous solution of tea polyphenols exhibited a gradual decrease in lightness and transmittance, a darkened color appearance and consequently an increase in absorbance at 425 nm, and a considerable reduction in catechins contents and pH. These changes were more marked at higher concentrations. Significantly higher changes in color different, transmittance, absorbance, pH and catechins contents were observed when stored at 25 ℃ than at 4 ℃. The zeta potential was negatively related to the concentration of tea polyphenols, suggesting that these compounds were more stable at lower concentrations. Based on the above results, we conclude that tea polyphenols in aqueous solution at concentrations between 400 and 800 mg/L are relatively stable when stored at 4 ℃.
tea polyphenols; stability; concentration; temperature
TS272
A
1002-6630(2014)11-0011-06
10.7506/spkx1002-6630-201411003
2013-12-05
国家自然科学基金青年科学基金项目(31100500);重庆市科委自然科学基金计划资助项目(cstc2013jcyjA80021);中央高校基本科研业务费专项资金项目(XDJK2013B036)
马梦君(1990—),女,硕士研究生,研究方向为茶饮料研究开发。E-mail:164021307@qq.com
*通信作者:曾亮(1980—),女,副教授,博士,研究方向为茶资源综合利用。E-mail:zengliangbaby@126.com
