生姜油树脂对过氧化氢引起RAW264.7巨噬细胞损伤的保护作用
2014-01-17卞梦瑶赵立艳辛志宏安辛欣杨方美胡秋辉
卞梦瑶,方 勇,裴 斐,赵立艳,辛志宏,安辛欣,杨方美,胡秋辉,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.南京财经大学食品科学与工程学院,江苏 南京 210046)
生姜油树脂对过氧化氢引起RAW264.7巨噬细胞损伤的保护作用
卞梦瑶1,方 勇2,裴 斐1,赵立艳1,辛志宏1,安辛欣1,杨方美1,胡秋辉1,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.南京财经大学食品科学与工程学院,江苏 南京 210046)
目的:研究生姜油树脂对过氧化氢引起的RAW264.7巨噬细胞损伤的影响。方法:以生姜油树脂为研究对象,建立RAW264.7细胞的过氧化氢损伤模型,测定质量浓度分别为1、3、5 μg/mL的生姜油树脂联合过氧化氢对RAW264.7细胞和细胞培养液中丙二醛、谷胱甘肽、超氧化物歧化酶以及谷胱甘肽过氧化物酶等抗氧化指标的影响。结果:生姜油树脂各剂量组均能显著缓解过氧化氢引起的RAW264.7细胞的损伤,降低细胞及细胞培养液内的丙二醛含量,提高谷胱甘肽含量以及超氧化物歧化酶和谷胱甘肽过氧化物酶的活性,其中5 μg/mL生姜油树脂对过氧化氢引起的细胞损伤的保护作用效果最好。结论:生姜油树脂对过氧化氢引起的RAW264.7细胞损伤具有保护作用,其作用机制可能是生姜油树脂通过调节细胞氧化还原系统,提高抗氧化能力,有效清除自由基的产生,从而对细胞的氧化性损伤起保护作用。
生姜油树脂;RAW264.7;过氧化氢;抗氧化
研究表明,当机体发生应激时会产生过量的活性氧并导致机体自身抗氧化能力的下降。活性氧的清除不足会产生大量的自由基导致细胞的氧化性损伤。自由基通过线粒体膜、呼吸链等造成线粒体损伤,主要表现在线粒体肿大,内外膜通透性增大,引起氧化磷酸化及三磷酸腺苷(adenosine triphosphate,ATP)生成障碍,影响到细胞的正常生理功能[1]。通常生物体会利用抗氧化防御系统对活性氧进行清除,抗氧化体系包括抗氧化物酶和非酶促系统,其中酶促系统主要包括超氧化物歧化酶(superoxide dismu tase,SOD)、过氧化氢酶等,是细胞内清除活性氧簇(reactive oxygen species,ROS)的主要保护酶;非酶促系统主要包括一些小分子抗氧化物,如还原型谷胱甘肽(glutathione,GSH)等[2-3]。SOD、谷胱甘肽过氧化物酶(glutathioneperoxidase,GSH-Px)、GSH以及脂质过氧化终产物丙二醛(malondialdehyde,MDA)是机体的主要抗氧化评价指标[4-5]。张健等[6]建立ECV-304细胞过氧化氢氧化损伤模型,以MDA和抗氧化酶为评价指标,研究卡维地洛对过氧化氢致血管内皮细胞氧化应激损伤的保护作用。Ju Hengyin等[7]以MDA和抗氧化酶为评价指标,说明女贞子中的抗氧化酚类物质通过清除自由基活性以及提高抗氧化酶活性从而发挥对过氧化氢诱导的SH-SY5Y细胞氧化损伤的保护作用。近年来,越来越多的中药被认为是外源性的“天然自由基清除剂”,并展开了各种清除自由基的实验研究[8-10]。
生姜是典型的药食同源性植物,为姜科植物姜的新鲜根茎,具有解表散寒、温中止呕、化痰止咳之功效[11]。现代药理研究表明生姜具有抗氧化、改善脂质代谢、降血脂、改善心脑血管系统、防辐射、抗炎、抗微生物、抗肿瘤、降血糖等作用[12]。生姜油树脂是指通过有机溶剂从姜根茎中萃取出来的深琥珀色至深棕色的黏稠液体,一般通过溶剂浸提法、压榨法和超临界CO2流体萃取法萃取。生姜油树脂具有很多的功能特性,如开发天然抗氧化剂、开发天然抗菌剂、医药和保健品等[13]。郑君成等[14]通过GC-MS分析了生姜油树脂的成分,鉴定出76种化合物,烯烃类易挥发性化合物相对含量达56.66%,姜辣素相对含量达到33.95%。生姜油树脂中的姜辣素,其各组分物质分子中均含有创木酚基结构,在常温下为黏稠液体,具有很强的抗氧化性,是一种有效的自由基清除剂。Singh等[15]通过1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)、硫代巴比妥酸(thiobarbituricacid,TBA)等方法研究生姜油树脂对芥子油的抗氧化效果;葛庆丰等[16]采用顺磁共振法测定姜油树脂对DPPH自由基的清除率,均表明生姜油树脂具有很强的抗氧化性。但目前对于生姜油树脂抗氧化性的研究仅局限于化学水平,未深入到细胞水平。
因此,本研究通过建立RAW264.7的过氧化氢损伤模型,研究不同浓度生姜油树脂对过氧化氢所引起的氧化损伤的保护作用,为开发天然抗氧化应激中药添加剂提供理论参考依据。
1 材料与方法
1.1 材料与试剂
生姜油树脂,本实验室制备。生姜烘干后磨粉过筛,利用超临界CO2流体从姜粉中萃取。生姜油树脂经0.45 øm滤膜过滤后于4℃保存。
MDA、SOD、GSH、GSH-Px以及BCA(bicin choninic acid)测定试剂盒 南京建成生物工程公司;噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Sigma公司;DMEM(dulbecco’s modified eagle medium)培养基、胰酶、胎牛血清、双抗(青霉素与链霉素) 美国Gibco公司;其余试剂均为分析纯。
1.2 仪器与设备
HA 121-50-01超临界萃取装置 江苏南通华安超临界萃取有限公司;AL 104电子天平 上海精天电子仪器有限公司;Coster 96 孔细胞培养板 美国Corning公司;SPECTRA MAX plus酶标仪 美国Molecular Devices公司;SW-CJ-IF超净工作台 美国Biological Coporation公司;HEPA Class100细胞培养箱 美国Thermo公司;BX-50显微镜 日本Olympus公司;Allegra 64R台式高速冷冻离心机 美国Beckman Coulter公司。
1.3 方法
1.3.1 细胞培养
将复苏后的RAW264.7细胞株接种于含有10%胎牛血清、1%双抗的DMEM培养液中,置于37℃、5% CO2的培养箱培养。细胞铺满培养瓶底70%~80%时,用1 mL胰酶细胞消化液消化1 min左右,按1∶3传代,培养3代后用于后续实验。
1.3.2 RAW264.7过氧化氢损伤模型的建立
过氧化氢是一种重要的活性氧,外源性过氧化氢易通过细胞膜进入细胞,在细胞内过渡金属存在时通过Fenton反应,形成高活性的自由基,进一步造成细胞损伤[6]。因其操作简单,容易控制,常用于体外模拟细胞的过氧化损伤实验。
取对数生长期的RAW264.7细胞,用胰酶细胞消化液消化后加入DMEM完全培养基,倒置显微镜下计数,调整细胞浓度至2.0×105个/mL。将细胞悬液接种于96孔板中,每孔200 øL,在37℃、5% CO2条件下培养24 h至细胞贴壁,弃去细胞培养液,加入用DMEM完全培养基配制的过氧化氢溶液,过氧化氢溶液的最终浓度分别为0(空白组)、0.1、0.2、0.3、0.4、0.5、1 mmol/L,每个浓度设置6个平行。继续培养24 h后,弃细胞培养液,并用PBS洗涤3次后加入200 øL DMEM完全培养基,每孔再加入10 øL质量浓度为5 mg/mL的MTT溶液,继续培养4 h,弃上清,再加入150 øL DMSO,轻轻振荡使紫色结晶溶解,室温反应10 min后用酶标仪于490 nm波长处测吸光度,并通过公式(1)计算过氧化氢对细胞RAW264.7的抑制率。

式中:A0为过氧化氢空白组的平均吸光度;A1为特定浓度过氧化氢组的平均吸光度。
1.3.3 生姜油树脂剂量筛选
细胞培养过程同1.3.2节,仅将1.3.2节所加入的DMEM完全培养基配制的过氧化氢溶液换成DMEM完全培养基配制的生姜油树脂溶液,生姜油树脂溶液的最终质量浓度分别为0(空白组)、1、2.5、5、10、15、20、25、50 øg/mL。并通过公式(2)计算生姜油树脂对细胞RAW264.7的抑制率。
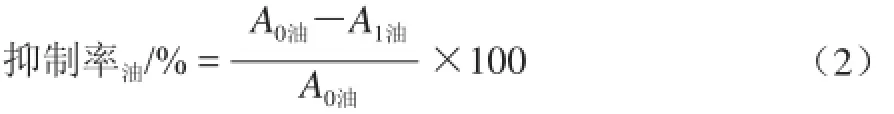
式中:A0油为生姜油树脂空白组的平均吸光度;A1油为生姜油树脂样品组的平均吸光度。
1.3.4 不同质量浓度的生姜油树脂和过氧化氢处理下RAW264.7细胞内和细胞培养液中MDA、GSH含量,SOD以及GSH-Px活力的测定
将10 mL含有2.0×105个/mL RAW264.7细胞的培养液接种于细胞培养皿中,在37℃、5% CO2培养箱中培养24 h,培养至贴壁,弃上清,将贴壁细胞随机分为6组,添加不同成分的培养基培养,如表1。在37℃、5% CO2培养箱中继续培养24 h后将细胞和细胞培养液分离。其中细胞培养液于4℃、1 500 r/min离心5 min后取上清液待测;细胞用PBS清洗细胞3次后,于4℃、1 000 r/min离心10 min后,留细胞沉淀,再加入PBS,冰水浴条件下超声破碎(功率300 W,5 s/次,间隔30 s,重复3次)。采用南京建成生物工程研究所生产的MDA、GSH、SOD、GSH-Px以及BCA试剂盒测定。细胞内的MDA、GSH含量,SOD及GSH-Px活力的计算以蛋白质含量为基础,蛋白质含量的测定参照BCA试剂盒方法所测定。

表1 RAW264.7细胞分组及处理Table 1 Grouping and treatment of RAW 264.7 cells
1.3.5 统计分析
采用SPSS17.0统计软件对实验数据进行统计学分析,实验数据以表示。组间比较采用最小显著性差异(the least significant difference,LSD)检验,P<0.05表示显著性差异。
2 结果与分析
2.1 不同浓度的过氧化氢对RAW264.7细胞增殖的影响
筛选过氧化氢剂量的条件是与对照组比较不能对RAW264.7的正常生长构成影响。由图1可知,与空白组相比,0.2 mmol/L过氧化氢对RAW264.7细胞增殖无显著影响(P>0.05),但高于0.3 mmol/L时均显著抑制RAW264.7细胞增殖(P<0.05)。考虑到0.1 mmol/L的过氧化氢溶液浓度过小,对细胞造成的氧化性损伤不明显,所以选择0.2 mmol/L的过氧化氢作为损伤条件,建立过氧化氢损伤模型,进行下一步实验。
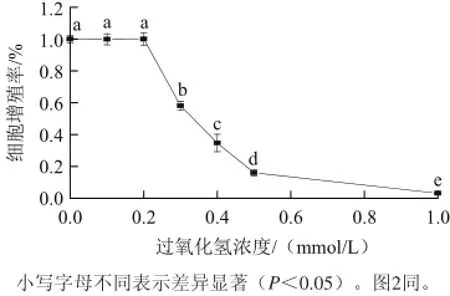
图1 1 不同浓度过氧化氢对RAW264.7细胞增殖的影响Fig.1 Dose-dependent effects of hydrogen peroxide on the viability of RAW 264.7 cells
2.2 不同质量浓度的生姜油树脂对RAW264.7细胞增殖的影响
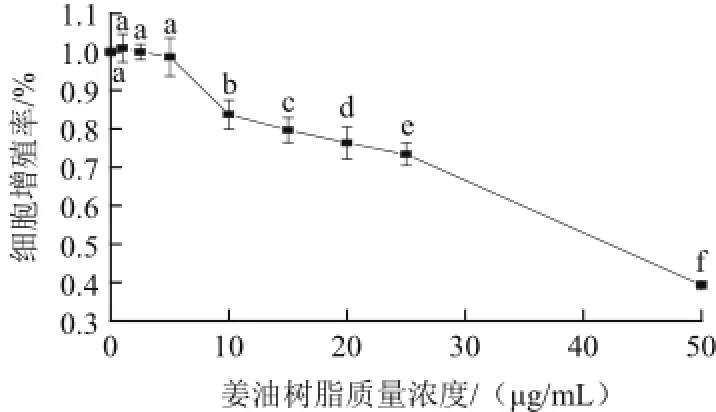
图2 不同质量浓度生姜油树脂对RAW264.7细胞增殖的影响Fig.2 Dose-dependent effects of ginger oleoresin on the viability of RAW 264.7 cells
由图2可知,与空白组相比,5 øg/mL生姜油树脂对RAW264.7细胞增殖无显著影响(P>0.05),但高于10 øg/mL时均显著抑制RAW264.7细胞增殖(P<0.05)。因此,将生姜油树脂的剂量确定为1、3、5 øg/mL。将此质量浓度作为推荐剂量进行进一步实验。
2.3 生姜油树脂和过氧化氢对RAW264.7细胞和细胞培养液中MDA含量的影响
MDA是脂质过氧化的生物标记物之一,几十年来一直被国内外学者用来反映脂质过氧化的水平[17]。如图3所示,与空白组相比,用0.2 mmol/L的过氧化氢处理时,细胞和细胞培养液中的MDA含量显著增加,而5 μg/mL生姜油树脂单独处理RAW264.7细胞时对细胞和细胞培养液中的MDA含量无显著影响,而添加1、3、5 μg/mL的生姜油树脂的联合处理组显著抑制了过氧化氢所引起的细胞和细胞培养液中MDA含量的增加,并呈剂量依赖性(P<0.05)。
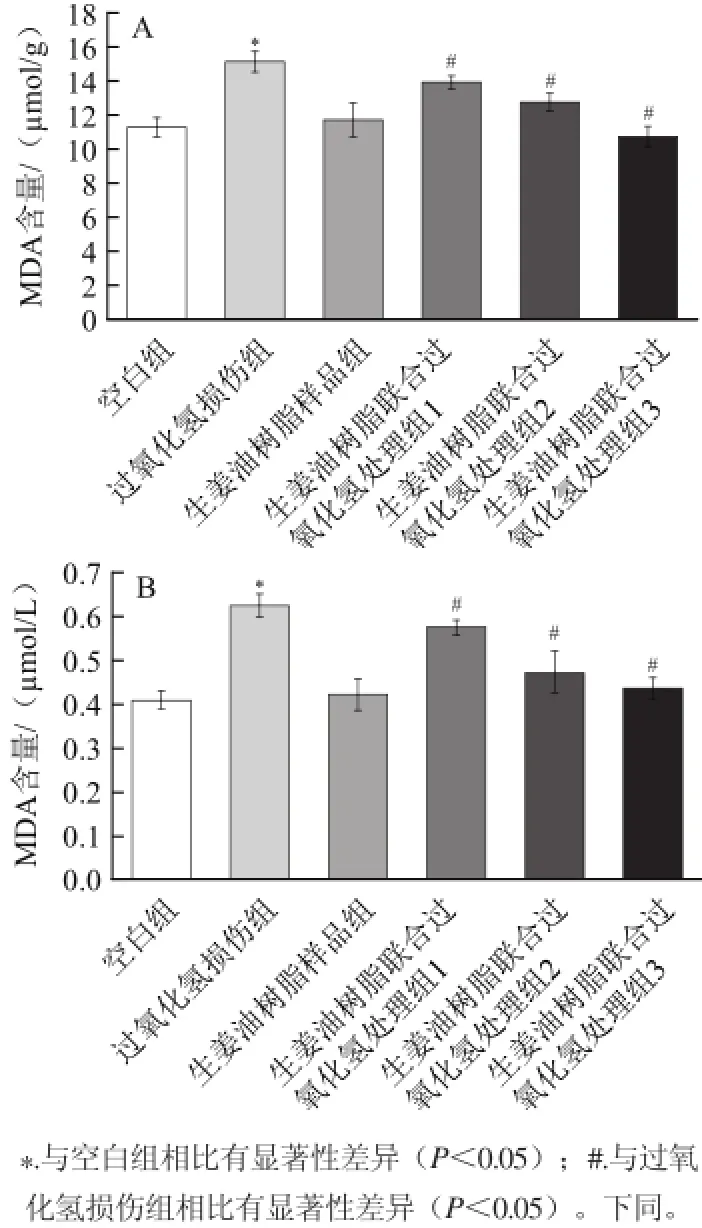
图3 生姜油树脂和过氧化氢对RAW264.77细胞(A)和细胞培养液(B)中MDA含量的影响Fig.3 Individual and combined effects of ginger oleoresin and hydrogen peroxide on MDA levels in RAW 264.7 cells (A) and culture medium (B)
2.4 生姜油树脂和过氧化氢对RAW 264.7细胞和细胞培养液中GSH含量的影响
GSH作为体内主要的生物抗氧剂和自由基清除剂,在维持体内正常的氧化状态和抗氧化防御机制中起着重要的作用[18]。如图4所示,与空白组相比,用0.2 mmol/L的过氧化氢处理时,细胞和细胞培养液中的GSH含量显著降低,而5 μg/mL生姜油树脂单独处理RAW264.7细胞时细胞及细胞培养液中的GSH含量显著增加,而添加1、3、5 μg/mL的生姜油树脂的联合处理组显著抑制了过氧化氢所引起的细胞及细胞培养液中GSH含量的减少,并呈剂量依赖性(P<0.05)。
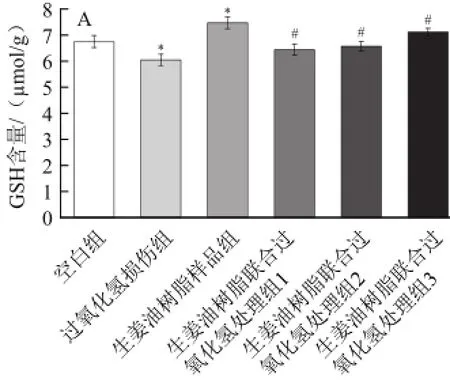

图4 生姜油树脂和过氧化氢对RAW264.77细胞(A)和细胞培养液(B)中GSH含量的影响Fig.4 Individual and combined effects of ginger oleoresin and hydrogen peroxide on GSH levels in RAW 264.7 cell (A) and cell-culture medium (B)
2.5 生姜油树脂和过氧化氢对RAW264.7细胞和细胞培养液中SOD活性的影响
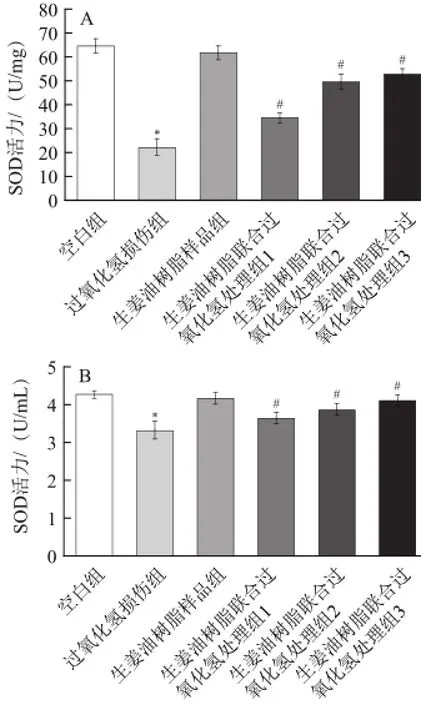
图5 生姜油树脂和过氧化氢对RAW264.77细胞(A)和细胞培养液(B)中SOD活性的影响Fig.5 Individual and combined effects of ginger oleoresin and hydrogen peroxide on SOD activities in RAW 264.7 cell (A) and cellculture medium (B)
抗氧化酶SOD在维持机体的氧化平衡中起着至关重要的作用,SOD活性高低可反映组织清除自由基能力[19]。如图5所示,与空白组相比,用0.2 mmol/L的过氧化氢处理时,细胞和细胞培养液中的SOD活性显著降低,而5 μg/mL生姜油树脂单独处理RAW264.7细胞时对细胞和细胞培养液中的SOD活性无显著影响,而添加1、3、5 μg/mL的生姜油树脂的联合处理组显著抑制了过氧化氢所引起的细胞和细胞培养液中SOD活性的下降,并呈剂量依赖性(P<0.05)。
2.6 生姜油树脂和过氧化氢对RAW264.7细胞和细胞培养液中GSH-Px活性的影响
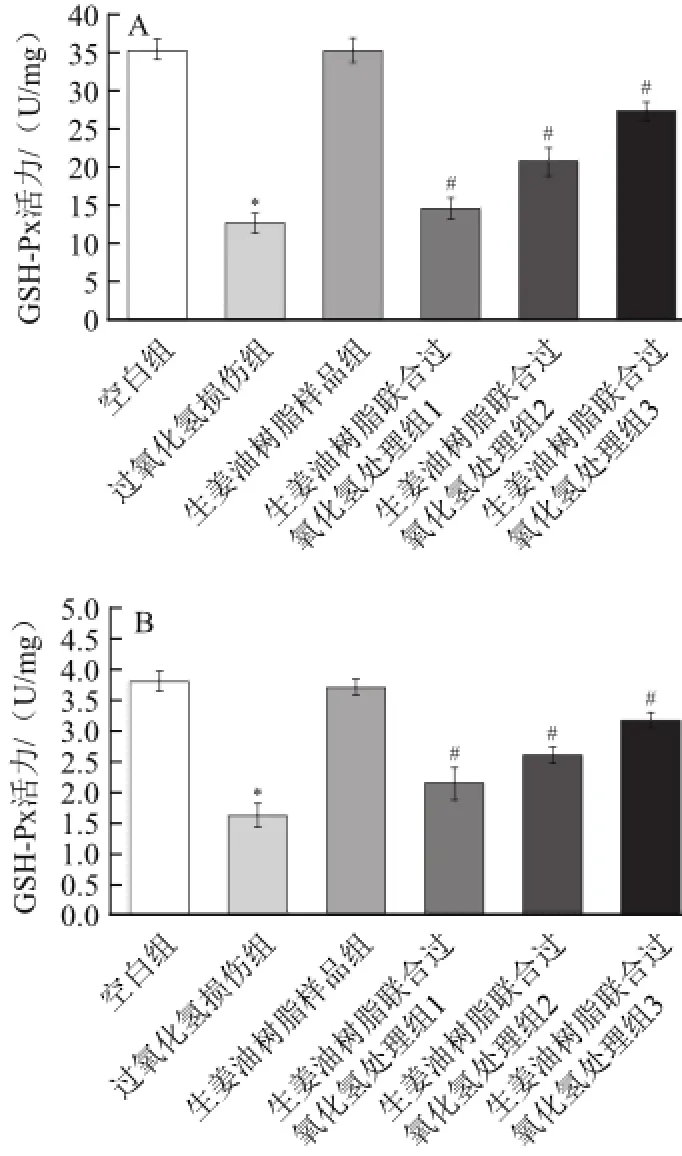
图6 生姜油树脂和过氧化氢对RAW264.77细胞(A)和细胞培养液(B)中GSH-Px活性的影响Fig.6 Individual and combined effects of ginger oleoresin and hydrogen peroxide on GSH-Px activities in RAW 264.7 cell (A) and cellculture medium (B)
GSH-Px能够有效的清除脂质和其他的有机的氢过氧化物,是低水平的氧化应激中发挥保护作用的重要酶[20]。如图6所示,与空白组相比,用0.2 mmol/L的过氧化氢处理时,细胞和细胞培养液中的GSH-Px活性显著降低 而5 μg/mL生姜油树脂单独处理RAW264.7细胞时对细胞和细胞培养液中的GSH-Px活性无显著影响,而添加1、3、5 μg/mL的生姜油树脂的联合处理组显著抑制了过氧化氢所引起的细胞和细胞培养液中GSH-Px活性的下降,并呈剂量依赖性(P<0.05)。
3 讨论与结论
自由基对神经细胞的损害作用是引起生物膜上多不饱和脂肪酸发生脂质过氧化反应,生成大量髓过氧化物酶。由于MDA是髓过氧化物酶稳定的代谢产物,所以常用来反映组织脂质过氧化损伤的程度[21]。GSH能够直接或者通过酶促反应间接的清除自由基[22],并且也参与了GSH-Px催化H2O2生成H2O的反应[23]。SOD和GSH-Px是机体内抗氧化酶系统的重要组成部分,其中SOD通过歧化反应清除氧自由基[24]。GSH-Px通过催化GSH还原一系列的氢过氧化物发挥作用清除氧自由基[25]。因此,测定MDA、GSH含量以及SOD、GSH-Px活性不仅可以反映细胞损伤的原因,还可以判断细胞损伤的程度。
本实验发现经过氧化氢处理后,RAW264.7巨噬细胞与细胞培养液中MDA含量均显著升高、GSH含量以及SOD、GSH-Px活性显著下降,这表明过氧化氢对RAW264.7巨噬细胞具有明显的毒性作用。而用不同浓度生姜油树脂和过氧化氢联合处理组,上述抗氧化性指标较过氧化氢损伤组获得不同程度的改善。生姜油树脂可能通过增强细胞和细胞培养液中SOD活性、GSH-Px活性、GSH含量,提高清除自由基的能力,防止生物膜磷脂分子中的不饱和脂肪酸氧化生成过氧化脂质,保持生物膜的结构完整和膜表面蛋白质的功能,从而保护细胞不受过氧化氢的氧化损伤;通过减少细胞内MDA含量,减轻细胞膜、线粒体膜和磷脂膜等受氧自由基攻击后的损伤程度,从而间接增强了细胞清除氧自由基的能力,使脂质过氧化程度降低,有效地保护了RAW 264.7细胞。生姜油树脂通过调节细胞氧化还原系统,有效地清除了自由基,提高抗氧化能力,从而对过氧化氢所引起的RAW264.7的氧化性损伤起到保护作用。
通过建立RAW264.7细胞的过氧化氢损伤模型,确定0.2 mmol/L的过氧化氢能使RAW264.7细胞抗氧化机能受损;研究了生姜油树脂对过氧化氢引起的RAW264.7细胞损伤的影响,可知生姜油树脂可以延缓0.2 mmol/L过氧化氢引起的RAW264.7细胞和细胞培养液中MDA含量升高、GSH含量以及SOD、GSH-Px活性显著下降,表明生姜油树脂对过氧化氢引起的RAW264.7细胞的氧化性损伤具有保护作用,并呈剂量依赖性。
[1] 李宜培. 线粒体损伤与细胞凋亡[J]. 河南职工医学院学报, 2008, 20(1): 94-97.
[2] PLAZA L, CRESPO I, de PASCUAL-TERESA S, et al. Impact of minimal processing on orange bioactive compounds during refrigerated storage[J]. Food Chemistry, 2011, 124: 646-651.
[3] HUANG Renhua, XIA Renxue, HU Liming, et al. Antioxidant activity and oxygen-scavenging system in orange pulp during fruit ripening and maturation[J]. Scientia Horticuvlturae, 2007, 113: 166-172.
[4] JO S H, SON M K, KOH H J, et al. Control of mitochondrial redox balance and cellular defense against oxidative damage by mitochondrial NADP+-dependent isocitrate dehydrogenase[J]. The Journal of Biological Chemistry, 2001, 276(19): 16168-16176.
[5] LIAO Hui, BANBURY L K. Antioxidant activity of 45 Chinese herbs and the relationship with their TCM characteristics[J]. Evid Based Complement Alternat Med, 2008, 5(4): 429-434.
[6] 张健, 魏欣冰, 丁华, 等. 卡维地洛对过氧化氢致血管内皮细胞氧化应激损伤的保护作用[J]. 中国药理学通报, 2006, 22(5): 620-624.
[7] JU Hengyin, CHEN Shiuching, WU Kuojen, et al. Antioxidant phenolic profile from ethyl acetate fraction of Fructus Ligustri Lucidi with protection against hydrogen peroxide-induced oxidative damage in SHSY5Y cells[J]. Food and Chemical Toxicology, 2012, 50: 492-502.
[8] 郅洁, 李炳奇, 廉宜君, 等. 沙枣多糖的提取及其抗氧化活性的研究[J].中成药, 2009, 31(5): 796-798.
[9] 戴喜末, 熊子文, 罗丽萍. 响应面法优化野艾蒿多糖的超声波提取及其抗氧化性研究[J]. 食品科学, 2011, 32(8): 93-97.
[10] 刘宁, 仇农学, 田玉霞. 超声辅助提取紫苏叶黄酮及其清除自由基作用研究[J]. 西北林学院学报, 2008, 23(1): 158-161.
[11] 郭琪, 李翔, 雷虹, 等. 姜及其制剂抗呕吐作用的研究进展[J]. 解放军医药杂志, 2013, 25(2): 54-56.
[12] 胡炜彦, 张荣平, 唐丽萍, 等. 生姜化学和药理研究进展[J]. 中国民族民间医药, 2008, 17(9): 10-14.
[13] 徐勇, 梁丽敏, 寇秀颖, 等. 姜油树脂的抗氧化活性研究[J]. 食品研究与开发, 2010, 31(6): 32-34.
[14] 郑君成, 高兆建, 刘辉, 等. 姜油树脂的超临界CO2萃取及其抗氧化性研究[J]. 食品科学, 2009, 30(18): 163-167.
[15] SINGH G, KAPOOR I P S, SINGH P, et al. Chemistry, antioxidant and antimicrobial investigations on essential oil and oleoresins of Zingiber officinale[J]. Food and Chemical Toxicology, 2008, 46: 3295-3302.
[16] 葛庆丰, 宋明军, 顾林. 顺磁共振测定姜油树脂的DPPH自由基清除率[J]. 食品科学, 2010, 31(15): 121-125.
[17] LYKKESFELDT J. Malondialdehyde as biomarker of oxidative damage to lipids caused by smoking[J]. Clinica Chimica Acta, 2007, 380(1/2): 50-58.
[18] 张伟, 杨震国, 候永清, 等. N-乙酰半胱氨酸对脂多糖刺激仔猪肠黏膜抗氧化能力的影响[J]. 动物营养学报, 2011, 23(4): 842-847.
[19] 黄清萍, 余薇. 黄芪注射液对大鼠局灶性脑缺氧的抗氧化作用[J].咸宁学院学报, 2007, 21(3): 193-195.
[20] MATÉS J M, PÉREZ-GÓMEZ C, NÐÑEZ de CASTRO I. Antioxidant enzymes and human diseases[J]. Clinical Biochemistry, 1999, 32(8): 595-603.
[21] 余薇, 吴基良, 汪晖, 等. 大蒜多糖对阿霉素所致心肌细胞损伤的保护作用[J]. 中国药理学通报, 2005, 21(1): 96-99.
[22] FANG Yunzhong, YANG Sheng, WU Guoyao. Free radicals, antioxidants, and nutrition[J]. Nutrition, 2002, 18(10): 872-879.
[23] LEI Xingen. in vivo antioxidant role of glutathione peroxidase: evidence from knockout mice[J]. Methods in Enzymology, 2002, 347: 213-225.
[24] 陈大春, 修梅红, 王宁. 利培酮对精深分裂症首次发病患者超氧化物歧化酶和丙二醛及S100B蛋白的影响[J]. 中华精神科杂志, 2010, 43(1): 19-23.
[25] 徐俊吉, 吕士杰, 魏景艳. 含硒抗体模拟谷胱甘肽过氧化物酶的研究进展[J]. 吉林医药学院学报, 2010, 31(4): 220-223.
Protective Effects of Ginger Oleoresin on Hydrogen Peroxide-Induced Toxicity in Cultured RAW 264.7 Cells
BIAN Meng-yao1, FANG Yong2, PEI Fei1, ZHAO Li-yan1, XIN Zhi-hong1, AN Xin-xin1, YANG Fang-mei1, HU Qiu-hui1,*
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2. College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210046, China)
Objective: To study the protective effects of ginger oleoresin on alleviating oxidative damage induced by hydrogen peroxide (H2O2) in RAW 264.7 cells. Methods: A cell model of oxidative damage was established by H2O2treatment. RAW 264.7 cells were treated with different concentrations of ginger oleoresin plus H2O2(0.2 mmol/L). Malondialdehyde (MDA), glutathione (GSH), superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) in these cell and culture medium were measured. Results: Ginger oleoresin with different concentrations significantly attenuated the oxidative damage induced by H2O2. in these cells. Ginger oleoresin decreased the MDA content, increased the GSH content and the activity of SOD and GSH-Px in a dose-dependent manner with the optimal concentration being 5 μg/mL. Conclusion: Ginger oleoresin has protective effects on H2O2-induced injury in RAW 264.7 cells by up-regulating cellular redox system and reducing the level of free radicals.
ginger oleoresin; RAW 264.7; hydrogen peroxide; antioxidant capacity
TS201.2
A
1002-6630(2014)01-0244-06
10.7506/spkx1002-6630-201323048
2013-09-25
国家公益性行业(农业)科研专项(200903018)
卞梦瑶(1989—),女,硕士研究生,研究方向为食品营养与化学。E-mail:kuangdabmy@126.com
*通信作者:胡秋辉(1962—),男,教授,博士,研究方向为食品科学与工程。E-mail:qiuhuihu@njau.edu.cn
