大豆异黄酮对四氯化碳致小鼠肝脏氧化应激和DNA损伤的干预作用
2014-01-17尹学哲赵文玺金爱花全吉淑
尹学哲,赵文玺,金爱花,全吉淑,*
(1.延边大学医院,吉林 延吉 133000;2.延边大学医学院,吉林 延吉 133000)
大豆异黄酮对四氯化碳致小鼠肝脏氧化应激和DNA损伤的干预作用
尹学哲1,赵文玺2,金爱花1,全吉淑2,*
(1.延边大学医院,吉林 延吉 133000;2.延边大学医学院,吉林 延吉 133000)
研究大豆异黄酮对四氯化碳(carbon tetrachloride,CCl4)诱发的急性肝损伤小鼠肝脏氧化应激和DNA损伤的干预作用。将50只小鼠随机分为5组,即正常组、模型组、联苯双脂组及大豆异黄酮高、低剂量组。每日给药1次,连续7 d。实验末期,除正常组外,其余组小鼠腹腔注射CCl4建立急性肝损伤模型。分光光度法检测血清谷丙转氨酶、谷草转氨酶、碱性磷酸酶活性、白蛋白含量,肝脏超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶活性及还原型谷胱甘肽、丙二醛含量,蛋白印迹法检测血红素加氧酶-1蛋白表达,电泳法检测小鼠肝细胞DNA损伤情况。结果表明:大豆异黄酮明显降低CCl4致急性肝损伤小鼠血清谷丙转氨酶、谷草转氨酶、碱性磷酸酶活性;降低肝组织丙二醛水平;升高肝组织总超氧化物歧化酶、Mn-超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶活性和还原型谷胱甘肽水平;升高肝线粒体Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活性;上调肝组织血红素加氧酶-1蛋白表达;并减少肝细胞DNA损伤程度。提示,大豆异黄酮对CCl4致急性肝损伤具有保护作用,其机制可能与其降低肝组织氧化应激和DNA损伤作用有关。
大豆;异黄酮;四氯化碳;肝损伤;氧化应激;DNA损伤
大豆异黄酮(soy isoflavones,ISOF)是一类从大豆中分离的生物活性成分,目前发现的大豆异黄酮共有12种,分为游离型的苷元和相应的糖苷[1]。大豆异黄酮主要分布于大豆胚轴中,具有防治癌症、降低血脂、防止动脉粥样硬化、抗氧化、预防骨质疏松和改善妇女更年期综合征等多种生理功能[1-2]。近年来,大豆异黄酮在肝病防治中的应用也越来越受关注。研究表明,大豆异黄酮对肝纤维化[3-6]及四氯化碳(carbon tetrachloride,CCl4)等化学物质所致的肝损伤[7-10]具有保护作用,但保护机制研究大多局限于其对肝脏和其他脏器的抗氧化作用,尚未见到其对肝线粒体氧化应激和DNA损伤的干预研究。因此,本实验通过建立CCl4致小鼠急性肝损伤模型,进一步观察大豆异黄酮对CCl4致急性肝损伤小鼠肝脏氧化应激和DNA损伤的干预作用,探讨ISOF的保肝作用机制,旨在为大豆资源开发利用提供参考。
1 材料与方法
1.1 试剂与仪器
ISOF(纯度80%) 西安中鑫生物技术有限公司;CCl4美国Sigma公司;联苯双脂(bifendate,BFD)浙江医药股份有限公司新昌制药厂;兔血红素加氧酶-1(heme oxygenase-1,HO-1)多克隆抗体 美国Abcam公司;白蛋白(albnmin,ALB)测试盒、谷丙转氨酶(alanine aminotransferase,ALT)测试盒、谷草转氨酶(aspartate aminotransferase,AST)测试盒、碱性磷酸酶(alkaline phosphatase,ALP)测试盒、总超氧化物歧化酶(total superoxide dismutase,T-SOD)测试盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测试盒、过氧化氢酶(catalase,CAT)测试盒、Mn-超氧化物歧化酶(Mn-superoxide dismutase,Mn-SOD)测试盒、还原型谷胱甘肽(glutathione,GSH)测试盒、Na+-K+-ATP酶(Na+-K+-ATPase)测试盒、Ca2+-Mg2+-ATP酶(Ca2+-Mg2+-ATPase)测试盒、丙二醛(malondialdehyde,MDA)测试盒及蛋白测试盒 南京建成科技有限公司。
3-30 K型离心机 美国Sigma公司;S22PC型分光光度计 上海精密科学仪器有限公司;DYY-12型电泳仪、DYCP-31D型电泳槽、DYCZ-24DN型电泳仪 北京六一仪器厂;Trans- Blot转印槽 美国Bio-Rad公司;UVP凝胶成像分析仪 美国UVP公司。
1.2 动物
昆明小鼠,雄性,体质量为18~22 g,由延边大学实验动物中心提供。
1.3 方法
1.3.1 实验动物分组及处理
将50只小鼠按体质量随机分为5组,即正常组、模型组、BFD组、ISOF高、低剂量组。每日灌胃给药1次,连续7d,BFD剂量为50mg/(kg·d),ISOF高剂量为240mg/(kg·d),低剂量为120 mg/(kg·d),正常组及模型组小鼠则灌 胃等体积生理盐水。末次给药1h后,除正常组腹腔注射等体积大豆油外,其余各组小鼠腹腔注射给予40mg/kg CCl4(注射体积分数为0.5%的CCl4大豆油5mL/kg)。造模期间禁食,不禁水。基础饲料由延边大学实验动物中心提供。饲料中的豆粕成分按食物成分表[11]替换成酪蛋白和淀粉。
1.3.2 血清生化指标的检测
造模16 h,分离血清,检测小鼠血清ALB含量和ALT、AST、ALP活性,按试剂盒操作说明书进行测定,并按公式计算药物对酶活性的抑制率[12]。

式中:A正常、A模型和A治疗分别为正常组、模型组和治疗组的吸光度。
1.3.3 肝组织氧化应激、抗氧化指标以及DNA损伤的检测
常规方法制备肝匀浆和肝线粒体。按照各测试盒操作方法测定T-SOD、CAT、GSH-Px、Mn-SOD、GSH、MDA、Na+-K+-ATPase、Ca2+-Mg2+-ATPase及蛋白水平。常规提取肝微粒体,蛋白印迹法检测肝组织HO-1蛋白表达情况[13]。提取肝细胞DNA,上琼脂糖凝胶电泳,检测肝细胞DNA损伤情况[14]。
1.3.4 统计学方法
数据用±s表示,应用SPSS 11.5统计软件进行t-检验和方差分析,以P<0.05表示差异显著。
2 结果与分析
2.1 ISOF对肝损伤小鼠血清ALT、AST、ALP活性和ALB含量的影响
表1 ISOF对肝脏损伤小鼠血清ALT、AST、ALP活性和ALB含量的影响Table 1 Effect of ISOF on serum ALT, AST, ALP and ALB
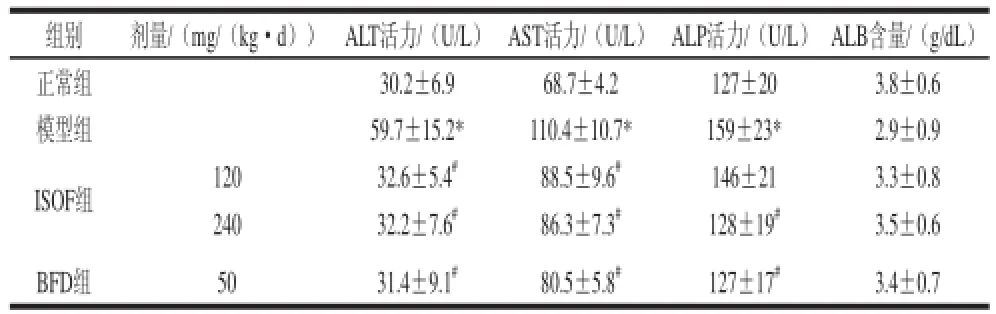
表1 ISOF对肝脏损伤小鼠血清ALT、AST、ALP活性和ALB含量的影响Table 1 Effect of ISOF on serum ALT, AST, ALP and ALB
注:*. 与正常组相比,有显著性差异(P<0.05);#.与模型组相比,有显著性差异(P<0.05)。下同。
组别剂量/(mg/(kg·d))ALT活力/(U/L)AST活力/(U/L)ALP活力/(U/L)ALB含量/(g/dL)正常组30.2±6.968.7±4.2127±203.8±0.6模型组59.7±15.2* 110.4±10.7* 159±23* 2.9±0.9 ISOF组12032.6±5.4#88.5±9.6#146±213.3±0.8 24032.2±7.6#86.3±7.3#128±19#3.5±0.6 BFD组5031.4±9.1#80.5±5.8#127±17#3.4±0.7
由表1可见,与正常组比较,模型组小鼠血清ALT、AST和ALP活性明显升高(P<0.05),表明小鼠急性肝损伤模型制备成功;与模型组比较,ISOF高、低剂量组小鼠血清ALT和AST活性明显降低(P<0.05),ISOF高剂量组血清ALP活性明显降低(P<0.05),提示ISOF对CCl4所致肝损伤具有保护作用。ISOF高剂量组对血清ALT、AST和ALP活性的抑制率分别为93%、58%和97%,接近BFD组的96%、72%和99%,说明其保肝活性稍弱于BFD。与正常组比较,模型组小鼠血清ALB水平趋于降低,而ISOF和BFD干预有增高血清ALB的趋势,但差异均无统计学意义(P>0.05)。
2.2 ISOF对肝损伤小鼠肝组织MDA水平的影响
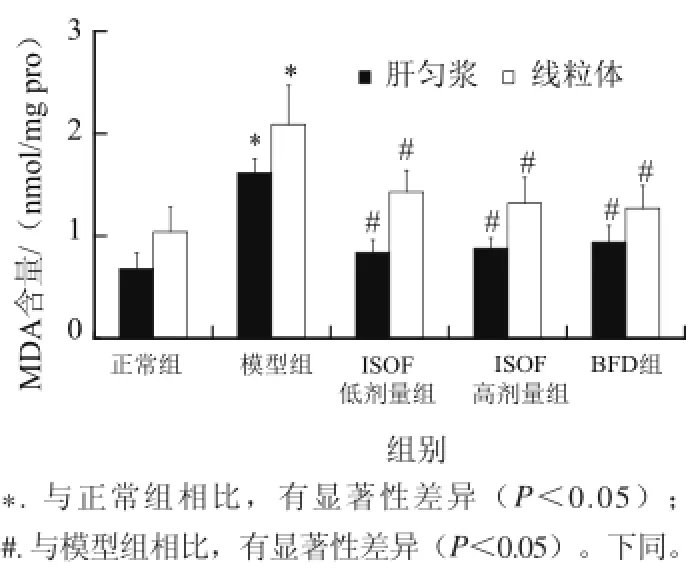
图1 ISOF对肝脏损伤小鼠肝及其线粒体MDA水平的影响Fig.1 Effect of ISOF on MDA level in liver and liver mitochondria
如图1所示,CCl4处理后模型组小鼠肝匀浆及肝线粒体MDA含量明显增高(P<0.05),说明CCl4诱导的急性肝损伤能引起肝细胞脂质过氧化损伤。ISOF治疗可明显降低肝匀浆及肝线粒体MDA水平(P<0.05)。ISOF高剂量组小鼠肝匀浆及肝线粒体MDA水平分别降低79%和73%,接近或超过BFD组的72%和78%。
2.3 ISOF对肝损伤小鼠肝组织GSH水平的影响

图2 ISOF对肝脏损伤小鼠肝及其线粒体GSH水平的影响Fig.2 Effect of ISOF on GSH level in liver and liver mitochondria
由图2可知,CCl4处理使模型组小鼠肝匀浆及肝线粒体GSH含量明显降低(P<0.05),而ISOF治疗可明显升高肝匀浆GSH水平(P<0.05),高剂量ISOF可明显升高肝线粒体GSH水平(P<0.05)。提示,ISOF有助于提高肝组织抗氧化能力。
2.4 ISOF对肝损伤小鼠肝组织抗氧化酶活性的影响
由表2可见,注射CCl4明显降低模型组小鼠肝组织T-SOD、Mn-SOD、GSH-Px、CAT活性(P<0.05),说明CCl4所致的急性肝损伤能引起肝组织抗氧化酶活性的降低。ISOF治疗可明显回升小鼠肝组织T-SOD、Mn-SOD和CAT活性(P<0.05),高剂量ISOF明显升高肝组织GSH-Px水平(P<0.05),提高损伤肝细胞的抗氧化能力。
表2 ISOF对肝脏损伤小鼠肝组织T-SOD、Mn-SOD、GSH-Px和CAT活性的影Table 2 Effect of ISOF on T-SOD, Mn-SOD, GSH-Px and CAT activities in liver ti

表2 ISOF对肝脏损伤小鼠肝组织T-SOD、Mn-SOD、GSH-Px和CAT活性的影Table 2 Effect of ISOF on T-SOD, Mn-SOD, GSH-Px and CAT activities in liver ti
组别剂量/(mg/(kg·d))T-SOD活力/(U/mg)Mn-SOD活力/(U/mg)GSH-Px活力/(U/mg)CAT活力/(U/mg)正常组125.7±6.892.4±11.4326±3725.7±4.9模型组92.7±15.3* 64.7±8.9* 231±40* 19.9±4.5* ISOF组120125.9±12.9#81.5±10.2#285±3232.6±6.5#240132.2±15.4#86.2±12.1#307±36#27.7±5.2#BFD组50124.8±11.7#85.9±11.3#294±34#28.5±6.6#
2.5 ISOF对肝损伤小鼠肝线粒体ATPase活性的影响
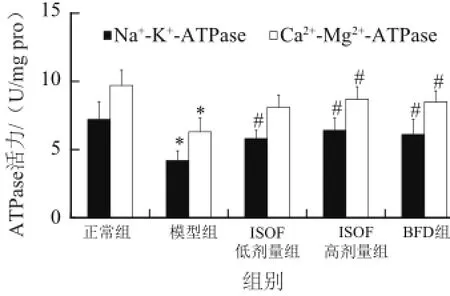
图3 ISOF对肝脏损伤小鼠肝线粒体NNaa+--KK+-ATPPaassee和CCaa22++--MMgg22++-ATPase活性的影响Fig.3 Effect of ISOF on Na+-K+-ATPase and Ca2+-Mg2+-ATPase activities in liver mitocho ndria
如图3所示,与正常组比较,模型组小鼠肝线粒体Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性降低(P< 0.05),说明CCl4引起急性肝损伤小鼠肝线粒体能量代谢障碍及功能损伤。ISOF治疗可回升小鼠肝线粒体Na+-K+-ATPase活性(P<0.05),高剂量ISOF升高肝线粒体Ca2+-Mg2+-ATPase活性(P<0.05)。提示,ISOF有助于改善急性肝损伤小鼠肝线粒体功能障碍。
2.6 ISOF对肝损伤小鼠肝组织HO-1蛋白表达的影响
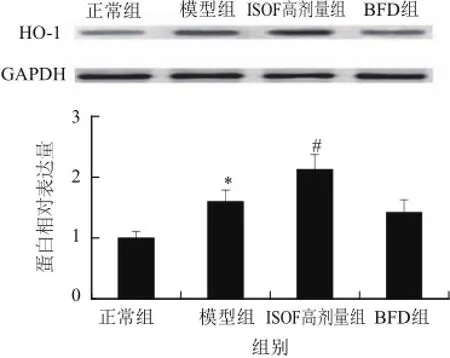
图4 ISOF对肝脏损伤小鼠肝组织HO-1蛋白表达的影响Fig.4 Effect of ISOF on HO-1 protein expression in liver tissues
如图4所示,与正常组比较,模型组小鼠肝组织HO-1蛋白表达增高(P<0.05);与模型组比较,高剂量ISOF组小鼠肝组织HO-1蛋白表达进一步增高(P<0.05),而BFD不影响小鼠肝脏HO-1蛋白表达水平。
2.7 ISOF对肝损伤小鼠肝组织DNA损伤的影响
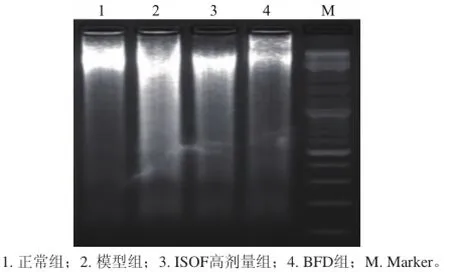
图5 ISOF对肝脏损伤小鼠肝组织DNA损伤的影响Fig.5 Effect of ISOF on DNA damage in liver tissues
DNA电泳结果(图5)显示,注射CCl4可明显增高模型组小鼠肝细胞DNA损伤,DNA随机降解呈模糊涂片状,另有少量部分DNA断裂形成梯形条带,说明CCl4导致肝细胞坏死,并伴随个别肝细胞凋亡。模型组小鼠肝细胞DNA损伤明显高于正常组(P<0.05),而高剂量ISOF可明显降低急性肝损伤小鼠肝细胞DNA损伤程度(P<0.05)。
3 讨 论
CCl4所致急性肝损伤模型是最早使用的经典动物模型。该模型能准确反映肝细胞的功能、代谢及形态学变化,重复性较好,是筛选保肝活性物质的常用模型之一[15-17]。本实验结果表明,ISOF可明显降低CCl4所致急性肝损伤小鼠血清ALT、AST和ALP活性,提示ISOF可减轻CCl4所致肝细胞损伤。
CCl4引发的氧化应激是导致肝损伤的重要途径。CCl4在肝内经微粒体细胞色素P450分解活化,生成活泼的三氯甲基自由基和氯自由基,导致肝微粒体的脂质过氧化增强,使肝细胞结构和功能受到损害[18]。因此,对氧化应激导致肝细胞损伤的研究便成为治疗肝脏疾病的一个重要途径[19-20]。SOD、CAT和GSH-Px是抗氧化酶,而Mn-SOD是线粒体主要抗氧化酶,在细胞内起到保护细胞膜结构和功能完整的作用[21]。GSH是有效的巯基抗氧化剂,能有效防止脂质过氧化,从而减弱氧化应激[22-23]。本实验表明,模型组小鼠肝脏抗氧化酶活性降低,GSH水平降低,脂质过氧化水平升高,而ISOF可增高肝损伤小鼠肝脏抗氧化酶活性和GSH水平,降低脂质过氧化水平。提示ISOF可抑制氧自由基反应和脂质过氧化反应,最终抑制脂质过氧化产物MDA的生成。线粒体是细胞能量代谢中心,自由基与脂质过氧化反应损伤线粒体膜、使伴有ATP依赖性酶活性降低[15]。Na+-K+-ATPase和Ca2+-Mg2+-ATPase是存在于线粒体膜上的重要ATP酶,是反映细胞能量代谢及功能损伤的重要指标[24]。本实验表明,模型组小鼠肝线粒体Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性降低,表明急性肝损伤小鼠肝细胞线粒体能量代谢障碍及钙泵活性降低,存在一定程度的线粒体氧应激和功能损伤。这与文献报道相一致[15,24],CCl4进入机体后产生大量自由基,自由基与脂质过氧化反应损伤线粒体膜,导致线粒体水肿和ATP合成减少,并伴有ATP依赖性酶的活性降低,而后者又能加重线粒体的损伤。ISOF可增高肝损伤小鼠肝组织抗氧化能力,减轻自由基对线粒体的损伤和改善线粒体功能障碍,从而对线粒体起到保护作用。
HO-1是生物体内具有抗氧化、抗凋亡、抗炎、抗增殖等广泛生物学活性的应激蛋白。HO-1的抗氧化机制与其对促氧化底物血红素的分解及多种活性代谢产物的生成密切相关,如胆红素、CO及由于Fe2+的生成而明显增加的铁蛋白水平,均具有直接或间接的抗氧化效应[25]。结果显示,CCl4注射引起模型组小鼠肝组织HO-1表达增高,而ISOF预处理使小鼠肝组织HO-1表达进一步增高,从而对急性肝损伤小鼠肝组织起到应激保护作用。
CCl4可导致肝小叶细胞坏死,细胞核固缩,肝细胞DNA降解。DNA涂片状是细胞坏死的典型生化特征,而DNA片段化是细胞凋亡的典型生化特征[21]。结果显示,CCl4导致大部分肝细胞DNA无规律随机降解,呈现细胞坏死特征,另有部分DNA断裂形成梯形条带,呈现凋亡特征。说明CCl4导致肝细胞坏死,并伴随个别肝细胞凋亡。而ISOF预处理可明显降低急性肝损伤小鼠肝细胞DNA损伤程度。
综上所述,ISOF对CCl4致急性肝损伤具有保护作用,其机制可能与其降低肝组织氧化应激以及DNA损伤有关。该研究结果对ISOF在保肝方面的开发利用具有一定的参考价值。
[1] 尹学哲, 许惠仙, 金爱花, 等. 大豆异黄酮抗家兔动脉粥样硬化作用[J]. 食品科学, 2011, 32(19): 220-223.
[2] 全吉淑, 程静, 刘春彦, 等. 大豆异黄酮联合顺铂对A549 细胞增殖和凋亡的影响[J]. 营养学报, 2011, 33(5): 506-509.
[3] 赵育芳, 张永生, 徐珊, 等. 大豆异黄酮对实验性肝纤维化大鼠肝星状细胞活化的影响[J]. 营养学报, 2010, 32(3): 295-296.
[4] LI Jianfang, CHEN Bicheng, LAI Dandan, et al. Soy isoflavone delay the progression of hepatic fibrosis in thioacetamide-induced model in rats[J]. Scand J Gastroenterol, 2011, 46(3): 341-349.
[5] 育芳, 黄亦琦, 张永生, 等. 大豆异黄酮对肝纤维化大鼠肝损伤保护作用的实验研究[J]. 光明中医, 2010, 25(4): 604-606.
[6] MCCARTY M F, BARROSO-ARANDA J, CONTRERAS F. Genistein and phycocyanobilin may prevent hepatic fibrosis by suppressing proliferation and activation of hepatic stellate cells[J]. Med Hypotheses, 2009, 72(3): 330-332.
[7] 杨丽娜, 郭英, 陈秋丽, 等. 大豆复合物对四氯化碳致大鼠肝损伤的防护作用[J]. 中国老年学杂志, 2009, 29(5): 559-560.
[8] FAN Yuanjing, RONG Yu, LI Pengfei, et al. Genistein protection against acetaminophen-induced liver injury via its potential impact on the activation of UDP-glucuronosyltransferase and antioxidant enzymes[J]. Food Chem Toxicol, 2013, 55: 172-181.
[9] KIM S H, HEO J H, KIM Y S, et al. Protective effect of daidzin against D-galactosamine and lipopolysaccharide-induced hepatic failure in mice[J]. Phytother Res, 2009, 23(5): 701-706.
[10] 黄南山. 三羟异黄酮联合药物GLU保肝解毒的效果与机理性研究[D]. 合肥: 合肥工业大学, 2009: 38.
[11] 中国疾病预防控制中心营养与食品安全所. 中国食物成分表[M].北京: 北京大学医学出版社, 2002: 40.
[12] QUAN Jishu, PIAO Long, XU Huixian, et al. Protective effect of iridoid glucosides from Boschniakia rossica on acute liver injury induced by carbon tetrachloride in rats[J]. Biosci Biotech Biochem, 2009, 73(4): 849-854.
[13] QUAN Jishu, YIN Xuezhe, XU Huixian. Boschniakia rossica prevents the carbon tetrachloride-induced hepatotoxicity in rat[J]. Exp Toxic Pathol, 2011, 63: 53-59.
[14] QUAN Jishu, LI Tian, ZHAO Wenxi, et al. Hepatoprotective effect of polysaccharides from Boschniakia rossica on carbon tetrachlorideinduced toxicity[J]. J Clin Biochem Nutr, 2013, 52(3): 244-252.
[15] 黄玉军, 陈霞, 顾瑞霞, 等. 嗜热链球菌grx02发酵乳对大鼠酒精性肝损伤保护作用的实验研究[J]. 营养学报, 2012, 34(2): 164-171.
[16] 陆艳艳, 邱细敏, 刘湘军, 等. 人工虫草多糖对小鼠CCl4肝损伤的保护作用[J]. 食品科学, 2011, 32(7): 319-322.
[17] 张先淑, 饶志刚, 胡先明, 等. 茯苓总三萜对小鼠肝损伤的预防作用[J].食品科学, 2012, 33(15): 270-273.
[18] 闫冰, 丁安伟, 张丽. 二至丸提取物对小鼠四氯化碳急性肝损伤的保护作用[J]. 中国中药杂志, 2010, 35(22): 3080-3083.
[19] TURRENS J F. Mitochondrial formation of reactive oxygen species[J]. J Physiol, 2003, 552(2): 335-344.
[20] 陈伟平, 谢园沁, 胡金鹿. 蚕蛹油对三种不同类型肝损伤小鼠的保护作用[J]. 食品科学, 2012, 33(15): 291-296.
[21] 张蓓, 薛长湖, 周鑫, 等. 海参和海星脑苷脂对大鼠急性肝损伤影响的比较研究[J]. 营养学报, 2011, 33(1): 19-23.
[22] 牛楠楠, 潘新娟, 李星, 等. 葡萄籽提取物改善砷暴露致大鼠肝损伤的作用及机制[J]. 营养学报, 2012, 34(4): 388-391.
[23] 周斌, 陶明煊, 程光宇, 等. 姬菇多糖对酒精所致小鼠急性肝损伤的保护作用[J]. 食品科学, 2012, 33(23): 323-326.
[24] 宋军, 赵军宁, 王晓东, 等. 芍甘多苷对四氯化碳亚急性肝损伤大鼠肝细胞线粒体保护作用[J]. 中国中药杂志, 2011, 36(7): 931-937.
[25] 邓玥, 揭琴丰, 郝丽萍, 等. 槲皮素通过促进Nrf2转位拮抗人肝细胞酒精性氧化损伤[J]. 营养学报, 2010, 32(6): 532-535.
Intervention Effect of Soy Isoflavones on Hepatic Oxidative Stress and DNA Damage Induced by Carbon Tetrachloride in Mice
YIN Xue-zhe1, ZHAO Wen-xi2, JIN Ai-hua1, QUAN Ji-shu2,*
(1. Yanbian University Hospital, Yanji 133000, China; 2. Yanbian University Medical College, Yanji 133000, China)
The intervention effect of soy isoflavones (ISOF) on oxidative stress and DNA damage in a mouse model of acute liver injury induced by carbon tetrachloride (CCl4) was investigated. Fifty mice were randomly divided into 5 groups including normal control, model control, bifendate (BFD), high-dose ISOF and low-dose ISOF groups. Animals were treated once daily for 7 days. At the end of the experiments, CCl4was injected intraperitoneally to the mice from four groups except the normal control group. Then, alanine aminotransferase (ALT), aspartate aminotransferase (AST), alkaline phosphatase (ALP), albumin (ALB), superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase (GSH-Px), Na+-K+-ATPase, Ca2+-Mg2+-ATPase, reduced glutathione (GSH) and malondialdehyde (MDA) were determined spectrometrically, and protein expression of heme oxygenase-1 (HO-1) was assayed through western blotting, and DNA damage was evaluated by electrophoresis. The results showed that the administration of ISOF reduced serum activities of ALT, AST and ALP GSH-Px; decrease MDA content in liver; in creased total SOD, Mn-SOD, GSH-Px and CAT activi ties and GSH level in li ver; enhanced Na+- K+-ATPase and Ca2+-Mg2+-ATPase activities in liver mitochondria; up-regulated the expression of HO-1 protein; and reduced DNA damage of hepatocytes in mice with acute liver injury. Therefore, ISOF exerts a protective function on acute liver injury induced by CCl4in mice, probably via reducing oxidative stress and DNA damage in liver tissue.
soy; isoflavones; carbon tetrachloride (CCl4); liver injury; oxidative stress; DNA damage
R285.5
A
1002-6630(2014)01-0214-05
10.7506/spkx1002-6630-201401042
2013-01-21
国家自然科学基金项目(30360113;81160539)
尹学哲(1962—),男,教授,博士,研究方向为中药药理学。E-mail:yinxz@ybu.edu.cn
*通信作者:全吉淑(1968—),女,教授,硕士,研究方向为中药药理学。E-mail:quanjs@ybu.edu.cn
