百合多糖对Ⅰ型糖尿病大鼠的降血糖作用
2014-01-17何纯莲
肖 遐,吴 雄,何纯莲
(湖南师范大学医学院,湖南 长沙 410006)
百合多糖对Ⅰ型糖尿病大鼠的降血糖作用
肖 遐,吴 雄,何纯莲*
(湖南师范大学医学院,湖南 长沙 410006)
目的:探讨百合多糖对I 型糖尿病大鼠的降血糖作用。方法:从新鲜百合中提取出百合多糖,采用离子交换层析和凝胶层析 纯 化得到3种多糖;优选碱洗百合多糖、以链脲佐菌素诱导建立I 型糖尿病大鼠模型,通过百合多糖治疗,比较治 疗前后大鼠体质量及空腹血糖的变化、测定治 疗后胰岛素水平以及己糖激 酶、琥珀酸脱氢酶、总超氧化物歧化酶的活性和丙二醛的含量,研究百合多糖对I型糖尿病大鼠的 降血糖作用。结果:百合多糖可减缓糖尿病 大鼠体 质量的负增长;降低空腹血糖(P<0.01 )和 丙二醛含量(P<0.05);升高胰岛素、己糖激酶、琥珀酸脱氢酶和总超氧化物歧化酶活性(P<0.01)。结论:百合多糖一方面通过提高糖代谢酶的活性,促进葡萄糖的摄取和利用;另一方面通过提高机体抗氧化功能,抑制氧自由基对胰岛β细胞的损伤,增加胰岛素分泌,调节I型糖尿病大鼠的血糖。
百合多糖;I 型糖尿病;胰岛素;超氧化物歧化酶
百合为百合科百合属植物,为卫生部审批通过的首批药食兼用的植物,在我国常将其鳞茎加工成中草药和各种保健食品[1];在现存的最早一部本草专著《神农本草经》上就有对其防病治病的药理活性有记载。现代医学研究表明百合多糖具有降血糖、抗肿瘤、抗氧化、抗疲劳、免疫调控等药理作用[2-6]。近年来,中药材所含植物多糖的降血糖控血脂作用备受关注,已有几十余种中药被用于相关研究[7],多糖在降血糖方面有着广阔的应用前景;但是国内外对百合多糖降血糖作用的研究报道较少,对其降血糖机制的研究尚处于起步阶段[8]。
本研究采用水提醇沉的方法从百合中提取出百合粗多糖,经DEAE52-纤维素柱分离纯化出3种百合多糖:水洗百合多糖、盐洗百合多糖、碱洗百合多糖[9]。通过建立链脲佐菌素诱导的Ⅰ型糖尿病大鼠模型[10-11],进行3种百合多糖降血糖作用预实验;经预实验选取降血糖作用效果最好的碱洗百合多糖,用葡聚糖Sephadex G-100凝胶柱进一步纯化[12],并采用高效液相色谱对其平均分子质量进行测定[13-14]。考察纯化后不同剂量的碱洗百合多糖降血糖作用,并对糖尿病大鼠胰岛素水平和相关糖代谢酶进行测定,为研制降血糖功能性食品或天然药物的开发提供参考。
1 材料与方法
1.1 材料与试剂
百合 湖南省龙山县提供。
链脲佐菌素 美国Sigma公司;盐酸苯乙双胍片山东仁和堂药业有限公司;DEAE-Cellulose52 美国Whatman公司;Sephadex G-100 瑞典Pharmacial公司;葡萄糖测定试剂盒 上海荣盛生物药业有限公司;胰岛素(insulin,INS)试剂盒、丙二醛(malondialdehyde,M D A)试剂盒、超氧化物歧化酶(s u p e r o x i d e dismutase,SOD)试剂盒、己糖激酶(hexokinase,HK)试剂盒、琥珀酸脱氢酶(succinate dehydrogenase,SDH)试剂盒 南京建成生物工程研究所;Bradford 蛋白质定量试剂盒 北京鼎国昌盛生物技术公司。
1.2 实验动物
SPF级健康雄性SD大鼠50只,体质量(180±20)g由长沙市开福区实验动物科技 服务部提供,合格证号:SCXK(湘)2009-0012。
1.3 仪器与设备
高速冷冻离心机 美国Beckman Coulter公司;BlueStar紫外-可见分光光度计 北京莱伯泰科仪器有限公司;DZF-6090真空干燥箱 上海精宏实 验设备有限公司;LC-2010A HT高效液相色谱仪 日本岛津公司;ELSD800蒸发光散射器 天津埃文森科技有限公司;ELX800酶标仪 美国Bio-Tek公司;TN-100微型提取浓缩回收机组 温州市利宏轻工机械有限公司。
1.4 方法
1.4.1 百合多糖的提取工艺流程
新鲜百合→洗净切碎、称质量→水提取→离心、过滤→4℃醇沉过夜→离心、过滤→复溶→Sevag法脱蛋白→醇沉、过滤→无水乙醇、无水乙醚、丙酮洗涤→烘干得多糖粗品
1.4.2 百合多糖的分离纯化
将百合多糖粗品配成饱和溶液超声溶解,离心分离得上清液备用。采用DEAE52-纤维素,经预处理后装柱,上样。分别用去离子水、0.04 mol/L NaCl溶液、0.1 mol/L NaOH溶液依次洗脱,用苯酚-硫酸法在波长490 nm处测定收集样中的糖含量。将测得结果以管数为横坐标,吸光度为纵坐标,作出洗脱曲线。根据洗脱曲线图,将各洗脱峰样品收集合并,经浓缩、透析后,加入3倍量95%乙醇,于4℃冰箱静置过夜。离心混合液,将沉淀于通风橱中分别用无水乙醇、无水乙醚、丙酮依次淋洗收集沉淀,真空干燥,得到水洗百合多糖Ⅰ、盐洗百合多糖Ⅱ、碱洗百合多糖Ⅲ。经3种百合多糖治疗Ⅰ型糖尿病大鼠预实验,选取降血糖作用效果最好的碱洗百合多糖Ⅲ以葡聚糖凝胶Sephadex G-100进一步纯化,真空干燥得百合多糖Ⅲ纯品。
1.4.3 百合多糖Ⅲ的平均分子质量测定
采用岛津高效液相色谱系统,恒流泵:L C-2010A HT,色谱柱:T S K g e l G 2 0 0 0 S WXL柱(300 mm×7.8 mm);检测器:ELSD800蒸发光散射器;流动相为超纯水;柱箱温度为室温;进样量10 μL;流速1.0 mL/min;漂移管温度:60℃;气体(N2)压力:(3.00±0.5)bar。葡聚糖标准品6 000、11 800、47 500、112 000、212 000、402 000 kD配成质量分数为0.2%的溶液,按分子质量由小到大的顺序依次进样,测定保留时间,以1gMr(分子质量对数)对TR(保留时间)绘制标准曲线,得线性回归方程y=-4.615 7x+34.291(R2=0.992)。将纯化所得的百合多糖Ⅲ配成质量分数0.2%溶液于相同色谱条件下分析,测定保留时间,代入回归方程计算其平均分子质量。
1.4.4 链脲佐菌素诱导糖尿病大鼠模型的建立
健康雄性SD大鼠50只,随机分为两组,正常对照组(Ⅰ)8只,造模组42只;常规饲料喂养,自由饮食摄水,适应性饲养3 d后,禁食不禁水过夜(约16 h)。将造模组大鼠按55 mg/kg剂量腹腔注射链脲佐菌素,注射72 h后,将全部大鼠禁食过夜,眼眶静脉丛采血,测定空腹血糖值。认为空腹血糖值高于11.0 mmol/L,且出现“三多一少”症状者为造模成功,本实验有32只大鼠符合Ⅰ型糖尿病模型条件。
1.4.5 分组灌胃给药
将糖尿病模型大鼠随机分为4组,每组8只,分别为:糖尿病模型对照组(Ⅱ)、百合多糖低剂量组(Ⅲ)、百合多糖高剂量组(Ⅳ)和药物治疗对照组(Ⅴ)。正常对照组(Ⅰ)和糖尿病模型对照组(Ⅱ)每天灌服等容积生理盐水,百合多糖低剂量组(Ⅲ)与百合多糖高剂量组(Ⅳ)组分别给予百合多糖Ⅲ 100、200 mg/(kg·d)(以体质量计,下同),药物治疗对照组(Ⅴ)灌服150 mg/(kg·d)的盐酸苯乙双胍。灌胃给药时间固定在每天上午9:00,实验为期4周。同时,每隔一段时间对大鼠体质量,饮水摄食量进行称量,并做好记录。
1.4.6 指标测定
末次灌胃结束禁食12 h后,大鼠以2%戊巴比妥钠麻醉,股动脉取全血分离血清,取肝组织用生理盐水制成10%的匀浆,分别用于各相应指标的检测。分别在灌胃15、30 d后禁食12 h,测量体质量、空腹血糖;测定第30天的血清中INS以及血清和肝脏中MDA、总超氧化物歧化酶(T-SOD)活性;测定肝脏中HK、SDH活性。
1.4.7 统计学处理
2 结果与分析
2.1 百合多糖Ⅲ的分离纯化及平均分子质量测定
本实验通过水提醇沉的方法从新鲜百合中提取得到灰白色的百合粗多糖,上DEAE52-纤维素柱洗脱分离纯化,得到的洗脱曲线如图1所示。
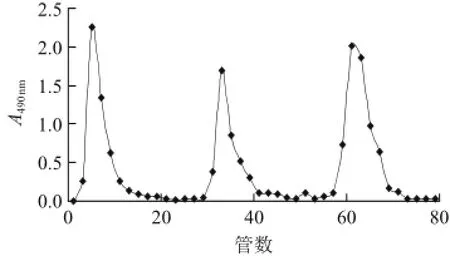
图1 百合多糖的DEAE52-纤维素柱洗脱曲线Fig. 1 DEAE52-cellulose elution profile of lily polysaccharides
由图1可知,百合多糖经水、0.04 mol/L NaCl、0.1 mol/L NaOH阶段洗脱后得到3个峰,依次为百合多糖Ⅰ、Ⅱ、Ⅲ 3个组分,并分别收集各洗脱峰主峰位置的洗脱液浓缩、醇沉、真空干燥。百合多糖Ⅲ经葡聚糖Sephadex G-100凝胶柱层析进一步纯化的洗脱曲线见图2,该洗脱曲线为单一峰形,表明百合多糖Ⅲ已经纯化。收集主峰位置的洗脱液浓缩、真空干燥得百合多糖Ⅲ。
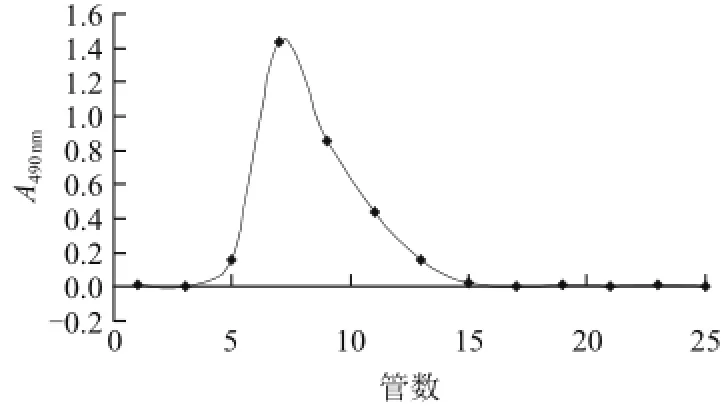
图2 百合多糖Ⅲ的葡聚糖Sephadex G-100洗脱曲线Fig. 2 Sephadex G-100 elution profile of lily polysaccharide Ⅲ
百合多糖Ⅲ的液相图谱见图3,百合多糖Ⅲ有2个峰,其保留时间依次为10.557、11.223 min,其中第1个峰的峰面积较小,糖含量较低,故忽略不计;以11.223 min为该多糖的保留时间计算,带入标准曲线中可得百合多糖Ⅲ的分子质量为94 321 kD。
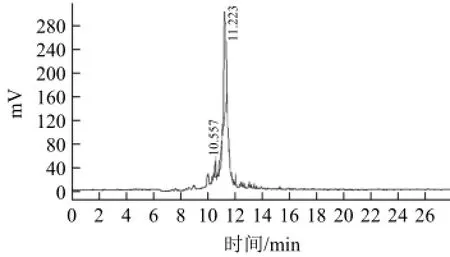
图3 百合多糖Ⅲ的高效液相色谱图Fig.3 Elution profile of lily polysaccharide Ⅲ by HPLC
2.2 百合多糖对Ⅰ型糖尿病大鼠体质量和饮水摄食量的影响
表1 百合多糖对Ⅰ型糖尿病大鼠体质量的Table 1 Effect of lily polysaccharide on body weight intype Ⅰ diabetic rat
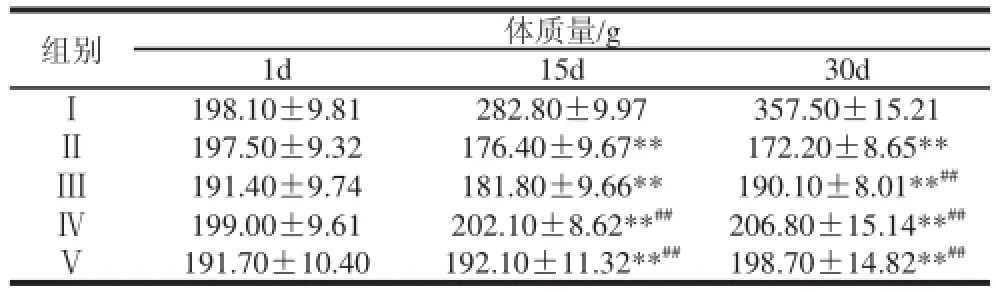
表1 百合多糖对Ⅰ型糖尿病大鼠体质量的Table 1 Effect of lily polysaccharide on body weight intype Ⅰ diabetic rat
注:*. 与正常对照组比较,有显著差异(P<0.05),**. 与正常对照组比较,有极显著差异(P<0.01);#. 与糖尿病模型对照组比较,有显著差异(P<0.05),##. 与糖尿病模型对照组比较,有极显著差异(P<0.01)。下同。
组别体质量/g 1d15d30dⅠ198.10±9.81282.80±9.97357.50±15.21Ⅱ197.50±9.32176.40±9.67**172.20±8.65**Ⅲ191.40±9.74181.80±9.66**190.10±8.01**##Ⅳ199.00±9.61202.10±8.62**##206.80±15.14**##Ⅴ191.70±10.40192.10±11.32**##198.70±14.82**##
由表1可见,在持续灌胃的30d中,Ⅰ组大鼠体质量显著增加;Ⅱ组大鼠体质量由(197.5±9.32)g降至(172.2±8.65)g,表明模型组体质量出现负增长;Ⅲ组大鼠体质量由(191.4±9.74)g减少至(190.1±8.01)g,大鼠体质量无明显改变,但较模型组相比体质量负增长趋势减缓;Ⅳ组大鼠体质量由(199.0±9.61)g增加至(206.8±15.14)g,表明大鼠治疗30 d后体质量较造模时有所增加,但1~30 d自身变化无统计学意义(P>0.05),表明高剂量百合多糖能减缓体质量负增长趋势且出现正增长;Ⅴ组大鼠体质量由(191.7±10.40)g增加至(198.7±14.82)g,大鼠体质量有一定的增加,但变化无统计学意义(P>0.05),表明盐酸苯乙双胍能减缓体质量负增长趋势,且较造模时体质量有所增加。Ⅲ、Ⅳ组与Ⅴ组体质量比较无显著性差异(P>0.05),表明低、高剂量百合多糖对糖尿病大鼠体质量的影响与盐酸苯乙双胍没显著性差别。
由图4可知,Ⅱ组大鼠第3周比第1周平均饮水量显著增多,平均摄食量也增加;与正常对照组相比有极显著性差异(P<0.01)。灌胃给药治疗后,Ⅲ、Ⅳ组每周平均饮水量、平均摄食量都较Ⅱ组有所减少,差异有显著性(P<0.01或P<0.05),与Ⅴ组相比无显著性差异(P>0.05),表明低、高剂量百合多糖对糖尿病大鼠饮水摄食量的影响与盐酸苯乙双胍没显著性差别。治疗第3周和治疗第1周相比,各给药治疗组大鼠饮水量和摄食量都有所减少;大鼠的“三多一少”症状出现好转。
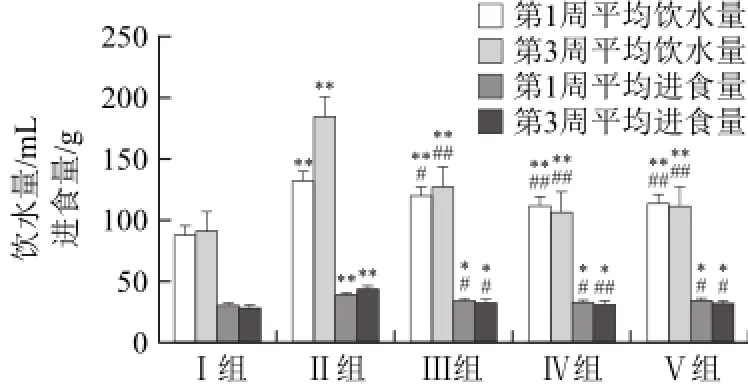
图4 百合多糖对Ⅰ型糖尿病大鼠的平均饮水量和平均进食量的影响(n=8=8)Fig.4 Effect of lily polysaccharide Ⅲ on average intake of water and food in type Ⅰ diabetic rats (n = 8)
2.3 百合多糖对I型糖尿病FBG及INS水平的影响
表2 百合多糖对大鼠空腹血糖和胰岛素的Table 2 Effect of lily polysaccharide Ⅲ on FBG and INS in type Ⅰdiabetic r
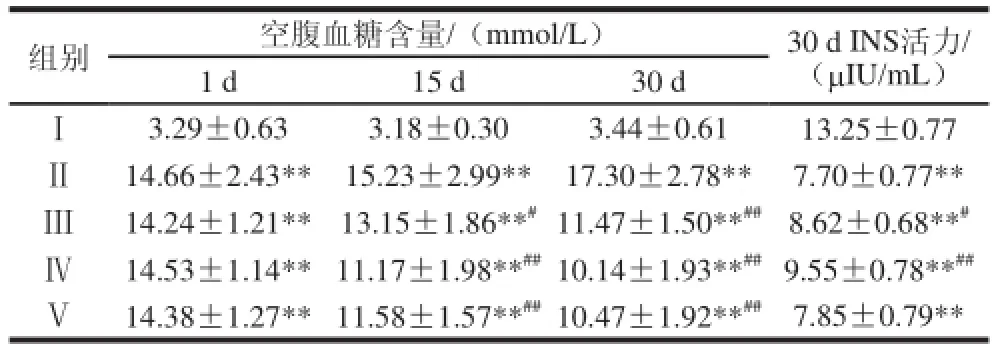
表2 百合多糖对大鼠空腹血糖和胰岛素的Table 2 Effect of lily polysaccharide Ⅲ on FBG and INS in type Ⅰdiabetic r
组别空腹血糖含量/(mmol/L)30 d INS活力/(μIU/mL)1 d15 d30 dⅠ3.29±0.633.18±0.303.44±0.6113.25±0.77Ⅱ14.66±2.43**15.23±2.99**17.30±2.78**7.70±0.77**Ⅲ14.24±1.21**13.15±1.86**#11.47±1.50**##8.62±0.68**#Ⅳ14.53±1.14**11.17±1.98**##10.14±1.93**##9.55±0.78**##Ⅴ14.38±1.27**11.58±1.57**##10.47±1.92**##7.85±0.79**
如表2所示,治疗组持续给药30d后,Ⅲ、Ⅳ、Ⅴ组的血糖水平较Ⅱ组明显下降,差异有统计学意义(P<0.01),且Ⅲ、Ⅳ、Ⅴ各组间无统计学差异(P>0.05);表明低、高剂量百合多糖及盐酸苯乙双胍均能降低Ⅰ型糖尿病大鼠空腹血糖,且三者之间无显著差别。INS活性结果显示,Ⅳ组INS与Ⅱ组比较明显增加,统计学分析有极显著性差异(P<0.01),说明高剂量百合多糖对提高Ⅰ型糖尿病INS有明显的作用;Ⅲ组INS与Ⅱ组比较有增加,统计学分析有显著性差异(P<0.05),表明低剂量百合多糖对提高Ⅰ型糖尿病INS有一定的作用;Ⅴ组INS与糖尿病模型组比较无统计学差异(P>0.05),表明盐酸苯乙双胍不能促进INS的分泌,这与临床研究结果:双胍类药物不刺激胰岛素分泌,主要作用于胰腺外组织相符。综上所述,低、高剂量百合多糖均能降低Ⅰ型糖尿病大鼠空腹血糖,且与盐酸苯乙双胍无显著差别;低、高剂量百合多糖能显著提高Ⅰ型糖尿病大鼠INS,而盐酸苯乙双胍不能促进糖尿病大鼠分泌INS。
2.4 百合多糖对I型糖尿病大鼠肝组织HK、SDH活性的影响
由表3可知,Ⅲ、Ⅳ、Ⅴ组的HK较较Ⅱ组均有显著增加,有极显著性差异(P<0.01)。说明低、高剂量百合多糖及盐酸苯乙双胍均能提高Ⅰ型糖尿病大鼠肝组织中HK活性。与Ⅱ组比较,Ⅲ、Ⅳ、Ⅴ组SDH均有明显增加,有极显著性差异(P<0.01),表明低、高剂量百合多糖及盐酸苯乙双胍均能提高Ⅰ型糖尿病大鼠肝组织中SDH活性。
表3 百合多糖对Ⅰ型糖尿病大鼠肝组织HK 和SDH 活性的影响Table 3 Effect of lily polysaccharide Ⅲ on the activities of HK and SDH in type Ⅰ diabetic)

表3 百合多糖对Ⅰ型糖尿病大鼠肝组织HK 和SDH 活性的影响Table 3 Effect of lily polysaccharide Ⅲ on the activities of HK and SDH in type Ⅰ diabetic)
组别HK活力/(U/g pro)SDH活力/(U/mg pro)Ⅰ23.61±2.3011.30±0.81Ⅱ5.74±0.99**5. 63±0.62**Ⅲ8.58±0.69**##6.61±0.56**##14.59±1.51**##8.85±0.76**##Ⅴ18.46±1.35**##9.71±0.65**##Ⅳ
2.5 百合多糖对I型糖尿病大鼠MDA含量和T-SOD活性的影响
表4 百合多糖对Ⅰ型糖尿病大鼠血清MDA和T-SOD 活性的影响Table 4 Effect of lily polysaccharide Ⅲ on serum MDA and T-SOD in type Ⅰ diabetic

表4 百合多糖对Ⅰ型糖尿病大鼠血清MDA和T-SOD 活性的影响Table 4 Effect of lily polysaccharide Ⅲ on serum MDA and T-SOD in type Ⅰ diabetic
组别MDA含量/(nmol/mL)T-SOD活力/(U/mL)Ⅰ5.72±0.55292.17±7.35Ⅱ9.63±0.80**243.55±7.43**Ⅲ7.81±0.63**##259.50±6.16**##7.30±0.58**##275.83±8.47**##Ⅴ8.99±0.65**251.43±9.79**Ⅳ
表5 百合多糖对Ⅰ型糖尿病大鼠肝组织MDA 和T-SOD 活性的影响Table 5 Effect of lily polysaccharide Ⅲ on MDA and T-SOD in liver tissues of type Ⅰ diabeti)

表5 百合多糖对Ⅰ型糖尿病大鼠肝组织MDA 和T-SOD 活性的影响Table 5 Effect of lily polysaccharide Ⅲ on MDA and T-SOD in liver tissues of type Ⅰ diabeti)
组别MDA含量/(nmol/mg pro)T-SOD活力/(U/mg pro)Ⅰ4.72±0.67153.83±9.62Ⅱ7.98±0.59**102.19±8.87**Ⅲ7.18±0.77**#115.39±9.51**##Ⅳ6.13±0.67**##140.27±6.83**##Ⅴ7.64±0.61**108.06±8.68**
由表4和表5可知,与Ⅰ组相比,造模后大鼠血清和肝脏中MDA含量明显增高,T-SOD活性明显降低,差异有极显著性(P<0.01)。与Ⅱ组相比,Ⅲ、Ⅳ组血清和肝脏中MDA含量均下降,T-SOD活性均升高,尤以Ⅳ组的变化比较明显;进行统计学分析,百合多糖治疗组与Ⅱ组相比均具有极显著性差异(P<0.01),表明低、高剂量百合多糖均能降低Ⅰ型糖尿病大鼠MDA含量和提高T-SOD活性。Ⅴ组血清和肝脏中MDA含量、T-SOD活性与Ⅱ组比较均无显著差别,差异无统计学意义(P>0.05),表明盐酸苯乙双胍对Ⅰ型糖尿病大鼠MDA 含量和T-SOD活性无显著性作用。Ⅳ组血清和肝脏中MDA含量、T-SOD活性与药物治疗对照组相比均具有极显著性差异(P<0.01),表明高剂量百合多糖能降低Ⅰ型糖尿病大鼠MDA含量和提高T-SOD活性且与盐酸苯乙双胍有显著性差别。
3 讨 论
本实验从新鲜百合中分离纯化得到3种百合多糖,通过3种百合多糖对Ⅰ型糖尿病大鼠的降血糖预实验得到碱洗百合多糖的降血糖效果最好,故对其降糖机制进行初步探讨。链脲佐菌素是自由基激活剂,能够选择性的破坏胰岛细胞,引起糖代谢紊乱;又能够使HK缺乏,使葡萄糖不能磷酸化,从而葡萄糖穿过细胞膜逸出,造成高血糖及糖尿病症状[15]。HK是葡萄糖进入细胞后,催化其磷酸化为6-磷酸葡萄糖的第一步酶促反应,是葡萄糖代谢过程中的关键酶之一,也是葡萄糖以糖原形式贮存通路中的第一个限速酶[16]。研究表明,正常或低糖浓度下,葡萄糖转运是细胞对葡萄糖摄取的限速步骤,但高糖条件下,HK对葡萄糖的磷酸化则成为限速步骤[17]。本实验结果显示,HK活性大小顺序为:正常对照组>盐酸苯乙双胍组>百合多糖高剂量组>百合多糖低剂量组>糖尿病模型对照组。提示百合多糖可能通过增强糖尿病大鼠肝组织中HK活性促进肝糖原的合成贮存,减少血液中游离的葡萄糖。
SDH是线粒体的标志酶,在三羧酸循环中是唯一渗入线粒体内膜的酶,为三羧酸循环的关键酶,其活性高低可作为评价三羧酸循环运行程度的指标,在糖代谢过程中起着重要作用[18]。本实验结果显示,糖尿病大鼠治疗30 d后,各药物治疗组的SDH活性均高于模型组,尤以百合多糖高剂量组和盐酸苯乙双胍组为著。提示百合多糖可能通过提高三羧酸循环中SDH的活性,增加糖的利用,从而改善糖代谢。本实验研究结果与有关报道一致[19]。因此初步认为,百合多糖对Ⅰ型糖尿病大鼠的降血糖作用机制之一可能是百合多糖直接或间接地提高了糖代谢酶的活性,促进周围组织对葡萄糖摄取和利用,抑制肝糖异生及糖原分解,减少肝糖输出,使血糖下降。
自由基清除剂是一种能够干扰自由基连锁反应的引发及扩散过程,并抑制自由基反应过程的物质[20]。SOD是机体清除氧自由基的重要酶,SOD的活性直接反映机体抗氧化水平;MDA是自由基引起的脂质过氧化的主要产物之一,其含量可间接体现机体抗氧化能力及清除氧化产物的能力[21]。本实验结果,模型组糖尿病大鼠体内的T-SOD活性低于正常对照组,而MDA含量高于正常对照组,表明糖尿病大鼠体内的自由基清除出现障碍。药物治疗对照组大鼠血糖明显下降,但INS无明显变化,其血清和肝脏中T-SOD活性和MDA含量也无显著性变化;而百合多糖高剂量组INS明显增加,其血清和肝脏中T-SOD活性有所提高,MDA含量有所减少。表明大鼠INS的分泌与其T-SOD活性和MDA含量存在一定联系,即可能是糖尿病大鼠的抗氧化水平对其胰岛素的分泌有一定的影响,这与国内外学者研究关于运用抗氧化剂治疗糖尿病患者能最大限度地保护残存的胰岛功能相符[22-23]。故初步认为,百合多糖对Ⅰ型糖尿病大鼠的降血糖作用的另一机制可能是百合多糖能提高机体抗氧化功能,抑制氧自由基对胰岛β细胞的损伤,使胰腺中残留的部分胰岛β细胞代偿增生,增加胰岛素分泌。
综合分析,百合多糖对Ⅰ型糖尿病大鼠的降血糖作用一方面通过提高机体糖代谢酶的活性,促进葡萄糖的摄取和利用,从而达到调节糖代谢、降低血糖、改善糖尿病症状的作用;另一方面通过提高机体抗氧化功能,抑制氧自由基对胰岛β细胞的损伤,增加胰岛素分泌。
[1] 赵秀玲. 百合的营养成分与保健作用[J]. 中国野生植物资源, 2010, 29(1): 44-46.
[2] 刘成梅, 付桂明, 涂宗财, 等. 百合多糖降血糖功能研究[J]. 食品科学, 2002, 23(6): 113-114.
[3] 张典, 弥曼, 姜凤良, 等. 百合多糖对人肝癌HePG2 细胞CyclinD1 和COX-2 的影响[J]. 细胞与分子免疫学杂志, 2011, 27(5): 582-584.
[4] MUCAJI P, HALADOVA M, EISENREICHOVA E, et al. Constituents of Lilium candidum L. and their antioxidative activity[J]. Ceska Slov Farm, 2007, 56(1): 27-29.
[5] 何纯莲, 杨小红, 黄浩, 等. 百合多糖的抗疲劳作用[J]. 湖南师范大学学报: 医学版, 2009, 6(3): 9-11.
[6] 李新华, 弥曼, 李汾. 百合多糖免疫调节作用的实验研究[J]. 现代预防医学, 2010, 37(14): 2708-2709.
[7] 王慧芳, 董玉山, 喇万英. 药食两用中药降血糖作用研究进展[J]. 中国煤炭工业医学杂志, 2010, 13(5): 820-821.
[8] 李玉萍, 皮小芳, 刘成梅, 等. 百合多糖降糖作用机理的体外研究[J].时珍国医国药, 2012, 23(8): 1964-1966.
[9] LIU C, FU G, TU Z, et al. Functional polysaccharide from lilies[J]. Transactions of the ASAE, 2005, 48(1): 257-261.
[10] 徐叔云, 卞如濂, 陈修. 药理实验方法学[M]. 北京: 人民卫生出版社, 2002: 86-88.
[11] 王太成, 任大力, 陈启龙. 链脲佐菌素诱导1型糖尿病大鼠模型方法改进[J]. 新疆医科大学学报, 2010, 33(5): 499-500.
[12] 高莉, 王强, 帕提古力·玛合木提. 核桃隔膜多糖的分离纯化及单糖组成分析[J]. 食品科学, 2010, 31(21): 182-184.
[13] LIN L, LEE M L, EATOUGH D J. Gas chromatographic analysis of organic marker compounds in fine particulate matter using solid-phase microextraction[J]. Air & Waste Manage Assoc, 2007, 57(1): 53-58.
[14] 韩振泰, 赵玉娟, 刘惠文, 等. 高效液相色谱法测定灵芝多糖含量[J].中国农业科技导报, 2009, 11(增刊1): 65-67.
[15] KIHO T. Hypoglycemic activity of polysaccharide fraction from Rehmannia glutinosa Libosch. f. hueichingensis Hsiao and the effect on carbohydrate metabolism in normal mouse liver[J]. Planta Med, 2002, 112(6): 393-400.
[16] 魏媛媛, 李潇, 阿吉艾克拜尔·艾萨, 等. 石榴花多酚对链脲佐菌素诱发2 型糖尿病大鼠糖代谢的影响[J]. 中国医院药学杂志, 2011, 31(7): 537-540.
[17] 樊怡, 马健飞. 蛋白激酶C对腹膜间皮细胞己糖激酶活性的调控[J].中华医学杂志, 2005, 85(37): 2619-2622.
[18] 张梅, 马凯, 张宏馨, 等. 富铬酵母对糖尿病模型小鼠肝组织琥珀酸脱氢酶活性的影响[J]. 山东医药, 2010, 50(3): 44-45.
[19] 杨宏莉, 张宏馨, 李兰会, 等. 山药多糖对2 型糖尿病大鼠HK、SDH及MDH 活性的影响[J]. 辽宁中医药大学学报, 2010, 12(1): 38-39.
[20] 刘明学, 李琼芳, 刘强, 等. 天麻多糖分离、结构分析与自由基清除作用研究[J]. 食品科学, 2009, 30(3): 29-32.
[21] DEVI G S, PRASAD M H, SARASWATHI I, et al. Free radicals antioxidant enzymes and lipid peroxidation in different types of leukemias[J]. Clin Chim Acta, 2000, 293(1/2): 53-62.
[22] BITAR M S, WALID S, PILCHER C W, et al. Alpha-lipoic acid mitigates insulin resistance in Goto-Kakizaki rats[J]. Horm Mdab Res, 2004, 3 6: 542-549.
[23] DA R R, ASSALONI R, CERIELO A. The preventive anti-oxidant action of thiazolidinediones: a new therapeutic prospect in di abetes and insulin resistance[J]. Diabet Med, 2004, 21: 1249-1252.
Hypoglycemic Effect of Lily Polysaccharides in Type Ⅰ Diabetic Rats
XIAO Xia, WU Xiong, HE Chun-lian*
(Medical College, Hunan Normal University, Changsha 410006, China)
Objective: To explore the hypoglycemic effect of lily polysaccharides in type Ⅰ diabetic rats. Methods: Lily polysaccharide was extracted from fresh lily bulbs and purified through ion-exchange chromatography on a DEAE52 cellulose column. An alkaline-soluble fraction was obtained from the eluates from the DEAE52 cellulose column and proved to be a single component by gel filtration chromatography. The purified polysaccharide was used to treat rat models of t ypeⅠ diabetes induced b y streptozotocin. The changes in body weight, fasting blood gluco se (FBG), insulin (INS), hexokinase (HK), succinic dehydrogenase (SDH), total superoxide dismutase (T-SOD) and malondialdehyde (MDA) were determined in diabetic rats before and after the treatment. Results: The lily polysaccharide could significantly slow down the negative growth of body weights in diabetic rats, reduce the contents of FBG (P < 0.01) and MDA (P < 0.05), and significantly increase INS, HK, SDH and T-SOD (P < 0.01). Conclusion: Lily polysaccharide exerts hypoglycemic effect in type Ⅰdiabetic rats through enhancing the activities of antioxidant enzymes, improving antioxidant function, inhibiting oxygen free radical damage to pan creatic β cells and increasing insulin secretion.
lily polysaccharide; type I diabetic rats; insulin (INS); superoxide dismutase (SOD)
R587.1
A
1002-6630(2014)01-0209-05
10.7506/spkx1002-6630-201401041
2013-01-19
国家自然科学基金项目(21176063);湖南省长沙市科技局科技计划项目(K1303022-31);湖南省教育厅重点项目(12A085);湖南省科技厅科技计划项目(2013SK3134)
肖遐(1971—),女,讲师,硕士,主要从事药物化学与药物合成研究。E-mail:344685809@qq.com
*通信作者:何纯莲(1969—),女,教授,博士,主要从事天然产物功能活性成分研究与开发。E-mail:chunlianhe68@163.com
