高活性谷氨酰胺酶基因glsA2在枯草芽孢杆菌BJ3-2染色体上的定点整合
2014-01-17吴拥军刘艳敏王亚娟
卢 彪,吴拥军*,刘艳敏,王亚娟,唐 雪
(贵州大学生命科学学院,贵州 贵阳 550025)
高活性谷氨酰胺酶基因glsA2在枯草芽孢杆菌BJ3-2染色体上的定点整合
卢 彪,吴拥军*,刘艳敏,王亚娟,唐 雪
(贵州大学生命科学学院,贵州 贵阳 550025)
以枯草芽孢杆菌BJ3-2的glsA1基因为同源序列,通过构建单交换整合载体,将高活性谷氨酰胺酶基因glsA2定点整合入BJ3-2菌株染色体中,获得能够稳定遗传的重组菌株BJ3-2A2。经检测重组菌株谷氨酰胺酶活力为BJ3-2菌株的3.36倍。利用重组菌株BJ3-2A2发酵豆豉,全氨基酸检测显示,重组菌株发酵的豆豉谷氨酸含量比出发菌株高12.8%。说明枯草芽孢杆菌BJ3-2可以转化且为RecE+菌株,glsA2基因在BJ3-2菌株染色体上可实现较高活性表达,并提高发酵豆豉的鲜味。
枯草芽孢杆菌;同源重组;单交换;谷氨酰胺酶基因
枯草芽孢杆菌是革兰氏阳性细菌,具有非致病性、分泌蛋白能力强的特性和良好的发酵基础,是美国食品药物管理局(Food and Drug Administration,FDA)和中国农业部批准使用的安全菌株,广泛应用于食品发酵行业[1-2]。
枯草芽孢杆菌中的质粒在复制时经常出现不稳定单链(ssDNA)形式,导致质粒丢失[3],因此对于枯草芽孢杆菌的基因改造主要是针对染色体基因的改造。而枯草芽孢杆菌中染色体同源序列整合大多发生在RecE+枯草芽孢杆菌内,RecE蛋白与大肠杆菌中的RecA酶类似,是一种用以重组修复及基因交换的重组酶[4]。
枯草芽孢杆菌BJ3-2为本研究室从贵州水豆豉中分离得到的一株发酵风味较好,可作为工业生产应用的豆豉发酵菌株[5]。实验将前期从枯草芽孢杆菌GA317中克隆得到的高活性谷氨酰胺酶基因glsA2[6]以单交换的方式定点整合入BJ3-2菌株获得重组菌株BJ3-2A2,进而对BJ3-2菌株是否为可转化菌株、RecE+菌株;glsA2基因整合入BJ3-2菌株染色体后能否存在活性;以及重组菌株的产谷氨酰胺酶能力等问题进行验证,为今后通过双交换重组或RED重组食品级置换BJ3-2菌株中的glsA基因[6]提供参考。
1 材料与方法
1.1 菌株与质粒
B.subtilis BJ3-2、E.coli DH5α 本实验室保存。
质粒pMD18、pMD18-glsA1、pMD18-glsA2、pET28b本实验室保存。
1.2 试剂与仪器
基因组提取试剂盒 美国Promega公司;质粒提取试剂盒、DNA纯化试剂盒 美国Omega公司;Bacterium Glutaminase Assay Kit 美国Genmed公司;Taq酶、限制性内切酶、T4 DNA连接酶、DNA Marker日本TaKaRa公司;其他试剂均为国产分析纯。
MyLycler PCR仪、Universal Hood凝胶成像分析仪、Gene Pulser Xcell 美国Bio-Rad公司;L8800全自动高速氨基酸分析仪 日本日立公司。
1.3 方法
1.3.1 常规方法[7-8]
质粒提取、B.subtilis基因组提取、采用试剂盒方法进行;DNA酶切、片段回收、连接采用常规方法。
1.3.2 PCR引物设计
按glsA2基因序列设计引物(下划线均为酶切位点,下同),Pgsa-F:CGCTGCAGATGCA GTGCATTG AAACAAAC (PstⅠ);Pgsa-R:CGAAGCTTCGGGCA TGCATGCTCCAACCTTCTTG (Hind Ⅲ)。
按pMD18载体上Amp基因及glsA2基因序列设计引物,Pamp-F:GCAAGCTTATGAGTATTCAACATTTC(Hind Ⅲ);Pgsa-R:CGAAGCTTCGGGCATGCATGC TCCAACCTTCTTG (Hind Ⅲ)。
按pET28b载体上kan基因序列设计引物,Pkan-F:CGGGGTACCCATGAGCCATATTCAACGGG (KpnⅠ);Pkan-R:GCTCTAGATTAGAAAAACTCATCGAGCATC(XbaⅠ)。
1.3.3 含glsA2基因的单交换整合载体的构建
以pMD18为骨架,分别克隆入glsA1、glsA2、kan这3个基因,其中glsA2为目的基因;glsA1为B.subtilis BJ3-2的同源序列;kan为重组菌株BJ3-2A2抗性筛选标记。构建过程见图1。以pMD18-glsA2质粒为模板,利用引物Pgsa-F/Pgsa-R扩增得到含双酶切位点PstⅠ/HindⅢ的glsA2基因,并克隆入pMD18-glsA1质粒,获得质粒pMD18-glsA1-glsA2并转化E.coli DH5α;以pMD18-glsA1-glsA2质粒为模板,利用引物Pamp-F/Pgsa-R扩增得到首尾均带HindⅢ酶切位点的、去除部分无关序列的简化质粒pMD18’-glsA1-glsA2片段,将pMD18’-glsA1-glsA2片段连接环化为pMD18’-glsA1-glsA2质粒并转化E.coli DH5α;以pET28b质粒为模板,利用引物Pkan-F/Pkan-R扩增得到含双酶切位点KpnⅠ/XbaⅠ的kan基因,克隆入pMD18’-gls A1-glsA2质粒,获得单交换重组质粒pTKGG并转化E.coli DH5α。

图1 单交换载体构建过程示意图Fig.1 Diagram showing the construction process of a single exchange vector pTKGG
1.3.4 电转BJ3-2菌株及重组菌株的筛选
BJ3-2菌株感受态的制备参照文献[9]。电转缓冲液为272mmol/L蔗糖与10%甘油的去离子水溶液。质粒加入量约1μg,电转条件为2.5kV,200Ω,25μF,2mm[10-11]。电击后感受态细胞转移至0.8 mL LB液体培养基中,37℃、180 r/min振荡1 h,菌体涂布于LB固体平板上(含卡那霉素2 μg/mL),37℃培养过夜[12]。挑取重组子进行PCR鉴定,获得阳性重组菌株BJ3-2A2。
由于pMD18质粒上所带复制子只能被大肠杆菌识别,而不能被枯草芽孢杆菌(革兰氏阳性菌)识别[13],致使单交换载体pTKGG在BJ3-2菌株中无法复制。因此,单交换重组质粒pTKGG通过电转进入BJ3-2菌株中后,即通过同源重组整合到BJ3-2菌株染色体上,重组菌株通过传代丢失单交换重组载体pTKGG。
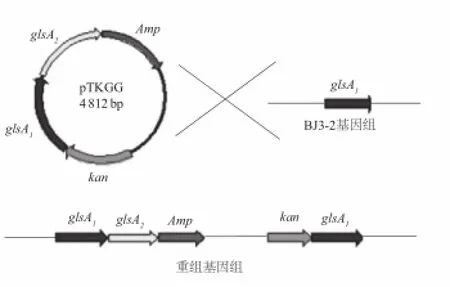
图2 重组菌株通过传代丢失单交换整合重组载体示意图Fig.2 Diagram showing the integration of single exchange
图2为pTKGG载体整合入BJ3-2菌株的示意图[14],BJ3-2菌株在glsA1基因后将整个载体整合入染色体。因此可通过PCR检测glsA2和kan基因来鉴定阳性重组菌。
1.3.5 传代培养重组菌株BJ3-2A2检测重组基因的稳定性
以体积分数0.1%的接种量将重组菌株BJ3-2A2接种LB液体培养基连续传代20次后利用PCR检测基因稳定性。
1.3.6 重组菌株BJ3-2A2的谷氨酰胺酶酶活力测定
采用Bacterium Glutaminase Assay Kit检测,基于底物谷氨酰胺在谷氨酰胺酶的作用下,转化为谷氨酸和氨气,进而在谷氨酰胺脱氢酶的催化下,伴随着氧化型烟酰胺腺嘌呤二核酸(NAD+)转化为还原型烟酰胺腺嘌呤二核苷酸(NADH),产生吸收峰值的变化(340 nm波长),来定量分析谷氨酰胺酶的活性。酶活力单位定义:在特定条件下,1 min内转化1 μmol底物所需的酶量,为一个酶活力单位,1 U。
1.3.7 发酵豆豉的氨基酸组分及含量检测
利用BJ3-2菌株及重组菌株BJ3-2A2进行豆豉发酵。发酵豆豉研钵研磨,参照GB/T 5009.124—2003《食品中氨基酸的测定》,采用全自动高速氨基酸分析仪上样检测,并验证差异性。
2 结果与分析
2.1 单交换重组质粒pTKGG的构建及单交换重组菌株的检测
扩增模板为连续传代20次后的BJ3-2A2菌株基因组。BJ3-2A2菌株经质粒提取验证无质粒存在,图3显示,PCR扩增glsA1、glsA2、kan基因片段大小分别约为984、924 bp和816 bp,均与预期片段大小一致。因此,glsA2、kan基因均已整合入菌株染色体上,该菌为单交换阳性重组菌。

图3 重组菌株基因组ggllssAA1、ggllssAA2、kkaann基因的PPCCRR扩增Fig.3 PCR amplification of the genes ggllssAA1, ggllssAA2and kkaann from recombinant strain
2.2 整合基因稳定性检测
重组菌株BJ3-2A2连续传代20次后,利用PCR检测菌株中glsA2基因的稳定性。由图4可知,转接培养20代后进行检测的10个菌落全部为阳性,表明glsA2基因在BJ3-2A2菌株中能够稳定遗传。

图4 重组菌株基因组kkaann基因的PPCCRR扩增Fig.4 PCR amplification of the gene kan from recombinant strain
2.3 重组菌株BJ3-2A2谷氨酰胺酶活力
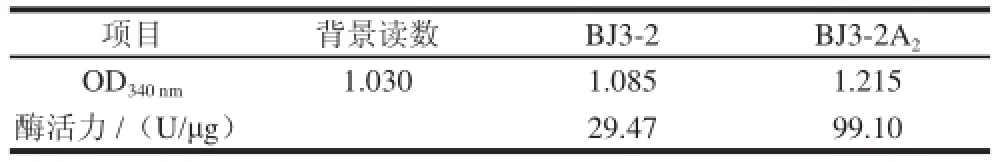
表1 重组菌株BJ3--22AA2酶活力比较Table 1 Comparison of enzymatic activities between BJ3-2 and BJ3-2A
对相同培养条件下的BJ3-2菌株及BJ3-2A2菌株利用Bacterium Glutaminase Assay Kit检测谷氨酰胺酶酶活力,结果见表1,两株菌的酶活力分别为29.47、99.10 U/øg,重组菌株酶活力是BJ3-2菌株的3.36倍。
2.4 发酵豆豉氨基酸含量
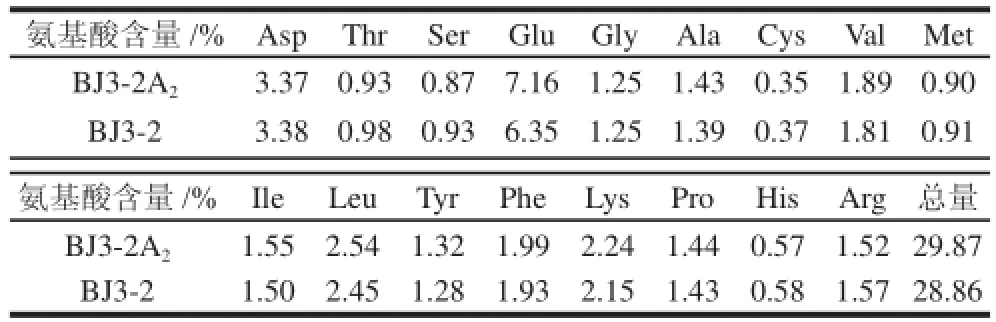
表2 豆豉氨基酸含量对比Table 2 Comparison of amino acid composition and content in douchi fermented with different strains
对BJ3-2A2、BJ3-2的豆豉发酵产物分别进行氨基酸含量分析,由表2可知,两种发酵豆豉的17种氨基酸中仅谷氨酸含量有较为明显的变化(P<0.05),BJ3-2A2菌株比BJ3-2菌株高出12.8%。分析原因与整合的glsA2基因有关,谷氨酰胺酶活性提高,使谷氨酰胺转化为谷氨酸,进而得到较高含量谷氨酸。
3 结论与讨论
由于遗传背景的原因,现研究多是对遗传背景清楚、确定可转化且具RecE+的枯草芽孢杆菌标准株(如枯草芽孢杆菌168)进行研究[15-17],而对于其他野生型枯草芽孢杆菌的分子改造研究较少。本实验对野生型并已作为工业生产应用的枯草芽孢杆菌BJ3-2进行染色体整合,证实了枯草芽孢杆菌BJ3-2为可转化且具有同源重组酶活性的RecE+菌株,可通过同源重组方式对其染色体进行改造,为今后利用同源重组或Red/ET重组[18-20]等方法改良食品级菌株奠定基础。
基因表达产物活性的增加主要通过在结构基因上游调控区增加强启动子、增加结构基因剂量、优化结构基因等方式进行。实验获得的重组菌株BJ3-2A2较原菌株BJ3-2从glsA基因数量来看新加入1个glsA1和1个glsA2,然而重组菌株BJ3-2A2与原菌株BJ3-2的谷氨酰胺酶活力对比可以看出重组菌株的谷氨酰胺酶活力比原菌株高2.36倍。因此在忽略其他影响因素的情况下认为新增加的glsA1基因能提高1倍酶活力,而glsA2基因提高的酶活力为glsA1的1.36倍。由此可知:glsA2基因在重组菌株中能够表达谷氨酰胺酶活性,但其酶活力较原菌株具体提高多少仍需通过双交换置换等方式验证。实验采用单交换整合的方式将glsA2基因整合入枯草芽孢杆菌BJ3-2染色体上,同时质粒上的抗性基因及其他片段也随之整合入染色体上,因此该菌株不能直接用于食品(豆豉)发酵。
[1] HONG H A, HUANG J M, KHANEJA R, et al. The safety of Bacillus subtilis and Bacillus indicus as food probiotics[J]. Journal of Applied Microbiology, 2008, 105: 510-520.
[2] 董晨, 曹娟, 张迹, 等. 耐高温α-淀粉酶基因在枯草芽孢杆菌中的高效表达[J]. 应用与环境生物学报, 2008, 14(4): 534-538.
[3] ULF B, MARION W, THORSTEN E. Versatile expression and secretion vectors for Bacillus subtilis[J]. Current Microbiology, 2006, 52(2): 143-148.
[4] 邹立扣, 王红宁, 潘欣. 枯草芽孢杆菌整合载体研究进展[J]. 生物技术通讯, 2003, 14(6): 525-527.
[5] 贾东旭, 吴拥军, 李耀中, 等. 细菌型豆豉发酵芽孢杆菌的筛选与鉴定[J]. 食品科学, 2009, 30(5): 217-221.
[6] 詹寿年, 吴拥军, 郭倩倩, 等. 高活性谷氨酰胺酶豆豉芽孢杆菌的筛选及glsA基因的克隆[J]. 贵州农业科学, 2011, 39(6): 119-122.
[7] 朱芳, 邓思, 罗立新. 分选酶A在pET32a(+)原核表达载体中的表达和鉴定[J]. 生物技术通报, 2011(6): 219-222.
[8] 闻洁君, 江文正, 郝文丽, 等. HIV-1nef基因的克隆及原核表达研究[J]. 细胞与分子免疫学杂志, 2010, 26(4): 348-350.
[9] PARK H W, GE Baoxue, BAUER L S, et al. Optimization of Cry3A yields in Bacillus thuringiensis by use of sporulation-dependent promoters in combination with the STAB-SD mRNA sequence[J]. Applied and Environmental Microbiology, 1998, 64(10): 3932-3938.
[10] 张晓慧. 海藻糖改善枯草芽孢杆菌电转化方法的研究[D]. 南京: 南京农业大学, 2010.
[11] YANG Mingming, ZHANG Weiwei, BAI Xiaoting, et al. Electroporation is a feasible method to introduce circularized or linearized DNA into B. subtilis chromosome[J]. Molecular Biology Reports, 2010, 37: 2207-2213.
[12] 刘萍, 夏立秋, 胡胜标, 等. 外源基因在苏云金杆菌染色体上的定点整合及表达[J]. 微生物学报, 48(5): 661-666.
[13] 石爱琴. 分子伴侣对枯草芽孢杆菌表达pga的影响以及pga的整合表达[D]. 杭州: 浙江理工大学, 2009.
[14] 邹立扣, 王红宁, 潘欣. 枯草芽孢杆菌整合载体研究进展[J]. 生物技术通讯, 2003, 14(6): 525-527.
[15] 侯化鹏. 枯草芽孢杆菌中性蛋白酶nprE的定向进化研究[D]. 武汉:华中农业大学, 2008.
[16] 夏雨成, 玉梁, 李达倩, 等. 枯草芽孢杆菌分泌载体构建及其对脂肪酶A的分泌表达[J]. 安徽农业科学, 2011, 39(30): 18435-18437.
[17] 刘大伟, 王正祥. PspA外源表达对枯草芽孢杆菌168蛋白质分泌的影响[J]. 天然产物研究与开发, 2008(20): 855-858.
[18] 唐恒明, 刘先凯, 高美琴, 等. 炭疽芽孢杆菌假想S-层蛋白SLP 缺失突变体的构建[J]. 生物技术通讯, 2009, 20(2): 161-165.
[19] 喻江, 范国权, 李璐, 等. 枯草芽孢杆菌224 YPIQ基因敲除及其对溶血性的影响[J]. 东北农业大学学报, 2010, 41(7): 74-78.
[20] 薛可, 李峰, 罗光彬, 等. 利用Red同源重组系统进行牛β-酪蛋白基因敲除[J]. 遗传, 2007, 29(5): 570-574.
Targeted Integration of Glutaminase Gene glsA2with High Activity into the Bacillus subtilis BJ3-2 Chromosome
LU Biao, WU Yong-jun*, LIU Yan-min, WANG Ya-juan, TANG Xue
(College of Life Science, Guizhou University, Guiyang 550025, China)
With glsA1in BJ3-2 as the homologous sequence, glutaminase gene glsA2with high activity was targeted and integrated into the Bacillus subtilis BJ3-2 chromosome by constructing a single-exchange integrative vector. A recombinant strain BJ3-2A2was obtained with good genetic stability. The results of detection showed that glutaminase activity in the recombinant strain was 3.36 times higher than that in the original strain BJ3-2. The amino acid contents in douchi fermented with BJ3-2A2and the original BJ3-2 were measured, and the results showed that glutamate content in fermentation products from the recombinant strain was increased by 12.8% as compared to that observed with the original strain. All the analyses show that B. subtilis BJ3-2 is transformable as a RecE+strain and that glutaminase gene glsA2can be highly expressed in the BJ3-2 chromosome, thus improving the flavour of douchi.
Bacillus subtilis; homologous recombinant; single-exchange; glutaminase-encoding gene
Q939.97
A
1002-6630(2014)01-0141-04
10.7506/spkx1002-6630-201401027
2012-12-20
国家自然科学基金项目(31260394);贵阳市科技计划项目(筑科工合同字[2010]第1-68号);贵州省科技重大专项(黔科合重大专项字[2013]6013号)
卢彪(1987—),男,硕士研究生,研究方向为应用微生物。E-mail:liaoyuan612@163.com
*通信作者:吴拥军(1971—),男,教授,博士,研究方向为食品生物技术。E-mail:wyjbio@163.com
