利用微卫星标记分析酿酒酵母的遗传多样性
2014-01-17张留燕黄英子刘延琳
张留燕,黄英子,刘延琳,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程中心,陕西 杨凌 712100)
利用微卫星标记分析酿酒酵母的遗传多样性
张留燕1,黄英子1,刘延琳1,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程中心,陕西 杨凌 712100)
为研究本土酿酒酵母的种内多态性,以及本土野生酵母与商业酵母之间的差异性,本实验采用4个微卫星标记(ScAAT1、YOR267C、C11、YPL009C)分析18株商业酵母和28株陕西泾阳分离的野生酿酒酵母的遗传多样性,利用PopGen32进行遗传参数的分析。结果表明:4个位点共检测出66个等位基因,每个位点等位基因数为16~18个;平均多态信息含量0.862 3,均为高多态位点;46株菌表现出39种基因型,分辨率为98.94%;观测杂合度0.478 3~0.658 5。野生酵母和商业酵母均具有丰富的遗传多样性,两个群体各具有自己独特的等位基因,且两者在聚类图中有较清晰的界线。
微卫星;商业酵母;本土酿酒酵母;遗传多样性
酿酒酵母是葡萄酒酿造中起最主要作用的微生物。它不仅决定葡萄醪发酵的成败,而且对葡萄酒最终产品的产量、质量及产品特色的形成都起到至关重要的作用。酿酒酵母的多样性和独特性,对葡萄酒的感官特性有重要贡献[1]。采用分子技术对酿酒酵母进行分类鉴定及多样性研究是开发和利用酵母菌资源的基础,是选育优良酿酒酵母菌种的基础和关键。
微卫星是DNA短串联重复序列(1~6个碱基重复),表现出重复次数的变异,这些序列广泛存在于真核生物、原核生物[2]和病毒[3]基因组中。微卫星表现出相同物种的个体之间实质水平的多态性,广泛用于父权否定测试[4]、法医学[5]和不同真核生物的分子分型,如葡萄品种[6]和病原酵母(Candida albicans)[7]等。微卫星标记具有保守性好、高度多态、共显性遗传等优点,经常在遗传图谱或群体遗传的研究中用做遗传标记[8]。
Perez等[9]在酿酒酵母的基因组DNA数据库中搜索二核苷酸和三核苷酸串联重复,从中选取10个位点进行分析,证明微卫星是一个分析酿酒酵母种群基因组的强大且灵活的工具。进而几位作者提出用于酿酒酵母分型的微卫星位点组合[9-12]。多个研究表明,与随机扩增多态性DNA标记(random amplified polymorphic DNA,RAPD)、限制片段长度多态性(restriction fragment length polymorphism,RFLP)、Interdelta等相比,微卫星表现出较优的分型效果[13-15]。采用微卫星标记对酿酒酵母的分布和种群结构塑造中地理、生态以及人类所发挥的作用进行研究的报道也越来越多[16-18]。目前采用微卫星标记对我国酿酒酵母的研究极其缺乏,本实验采用4个微卫星位点对28株本土野生酵母和18株商业酵母进行基因分型,分析其遗传多样性,并对野生酵母和商业酵母两个群体表现出来的差异进行讨论,为研究我国酵母资源多样性及酵母选育奠定理论基础。
1 材料与方法
1.1 菌株与引物
1.1.1 供试菌株
供试菌株包括商业酵母18株(BDX、CLIB2047、T306、R-HST、K1、Lalvin、Syrah、RA17、71B、W15、GRE、QA23、D47,法国Lallemand公司;F10、X16、VL1,法国Lafford公司;XR,法国Lamothe-Abiet公司;DSM,德国微生物菌种保藏中心)和2009年陕西泾阳小白玫瑰葡萄发酵过程中分离的本土酿酒酵母28株(02y14、111y3、111y9、112y1、112y4、112y14、14w11、14w14、 173y1、173y4、173y7、173y8、173y10、173y15、174y1、174y5、174y15、181y1、181y2、181y3、181y4、181y6、181y10、182y5、182y12、23w12、23w13、23w15)。
1.1.2 微卫星引物
本实验所采用的4个微卫星位点信息见表1。

表1 微卫星引物位点基本信息Table 1 Characteristics of four microsatellite loci tested in this study
1.2 方法
1.2.1 基因组DNA提取
将菌株在YPD培养基上培养48 h后,采用石英砂破壁法提取DNA[21]。
1.2.2 基因组DNA的PCR扩增
PCR反应体系:总体积25μL,包含10mmol/L Tris-HCl,50mmol/L KCl,1.5mmol/L MgCl2,200μmol/L dNTP,0.5μmol/L引物,1.25U Taq DNA聚合酶,模板DNA 10~250 ng。
PCR扩增程序为:95℃、4 min;94℃、30 s,53℃、30 s,68℃、1 min,34个循环;68℃、10 min。
1.2.3 PCR产物检测及分析
PCR产物经2%琼脂糖凝胶电泳确认后,使用ABI 3730DNA测序仪以GeneScan ROX500作为内标进行毛细管电泳,GeneMapper v3.2分析PCR扩增产物大小。小数部分采取四舍五入的处理方法,在比较菌株的微卫星基因型计算等位基因时,1核苷酸的差异不被认为是不同的[22]。根据每个个体的条带确定基因型,利用PopGen32软件[23]统计微卫星基因座的等位基因数(number of alleles,Na)、等位基因频率(frenquencies of alleles,Fa)、有效等位基因数(effective number of alleles,Ne)、观测杂合度(observed heterozygosity,Ho)、期望杂合度(expected heterozygosity,He)、遗传分化系数(coefficient of genetic differentiation,Fst)等。用NTsys软件构建基于每对菌株的Jaccard相似性系数的非加权算术平均数(unw eighted pair group method with arithmetic mean,UPGMA)系统发育树。
2 结果与分析
2.1 微卫星多态性和遗传多态性
46株酿酒酵母ScAAT1、YOR267C、C11、YPL009C 4个微卫星位点分型共检测到66个等位基因,在S288C基因组中拥有最长的TAA基元的ScAAT1,表现出最高的等位基因多样性,检测到18个等位基因。YOR267C、C11和YPL009C表现出稍微低一点的遗传多态性,均有16个等 位基因。如果考虑较小和较大等位基因之间大小的差异,YOR267C有最显著的188 bp的差异,这与前人研究相同[19]。ScATT1、YOR267C和C11最大和最小等位基因相差分别83、64、44 bp。野生酵母菌株111y9在ScAAT1和YPL009C两个位点均未检测到条带,还有4株菌(174y15、181y2、181y4、181y6)在YPL009c位点未检测到目的带。4个位点的基因型数目分别为21、19、23、18种,46株菌共表现出39种基因型,分辨率[24]为98.94%。
ScAAT1、YOR267C、C11、YPL009C 4个位点多态信息含量分别为0.860 2、0.869 3、0.852 9、0.866 7。依PIC判断标准[25]:PIC<0.25为低度多态,0.25≤PIC<0.5为中度多态,PIC≥0.5为高度多态,故4个位点均为高多态位点。
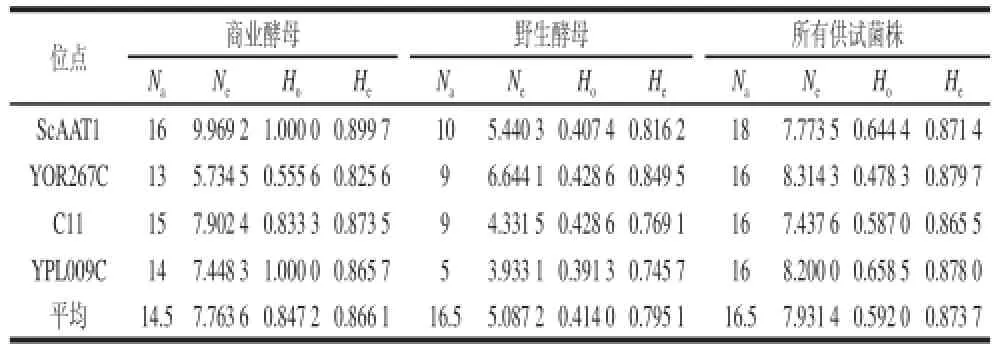
表2 46个供试菌株的多样性分析结果Table 2 Statistical analysis for genetic diversity of 46 S. cereviase strains
如表2所示,商业酵母中,ScAAT1和YPL0 09C两个位点杂合率高,YOR267C位点杂合率最低。野生酵母中,4个位点杂合度差异较小,与商业酵母相反,YOR267C和C11表现出杂合率稍高于另两个位点,除C11外,3个位点的杂合度均高于Legras中[19]报道的杂合度。杂合度反应群体的遗传一致性,杂合度越高,群体的遗传一致性就越低,其遗传多样性越高,由此说明我国本土酵母包含遗传信息的丰富程度较好。将所有菌株进行整体分析,ScAAT1和YPL009C两个位点杂合率较高,4个位点平均杂合率为0.592 0。

图1 商业酵母和野生酵母4个微卫星位点的等位基因及等位基因频率Fig.1 Alleles of four microsatellite loci and their frequencies in S. cerevisiae from commercial wine strains and indigenous yeasts
如图1所示,每个位点均出现商业酵母和野生酵母群体特有的等位基因,商业酵母的特有等位基因较多,7~11个;野生酵母特有等位基因很少,1~3个。每个位点片段最小的一个等位基因均为商业酵母特有。如将等位基因横轴从中分为两部分,除二核苷酸重复C11位点外,野生酵母的等位基因倾向于出现在较大片段区;YOR267C和YPL009C位点商业酵母的特有等位基因倾向于分布在较小片段区域,ScAAT1位点较小片段区和较大片段区商业酵母特有基因数相等。等位基因频率范围从0.028~0.393。每个位点均出现有在商业酵母和野生酵母中表现差异较大的等位基因。每个位点每个群体中的等位基因分布不呈现明显的规律,商业酵母YOR267C位点286 bp表现出较强的优势,其他位点没有主导的等位基因。
商 业酵母群体与野生酵母群体的遗传距离无偏估计为0.828 3,遗传一致性无偏估计[26]较低,为0.436 8,表明商业酵母与野生酵母两者之间的遗传差异明显。4个位点的Fst值分别为0.025 8、0.047 3、0.066 3、0.091 2,较小,说明群体内部多样性较高。
2.2 菌株的聚类分析
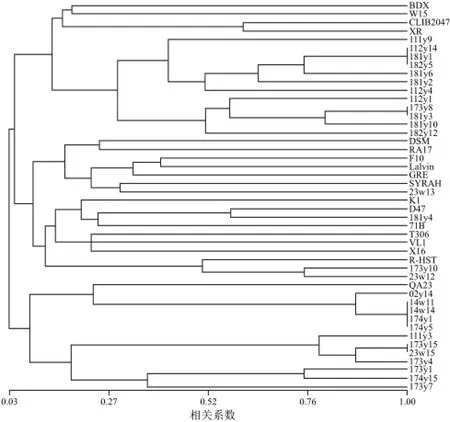
图2 46株酿酒酵母菌的UPMGA聚类图Fig.2 UPMGA dendrograms showinggenetic relationships among 46 yeast strains
运用NTsys进行采用UPMGA的遗传多样性分析,可将菌株划分为3个群体如图2所示。第一类12株野生酵母和1株来源于波尔多地区的商业酵母QA23,其中,173y1、174y15、173y73株菌具有相同的Interdelta基因型,微卫星基因型不同而得以区分,三者的亲缘关系较近。第二类包括13株商业酵母和4株野生酵母,多数商业酵母和野生酵母与其同类聚在一起,有趣的是,181y4与来源于法国的D47关系较近,23w12、173y10与来源于奥地利的R-HST关系较近,23w12、173y10具有相同的Interdelta基因型B,且有3个微卫星位点的基因型相同。第三类包括4株商业酵母和12株野生酵母,两者有清晰的界线,分为2支,12株野生酵母中有5株Interdelta基因型相同为M[27],4株Interdelta基因型相同为J,说明Interdelta基因型相同的菌株的微卫星聚类亲缘关系也较近。
3 讨 论
一些菌株在一个位点出现2个条带,可以认定这些菌株在这个位点是二倍体且是杂合的。当一个菌株在所有位点都表现出一条带时,那么这个菌株的倍性不能被确定。26株野生酵母中有10株4个位点中至少有一个是杂合的。本实验所采用的微卫星标记与前人研究报道中的等位基因数的差别主要是由于研究群体的不同而引起的[20,28]。14w11、14w14、174y1、174y5这4株菌表现出相同的基因型;还有菌株112y14、181y1、182y5的基因型相同;菌株173y8和181y3的基因型相同;菌株23w15和173y15基因型相同。这些基因型相同的菌株,可能是同一株菌,也有可能是所选用的4个位点不足以将其区分开,需要进一步分析。然而这些菌株中有些菌株的Interdelta基因型不同,一些能被Interdelta PCR鉴别的菌株的微卫星基因型却不能被区分开,这在前人的研究中也有报道[29]。
野生酵母的特有等位基因较少,原因可能为本实验中的酵母来源于同一产区同一葡萄品种的发酵过程,如果将野生酵母菌株扩大到不同产区不同葡萄品种,应该能得到更丰富的遗传多态性。商业酵母来源较为广泛,表现出遗传多样性较丰富。对特有等位基因的分析可以认为,商业酵母特有等位基因倾向于较小的片段,野生酵母的特有等位基因倾向于较大的片段。
本研究表明ScAAT1、YOR267C、C11、YPL009C 4个微卫星位点多态性高,可作为酿酒酵母遗传多样性的有效遗传标记。46株酿酒酵母菌共检测出66个等位基因,39种基因型,商业酵母和本土酵母遗传多样性丰富,并具有明显差异。本研究为酿酒酵母的多样性研究及优良菌株选育奠定了基础。
[1] CIANI M, MANNAZZU I, MARINANGELI P, et al. Contribution of winery-resident Saccharomyces cerevisiae strains to spontaneous grape must fermentation[J]. Antonie van Leeuwenhoek, 2004, 85(2): 159-164.
[2] FIELD D, WILLS C. Abundant microsatellite polymorphism in Saccharomyces cerevisiae, and the different distribution in eight prokaryotes and S. cerevisiae, result from strong mutation pressures and a variety of selective forces[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(4): 1647-1652.
[3] SREENU V B, RANJITKUMAR G, SWAMINATHAN S, et al. MICAS: a fully automated web server for microsatellite extraction and analysis from prokaryote and viral genomic sequences[J]. Applied Bioinformatics, 2003, 2(3): 165-168.
[4] HELMINEN P, LOKKI M L, EHNHOLM C, et al. Application of DNA “fingerprints” to paternity determinations[J]. Lancet, 1988, 331(8585): 574-576.
[5] HAGELBERG E, GRAY I C, JEFFREYS A J. Identification of the skeletal remains of a murder victim by DNA analysis[J]. Nature, 1991, 352: 427-429.
[6] THIS P, JUNG A, BOCCACCI P, et al. Development of a standard set of microsatellite reference alleles for identi cation of grape cultivars[J]. Theoretical and Applied Genetics, 2004, 109: 1448-1458.
[7] BOTTEREL F, DESTERKE C, COSTA C, et al. Analysis of microsatellite markers of Candida albicans used for rapid typing[J]. Journal of Clinical Microbiology, 2001, 39: 4076-4081.
[8] WEISSENBACH J, GYAPAY G, DIB C, et al. A second-generation linkage map of the human genome[J]. Nature, 1992, 359: 794-801.
[9] PEREZ M A, GALLEGO F J, MARTINEZ I, et al. Detection, distribution and selection of microsatellites (SSRs) in the genome of the yeast Saccharomyces cerevisiae as molecular markers[J]. Letters in Applied Microbiology, 2001, 33: 461-466.
[10] GALLEGO F J, PEREZ M A, MARTINEZ I, et al. Microsatellites obtained from database sequences are useful to characterize Saccharomyces cerevisiae strains[J]. American Journal of Enology and Viticulture, 1998, 49: 350-351.
[11] HENNEQUIN C, THIERRY A, RICHARD G F, et al. Microsatellite typing as a new tool for identification of Saccharomyces cerevisiae strains[J]. Journal of Clinical Microbiology, 2001, 39: 551-559.
[12] GONZALEZ T A, JUBANY S, CARRAU F M, et al. Differentiation of industrial wine yeast strains using microsatellite markers[J]. Letters in Applied Microbiology, 2001, 33: 71-75.
[13] SCHULLER D, VALERO E, DEQUIN S, et al. Survey of molecular methods for the typing of wine yeast strains[J]. FEMS Microbiology Letters, 2004, 231(1): 19-26.
[14] POSTERARO B, SANGUINETTI M, ROMANO L, et al. Molecular tools for differentiating probiotic and clinical strains of Saccharomyces cerevisiae[J]. International Jounal of Food Microbiology, 2005, 103(3): 295-304.
[15] OLIVEIRA V A, VICENTE M A, FIETTO L G, et al. Biochemical and molecular characterization of Saccharomyces cerevisiae strains obtained from sugar-cane juice fermentations and their impact in Cachaca production[J]. Applied and Environmental Microbiology, 2008, 74(3): 693-701.
[16] LEGRAS J L, MERDINOGLU D, CORNUET J M, et al. Bread, beer and wine: Saccharomyces cerevisiae diversity reflects human history[J]. Molecular Ecology, 2007, 16: 2091-2102.
[17] GODDARD M R, ANFANG N, TANG R Y, et al. A distinct population of Saccharomyces cerevisiae in New Zealand: evidence for local dispersal by insects and human-aided global dispersal in oak barrels[J]. Environmental Microbiology, 2010, 12(1): 63-73.
[18] ZHANG H Y, LEE S A, BRADBURY J E, et al. Yeasts isolated from New Zealand vineyards and wineries[J]. Australian Journal of Grape and Wine Research, 2010, 16(3): 491-496.
[19] LEGRAS J L, RUH O, MERDINOGLU D, et al. Selection of hypervariable microsatellite loci for the characterization of Saccharomyces cerevisiae strains[J]. International Journal of Food Microbiology, 2005, 102: 73-83.
[20] JUBANY S, TOMASCO I, de LEON I P, et al. Toward a global database for the molecular typing of Saccharomyces cerevisiae strains[J]. FEMS Yeast Research, 2008, 8: 472-484.
[21] 周小玲, 沈微, 饶志明, 等. 一种快速提取真菌染色体DNA的方法[J]. 微生物学通报, 2004(4): 89-92.
[22] RICHARDS K D, GODDARD M R, GARDNER R C. A database of microsatellite genotypes for Saccharomyces cerevisiae[J]. Antonie van Leeuwenhoek, 2009, 96: 355-359.
[23] YEH F C, YANG R C, BOYLE T. POPGENE, the user-friendly shareware for population genetic analysis[DB/OL]. Canada: Molecular Biology and Biotechnology Centre, University of Alberta, 1997[2013-01-10]. http://www.ualberta.ca/~fyeh/.
[24] HUNTER P R. Reproducibility and indices of discriminatory power of microbial typing methods[J]. Journal of Clinical Microbiology, 1990, 28: 1903-1905.
[25] BOTSTEIN D, WHITE R L, SKOLNICK M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. American Journal of Human Genetics, 1980, 32(3): 314-331.
[26] NEI M. Estimation of average heterozygosity and genetic distance from a small number of individuals[J]. Genetics, 1978, 89(3): 583-590.
[27] 张静. 自然发酵和接种发酵的酵母菌群生态研究及对葡萄酒质量的影响[D]. 杨凌: 西北农林科技大学, 2010.
[28] 冯敏, 王春晓, 刘延琳. 利用微卫星多态性揭示酿酒酵母菌株遗传多样性[J]. 中国农业科学, 2012, 45(12): 2537-2543.
[29] AYOUB M J, LEGRAS J L, SALIBA R, et al. Application of multilocus sequence typing to the analysis of the biodiversity of indigenous Saccharomyces cerevisiae wine yeasts from Lebanon[J]. Journal of Applied Microbiology, 2006, 100: 699-711.
Genetic Diversity Analysis of Saccharomyces cerevisiae Strains by Microsatellite Marker Technique
ZHANG Liu-yan1, HUANG Ying-zi1, LIU Yan-lin1,2,*
(1. College of Enology, Northwest A&F University, Yangling 712100, China; 2. Shaanxi Engineering Research Center for Viti-viniculture, Yangling 712100, China)
In order to analy ze the genetic diversity of indigenous wine yeasts and the differences between indigenous isolates and commercial wine yeast strains, genetic variability of 28 isolates from Jingyang, Shaanxi Province and 18 commercial strains was analyzed using four microsatellite markers (ScAAT1, YOR267C, C11 and YPL009C). Meanwhile, genetic parameter s were also analyzed by PopGen32. Forty-six strains were amplified by four microsatellite prime pairs, and generated a total of 66 polymorphic bands with 16–18 alleles for each locus. The average polymorphism information content (PIC) of all strains at four loci was 0.862 3, suggesting that all the four SSR loci were hypervariable. Forty-six strains gave 39 different patterns with a discriminatory power of 98.94%. The heterozygosity was observed as 0.478 3–0.658 5. These results indicate that indigenous wine yeasts and commercial yeasts have high levels of genetic diversity, and both have unique alleles. Both kinds of strains have clear clustering boundary in the phylogentic tree.
microsatellite; commercial yeasts; indigenous wine yeast; genetic diversity
Q93.331
A
1002-6630(2014)01-0130-04
10.7506/spkx1002-6630-201401025
2013-01-22
国家自然科学基金项目(31271917);西北农林科技大学基本科研业务费项目(22050205);国家现代农业(葡萄)产业技术体系建设专项(CARS-30-jg-3)
张留燕(1988—),女,硕士研究生,研究方向为酿酒微生物。E-mail:forever7365@163.com
*通信作者:刘延琳(1966—),女,教授,博士,研究方向为葡萄、葡萄酒及酿酒微生物。E-mail:yanlinliu@nwsuaf.edu.cn
