普鲁兰多糖-明胶可食性膜的特性
2014-01-17高丹丹徐学玲江连洲赵晓燕
高丹丹,徐学玲,江连洲,张 超,马 越,赵晓燕
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.北京市农林科学院蔬菜研究中心,北京 100097)
普鲁兰多糖-明胶可食性膜的特性
高丹丹1,徐学玲2,江连洲1,张 超2,马 越2,赵晓燕2
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.北京市农林科学院蔬菜研究中心,北京 100097)
为了提高可食性膜的透明度和阻隔性,制备一种速溶的普鲁兰多糖-明胶可食性膜。将普鲁兰多糖添加到明胶膜中,普鲁兰多糖和明胶的添加质量比为2∶5(PG2)。在此配比下,普鲁兰多糖-明胶可食性膜的抗拉强度是明胶可食性膜的120%,氧气透过率是明胶可食性膜的1/13。可食性膜PG2中普鲁兰多糖和明胶分子间具有较强的氢键作用,并且此时可食性膜具有较好的相容性,因此使可食性膜PG2抗拉强度增强和氧气透过率降低。可食性膜PG2具有较低的氧气透过率(0.15 mL/(m2•d))、较高的抗拉强度(97.21 MPa)和溶水时间(29.5 s),而且具有不透油和低水蒸气透过率(109.08 g/(m2•d))的性质,因此,可食性膜PG2是适合应用于可食性内包装的材料。
普鲁兰多糖;明胶;可食性膜;氧气透过率;抗拉强度
Caroline等[1]制备的明胶可食性膜和Li等[2]制备的魔芋葡甘聚糖-明胶可食性膜研究结果表明:明胶可食性膜机械性能较高、价格低廉,但是其阻隔性能和透明度较差。Tong等[3]制备的普鲁兰多糖-海藻酸钠-羧甲基纤维素复合膜和Mahamadou等[4]制备的乳清分离蛋白-普鲁兰多糖复合膜研究结果表明,普鲁兰多糖可食性膜透明度高、阻油、阻氧性好,但是单一成分的普鲁兰多糖可食性膜的机械性能较差。为了同时保证可食性膜具有较高的机械性能、阻隔性和水溶性,本实验在明胶可食性膜中添加普鲁兰多糖,复合之后在不影响可食性膜机械性能和水溶性的同时,提高了可食性膜的透明度和阻隔性,复合之后的可食性膜的综合性能高于以上各种可食性膜,提高了可食性膜的适用性,为可食性膜的工业化生产提供实验数据。
1 材料与方法
1.1 材料与试剂
普鲁兰多糖 天津实发中科百奥工业生物技术公司;明胶 沧州市金箭明胶有限公司;甘油 北京化工厂;金龙鱼大豆油 山东莱阳鲁花浓香花生油有限公司。
1.2 仪器与设备
CHY-C2测厚仪 中国Labthink公司;DZKW-4型电子恒温水浴锅 中国中兴伟业仪器有限公司;RCT Basic Safety Control磁力搅拌器 德国IKA公司;TA·XT2i型物性测试仪 英国Stable Micro Systems公司;PERMA TRAN-W Model 1/50 G水蒸气透过率测试仪、OX-TRAN Model 2/21 MD氧气透过率测试仪 美国Mocon公司; Nicolet 6700型傅里叶变换红外光谱仪 美国Thermo公司;Incucell型生化培养箱 德国Mmm公司;D8 Advance 型X射线衍射仪 德国Bruker公司;AR1500型流变仪 美国TA公司;Nano Scope IIIa原子力显微镜 美国Digital Instrument公司;S-4800型扫描电镜日本Hitachi公司。
1.3 方法
1.3.1 普鲁兰多糖-明胶可食性膜的制备
普鲁兰多糖溶解在25~30℃的蒸馏水中,明胶溶解在90℃的蒸馏水中,混合并冷却到25~30℃后添加甘油,甘油的添加量为普鲁兰多糖和明胶质量的20%,磁力搅拌10 min,在0.01~0.09 MPa真空脱气10 min。成膜溶液倾倒在聚丙乙烯培养皿中,置于通风橱中8~10 h室温成膜。制成普鲁兰多糖可食性膜、明胶可食性膜和普鲁兰多糖-明胶可食性膜。普鲁兰多糖和明胶的混合比例见表1,形成的可食性膜命名为PUL、PG1、PG2、PG3、PG4和GEL。揭膜后于40℃、53%相对湿度条件下平衡2 d后,取(40±3)μm厚度的样品膜进行可食性膜指标的测定。
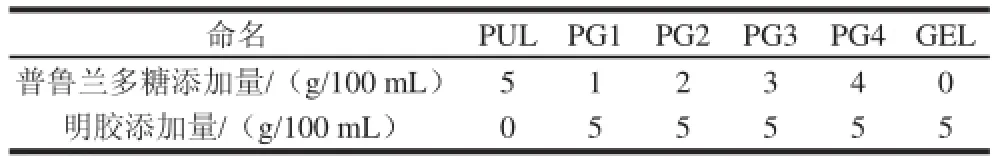
表1 普鲁兰多糖-明胶可食性膜的命名Table 1 Edible films with different ratios of pullulan to gelatin
1.3.2 可食性膜性质的测定
1.3.2.1 红外光谱测定
应用Nicolet 6700傅里叶变换红外光谱仪采集可食性膜的红外光谱图。采用ATR单反(Smart iTR ATR)附件,测定在波数650~4 000 cm-1的吸收光谱,分辨率4 cm-1,波数精度0.01 cm-1,扫描次数32次,环境温度25℃。以OMNIC 8.0软件分析采集的谱图。
1.3.2.2 X射线衍射测定
应用D8 Advance型X射线衍射仪采集可食性膜的X射线图。实验条件为25℃,X射线源为CuKα线,电压为40 kV,电流为40 mA,扫描角度6.00°~50.00°。
1.3.2.3 流变特性测定
应用AR1500型流变仪测定可食性膜液的表面黏度。实验条件为25℃,采用平板,剪切速率为0.1~100 s-1,应变为2%,裂缝为500 μm。
1.3.2.4 扫描电镜观察
应用扫描电子显微镜观察可食性膜的横截面,可食性膜样品以垂直方向用双面胶固定在样品台上,真空状态下镀金,电子束的加速电压为1.0 kV,对样品可食性膜横截面放大1 000倍进行观察。
1.3.3 可食性膜的相容性
应用原子力显微镜采集可食性膜表面的图片,考察可食性膜的相容性。可食性膜的相容性是两种或两种以上物质混合时,不产生相斥分离现象的能力。25℃条件下,采集10 μm范围可食性膜的表面图形。可食性膜表面的粗糙度采用SPM软件(v512r2)处理。
1.3.4 可食性膜厚度
根据GB/T 6672—2001《塑料薄膜和薄片厚度测定 机械测量法》[5],用测厚仪对每张可食性膜测定厚度,均匀取13个点(其中1点为通过可食性膜的中心点),以平均值作为可食性膜的厚度值。可食性膜厚度的测定是为可食性膜指标的测定提供依据。
1.3.5 可食性膜的抗拉强度
根据ASTM D 882—01方法[6]使用物性测试仪测定(TS),两个探头的初始间距设定为40 mm,拉引速率设定为1 mm/s,其计算参照公式(1)。

式中:TS为抗拉强度/MPa;F为实验样品可食性膜断裂时的最大拉力/N;S为实验样品可食性膜的横截面积/m2。
1.3.6 可食性膜的氧气透过率
根据ASTM D 3985—95方法[7],在23℃条件下应用氧气透过率测试仪进行测定。测试面积为50 cm2。吹扫气体和测试气体分别为高纯氮气(混有体积分数为2%的氢气)和氧气。
1.3.7 可食性膜的水蒸气透过率
根据ASTM F 1249—05方法[8],在23℃条件下应用水蒸气透过率测试仪进行测定。测试时使用的载气为高纯氮气,测试面积为5 cm2。可食性膜两侧相对湿度分别设定为50%和15%。
1.3.8 可食性膜的油脂透过率
根据谷宏等[9]的方法进行测定。于试管内装5 mL大豆油,用可食性膜样品封住试管口,再放一张预先称量的滤纸片,25℃条件下倒置放于相对湿度53%的干燥器中。一周后记录滤纸片的质量。油脂透过率的计算参照公式(2)。

式中:P0为油脂透过率/(g/(m2·d));Δm为滤纸片称量前后的质量变化/g;h为可食性膜厚度/mm;S为试管口面积/m2;t为测试时间/d。
1.3.9 可食性膜的水溶性
取剪裁成2 cm×2 cm规格的可食性膜样品,置于盛满90℃水的烧杯中,能发现可食性膜先收缩然后呈很多细小的颗粒状分散于水中,一段时间后阳光下观察水中颗粒状消失为本实验溶水时间的终点,记录样品溶解的秒数。
1.4 数据分析与统计
利用DPS v7.05统计软件对数据进行差异显著性分析和软件Origin7.5作图。
2 结果与分析
2.1 可食性膜的结构特征
2.1.1 红外光谱分析

图1 可食性膜的红外光谱Fig.1 Fourier transform infrared spectra of edible films
红外光谱反映出可食性膜原料之间分子间的相互作用,普鲁兰多糖和明胶分子之间的相互作用会直接影响可食性膜的性能[10-11]。所有可食性膜在3 303 cm-1和2 925 cm-1处的吸收带是-OH和甲基中的C-H的伸缩振动[12]。由图1可知,可食性膜PG2在3 303 cm-1处的吸收峰变宽并且比PUL和GEL峰强度更大,表明普鲁兰多糖和明胶分子间的氢键加强了[11]。在1 646 cm-1处的吸收峰是C-O连着的-OH的伸缩振动[13]。PUL和GEL分别出现在1 649 cm-1和1 624 cm-1处的吸收峰没有出现在复合组分的可食性膜中,但是PG4、PG3、PG2和PG1在1 643、1 637、1 634、1 632 cm-1出现了类似的峰。这个现象表明普鲁兰多糖和明胶之间产生了相互作用。PUL在1 076 cm-1处的吸收峰是C6连着的-OH伸缩振动,GEL在1 030 cm-1处的吸收峰是C-O-C的伸缩振动[14]。与之相比,PG4、PG3、PG2、PG1在1 081 cm-1和1 030 cm-1处的吸收峰降低到了一个较低的波数,表明普鲁兰多糖和明胶之间存在分子间氢键的相互作用。氢键作用的产生,是可食性膜机械性能和阻隔性能增强的主要原因[10-11]。
2.1.2 X射线衍射分析

图2 可食性膜的X射线衍射图Fig.2 X-ray diffraction profiles of edible films
由图2可知,6种样品可食性膜在20.5°处有一个衍射峰。GEL在7.6°处有一个显著的衍射峰,这是因为存在少量棒状的胶原蛋白三螺旋结构[15],其他4种可食性膜成膜原料中也含有明胶,故在此处也有衍射峰,PUL中没有这种现象。PG2在7.6°附近显示出一个尖锐的衍射峰,这是因为普鲁兰多糖和明胶之间并非简单的机械混合,它们发生了分子间的相互作用,可能是激发了H•••O-N、OH•••O、C-H•••O[16]和C-H•••N[17]等氢键的形成,才会使PG2在7.6°处形成了半晶域。另外,PG2在7.6°附近的衍射峰比其他复合的可食性膜的峰都尖锐,这可能是因为PG2具有较强的氢键作用。
2.1.3 可食性膜的微观结构
可食性膜的微观结构反映了可食性膜的均一性和致密性,如果可食性膜具有较高的均一性和致密性,就能使可食性膜具有较高的抗拉强度[18]。可食性膜横截面的扫描电镜图见图3。从可食性膜横截面的形貌来看,PG3和PG4的横截面有一些细微的小孔,其他的可食性膜都具有紧密而均一的横截面形态,因此PG3和PG4的相容性低于PG2和PG1。另外,横截面上的横纹和鳞片状是人工切割和撕裂可食性膜截面造成的。

图3 可食性膜横截面的扫描电镜图(×1 0001 000)Fig.3 Cross-sectional morphologies of edible films under scanning electron micrograph (× 1 000)
为了筛选出相容性最佳的可食性膜,故做了可食性膜的原子力显微镜的观察。从原子力显微镜析出的结果显示PUL、GEL、PG1、PG2、PG3、PG4的粗糙度分别为1.727、0.676、4.347、2.160、11.349、13.275 nm。PG2的粗糙度低于PG4、PG3和PG1,因此筛选出可食性膜PG2具有较好的相容性。PG2较高的相容性是导致可食性膜较好的机械性能和阻隔性能的一部分原因。
2.2 可食性膜的特性
2.2.1 流变学特性
表面黏度与材料的内部结构有关。由图4可知,可食性膜的表面黏度显示出剪切稀化的行为,故可以认为可食性膜液都为非牛顿流体[19]。剪切速率从0增加到3.594 s-1时,PG1~PG4的表面黏度高于PUL和GEL,这是因为普鲁兰多糖和明胶分子之间发生了协同效应,这种协同作用可能是由于普鲁兰多糖和明胶分子之间形成了氢键和其他相互作用力导致的。剪切速率从3.594 s-1增加到100 s-1时,PG2的表面黏度介于PUL和GEL之间,这是因为随着剪切速率进一步增加,会破坏普鲁兰多糖和明胶分子之间形成的氢键和相互作用力。因此,流变学的分析验证了普鲁兰多糖和明胶分子间氢键和相互作用的产生。
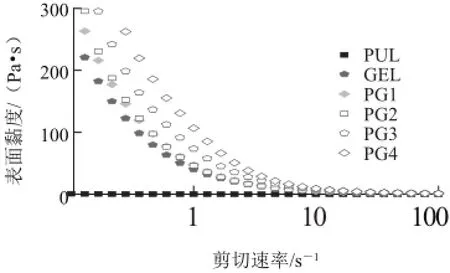
图4 可食性膜的表面黏度随剪切速率的变化Fig.4 Apparent viscosity versus shear rate plot for edible films
2.2.2 普鲁兰多糖的添加对可食性膜抗拉强度的影响

图5 普鲁兰多糖添加量对可食性膜抗拉强度的影响Fig.5 Effect of pullulan addition on the tensile strength of edible gelatin films
由图5可知,PG 1、PG2、PG3、PG4的抗拉强度高于PUL和GEL,其中PG2的抗拉强度最 大,为(97.21±10.39)MPa,是明胶可食性膜的120%,高于普鲁兰多糖-海藻酸钠-羧甲基纤维素可食性膜(67 MPa)[3],魔芋葡甘聚糖-壳聚糖-大豆分离蛋白可食性膜(51.07 MPa)[20],魔芋葡甘聚糖-明胶可食性膜(59.7 MPa)[2],也高于高分子聚合物膜,如聚氯乙烯膜(3.8 MPa)[21]、聚丙烯膜(30 MPa)[22]和低密度聚乙烯膜(9.4 MPa)[23]。
2.2.3 普鲁兰多糖的添加对可食性膜阻隔性能的影响
普鲁兰多糖添加量对可食性膜氧气透过率的影响见图6A,普鲁兰多糖的添加显著降低了明胶可食性膜的氧气透过率,PG2的氧气透过率最低,为0.15 mL/(m2•d),比普鲁兰多糖可食性膜低,是明胶可食性膜的1/13,这可能是因为PG2具有较强的分子间的相互作用和较好的相容性。PG2的氧气透过率显著低于使用纳米填充材料的醋酸纤维素可食性膜(350 mL/(m2•d))[24],乳清分离蛋白-普鲁兰多糖(304mL/(m2•d))[25],低密度聚乙烯(173.3mL/(m2•d))[26]和聚丙烯膜(2000mL/(m2•d))[27]。
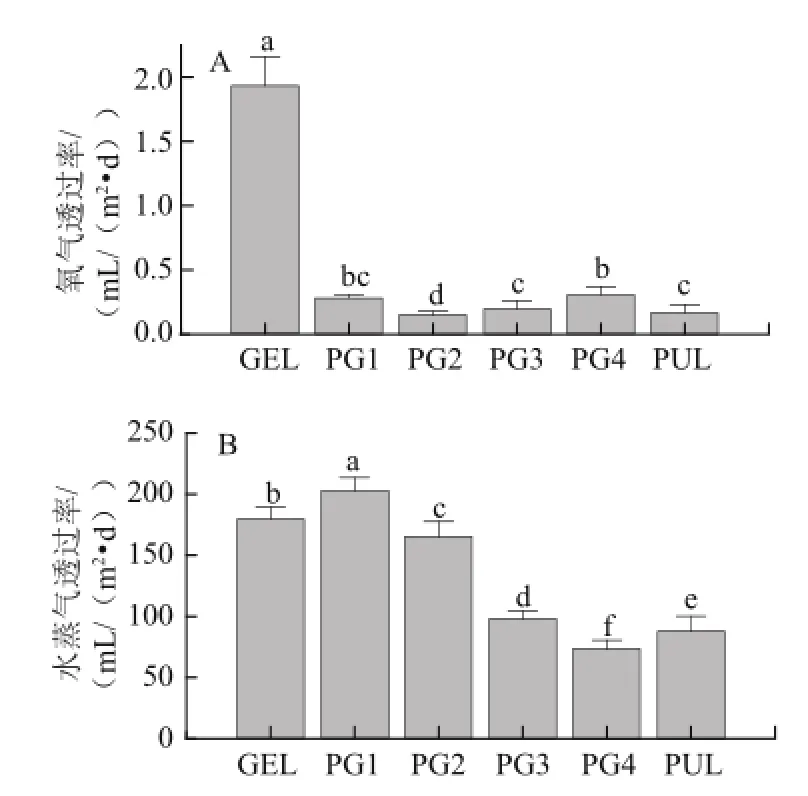
图6 普鲁兰多糖添加量对可食性膜阻隔性能的影响Fig.6 Effect of pullulan addition on the barrier properties of edible gelatin films
普鲁兰多糖添加量对明胶可食性膜水蒸气透过率的影响见图6B,普鲁兰多糖的添加使可食性膜PG2的水蒸气透过率降低,这可能是因为普鲁兰多糖的添加使可食性膜的相互作用力增强,因而结构更加致密,使其阻水性较好。PG2的水蒸气透过率为109.08 g/(m2•d),低于使用纳米填充材料的醋酸纤维素可食性膜(920 g/(m2•d))[24]、添加蜂蜡的大豆蛋白可食性膜(180 g/(m2•d))[28]和玻璃纸(717.12 g/(m2•d))[29]。
普鲁兰多糖可食性膜、明胶可食性膜和复合组分的可食性膜的油脂透过率未检出,这可能是由于普鲁兰多糖和明胶聚合物分子间具有强烈的相互作用和亲水性导致的。
2.2.4 可食 性膜的水溶性

图7 普鲁兰多糖添加量对可食性膜水溶性的影响Fig.7 Effect of pullulan addition on the water solubility of edible gelatin films
由图7可知,所有可食性膜都在65 s以内溶于90℃水中,一方面是由于成膜原料都为亲水性物质,另一方面甘油也亲水,使可食性膜样品更易扩散到水中。普鲁兰多糖的添加使明胶可食性膜的溶水时间增长,这可能是因为普鲁兰多糖的添加,使可食性膜的结构更加致密导致的。其中PG2的溶水时间为29.5 s,溶水时间越低越易溶解于水中,这个数值低于魔芋葡甘聚糖-明胶可食性膜(35 s)[2]和普鲁兰多糖-海藻酸钠-羧甲基纤维素可食性膜(111 s)[30]。
3 结 论
将普鲁兰多糖和明胶复合成膜,可食性膜PG2的抗拉强度是明胶可食性膜的120%,氧气透过率是明胶可食性膜的1/13。这是由于PG2具有较强的氢键作用,并且具有较好的相容性导致的。PG2还具有速溶和不透油的特性,是一种适合应用在速溶咖啡、方便面、奶粉、豆浆等食品的内包装材料。
[1] CAROLINE A, CARVALHO R, TOMAS G G. Effect of surfactants on the functional properties of gelatin-based edible films[J]. Journal of Food Engineering, 2011, 103: 129-136.
[2] LI B, KENNEDY J F, JIANG Q G, et al. Quick dissolvable, edible and heatsealable blend films based on konjac glucomannan-gelatin[J]. Food Research International, 2006, 39: 544-549.
[3] TONG Q Y, XIAO Q, LIM L T. Preparation and properties of pullulan-alginate-arboxymethylcellulose blend films[J]. Food Research International, 2008, 41: 1007-1014.
[4] MAHAMADOU E G, XU S Y, WANG Z. Whey protein isolate-based edible films as affected by protein concentration, glycerol ratio and pullulan addition in film formation[J]. Journal of Food Engineering, 2007, 83: 521-530.
[5] GB/T 6672—2001 塑料薄膜与薄片厚度的测定: 机械测量法[S].
[6] ASTM D 882-01. Annual book of ASTM standards[S]. Philadelphia, PA: American Society for Testing and Materials, 2002.
[7] ASTM D 3985-95. Oxygen gas transmission rate through plastic film and sheeting using a coulometric sensor[S]. Philadelphia, PA: American Society for Testing and Matericals, 1995.
[8] ASTM F 1249-05. Water vapor transmission rate through plastic film and sheeting using a modulated infrared sensor[S]. Philadelphia, PA: American Society for Testing and Matericals, 2005.
[9] 谷宏, 马涛, 赵增煜. 高直链玉米淀粉可食性膜的研制[J]. 包装工程, 2007, 28(5): 15-17.
[10] ABUGOCH JAMES L E, TAPIA C, VILLAM˘N M C, et al. Characterization of quinoa proteine-chitosan blend edible films[J]. Food Hydrocolloids, 2011, 25: 879-886.
[11] WOLF K L, SOBRAL P J A, TELIS V R N. Physicochemical characterization of collagen fibers and collagen powder for self-composite film production[J]. Food Hydrocolloids, 2009, 23: 1886-1894.
[12] 方禹之. 仪器分析[M]. 上海: 复旦大学出版社, 1990: 295-301.
[13] YE X, KENNEDY J F, LI B, et al. Condensed state structure and biocompatibility of the konjac glucomannan/chitosan blend films[J]. Carbohydrate Polymers, 2006, 64: 532-538.
[14] LI B, LI J, XIA J, et al. Effect of gamma irradiation on the condensed state structure and mechanical properties of konjac glucomannan/ chitosan blend films[J]. Carbohydrate Polymers, 2011, 83(1): 44-51.
[15] YAKIMETS I, PAES S S, WELLNER N, et al. Effect of water content on the structural reorganization and elastic properties of biopolymer lms: a comparative study[J]. Biomacromolecules, 2007, 8: 1710-1722.
[16] RAM¸REZ J, BRELOT L, OSINSKA I, et al. CH•••O hydrogen bond in the crystal structure of a pyrazine-based ligand and determination of the amplitude of the ligand conformational change induced by Cu(II) coordination[J]. Journal of Molecular Structure, 2009, 931: 20-24.
[17] KRISHNAMOHAN SHARMA C V, ROGERS R D. C-HX (X=N, O) hydrogen bond-mediated assembly of donors and acceptors: the crystal structures of phenazine complexes with 1,4-dinitrobenzene and TCNQ[J]. Crystal Engineering, 1998, 1(2): 139-145.
[18] ZHANG Chao, GUO Kuan, MA Yue, et al. Incorporations of blueberry extracts into soybean-protein-isolate film preserve qualities of packaged lard[J]. International Journal of Food Science and Technology, 2010, 45: 1801-1806.
[19] MURILLO-MART¸NEZ M M, PEDROZA-ISLAS R, LOBATOCALLEROS C, et al. Designing W1/O/W2 double emulsions stabilized by protein-polysaccharide complexes for producing edible lms: rheological, mechanical and water vapour properties[J]. Food Hydrocolloids, 2011, 25(4): 577-585.
[20] JIA D Y, FANG Y, YAO K. Water vapor barrier and mechanical properties of konjac glucomannan-chitosan-soy protein isolate edible films[J]. Food and Bioproducts Processing, 2009, 87: 7-10.
[21] BISHAY I K, ABD-EL-MESSIEH S L, MANSOUR S H. Electrical, mechanical and thermal properties of polyvinyl chloride composites lled with aluminum powder[J]. Materials and Design, 2011, 32: 62-68.
[22] HATTOTUWA G B, PREMALAL H, ISMAIL A B. Comparison of the mechanical properties of rice husk powder lled polypropylene composites with talc lled polypropylene composites[J]. Polymer Testing, 2002, 21: 833-839.
[23] LUYT A S, MOLEFI J A, KRUMP H. Thermal, mechanical and electrical properties of copper powder lled low-density and linear low-density polyethylene composites[J]. Polymer Degradation and Stability, 2006, 91: 1629-1636.
[24] RODR¸GUEZ F J, GALOTTO M J, GUARDA A, et al. Modification of cellulose acetate films using nanofillers based on organoclays[J]. Journal of Food Engineering, 2012, 110(2): 262-268.
[25] GOUNGA M E, XU S Y, WANG Z. Whey protein isolate-based edible films as affected by protein concentration, glycerol ratio and pullulan addition in film formation[J]. Journal of Food Engineering, 2007, 83(4): 521-530.
[26] PARK H J, BUNN J M, WELLER C L, et al. Water vapour permeability and mechanical properties of grain protein-based films as affected by mixtures of polyethylene glycol and glycerin plasticizers[J]. Transactions of the ASAE, 1994, 37: 1281-1285.
[27] FUNDA T, İSA D A, BANU Ö. Water vapor and oxygen-barrier performance of corn-zein coated polypropylene lms[J]. Journal of Food Engineering, 2010, 96: 342-347.
[28] 郭宽. 大豆蛋白膜制备工艺优化及膜性质的调控机理研究[D]. 天津: 天津科技大学, 2010.
[29] TOMÉA L C, GONÇALVESA C M B, BOAVENTURAB M, et al. Preparation and evaluation of the barrier properties of cellophane membranes modified with fatty acids[J]. Carbohydrate Polymers, 2011, 83(2): 836-842.
[30] 肖茜. 普鲁兰多糖可食用包装膜的制备与性能研究[D]. 无锡: 江南大学, 2008.
Properties of Pullulan-Gelatin Composite Films
GAO Dan-dan1, XU Xue-ling2, JIANG Lian-zhou1, ZHANG Chao2, MA Yue2, ZHAO Xiao-yan2
(1. College of Food Science, Northeast Agricultural University, Harbin 150030, China; 2. Vegetable Research Center, Beijing Academy of Agricultural and Forestry Sciences, Beijing 100097, China)
A quick dissolvable edible film was prepared with blends of pullulan and gelatin (GEL) showing improved transparency and barrier properties. Pullulan was added into gelatin film with a ratio of pullulan:GEL of 2:5 (m/m), forming a composite film named as PG2. The tensile strength of PG2 was 120% of GEL, and PG2 had an oxygen permeability one thirteenth as high as GEL. There was the strongest interaction of hydrogen bonds and the best compatibility between the molecules of pullulan and GEL in PG2, which could explain the improved tensile strength and the reduced oxygen permeability of PG2. PG2 provided low oxygen permeability (0.15 mL/(m2•d)), high tensile strength (97.21 MPa) and short dissolution time (29.5 s). Moreover, it was instant, oiltight and of low water-vapor permeability (109.08 g/(m2•d)). Thus, the prepared edible film of PG2 is suitable for application in edible inner packaging.
pullulan; gelatin; edible film; oxygen permeability; tensile strength
TS206
A
1002-6630(2014)01-0069-05
10.7506/spkx1002-6630-201401013
2012-09-12
北京市优秀人才培养资助项目(2010D002020000012)
高丹丹(1986—),女,硕士研究生,研究方向为粮食、油脂与植物蛋白工程。E-mail:Diana198691@126.com
