FAK、NF-κB及VEGF在非小细胞肺癌中的表达及临床意义
2014-01-17张柯晴吕坤聚朱君祥
张柯晴 吕坤聚 朱君祥
(中国人民解放军第401医院呼吸内科;1青岛大学医学院,山东266000)
肺癌是目前世界上对人类健康威胁最大的恶性肿瘤之一,全球每年约有135万人被确诊为肺癌,120万人死于肺癌[1]。虽然医学技术有了长足发展,但肺癌患者的5年存活率并未得到明显改善,仅为15%左右[1],其中非小细胞肺癌占肺癌总数的80%-85%[2]。其根本原因在于肺癌发病机制尚不明确,临床缺乏早期的诊断和治疗手段。20世纪90年代以来,信号传导通路逐渐成为肿瘤学领域研究的热点。本研究应用免疫组化的方法检测FAK、NF-κBp65及VEGF-C在NSCLC组织及癌旁正常组织中的表达情况,以期探讨三者与NSCLC分化程度、临床分期及淋巴结转移等的关系。
材料和方法
1.标本与资料
收集2012年12月至2013年12月解放军第四零一医院胸外科手术切除的NSCLC石蜡标本75例(标本要求:1.术前未进行过化疗和(或)放疗者;2.无合并其他器官原发性肿瘤者;3.组织块石蜡包埋充分)。在75例NSCLC标本中,鳞癌42例,腺癌33例;男性60例,女性15例;最小年龄41岁,最大年龄78岁,平均年龄60.6岁。随机选择30例NSCLC癌旁正常组织作为对照。入选标本的组织学类型,分化程度及分期等均经病理科医师确诊。
2.方法与试剂
石蜡包埋的组织块经4μm厚连续切片,采用免疫组织化学Envision二步法检测FAK、NF-κBp65及VEGF-C在75例NSCLC及癌旁组织标本中的表达。步骤如下:切片脱蜡至水后EDTA缓冲液高压修复抗原,3%过氧化氢溶液封闭,加一抗(FAK稀释比例1∶50,NF-κBp65稀释比例1∶200,VEGF-C为即用型)后4℃孵育过夜,加二抗37℃反应,最后DAB显色,苏木素复染,封片观察。鼠抗人单克隆抗体FAK购于美国Santa Cruz公司,兔抗人多克隆抗体 NF-κBp65、兔多抗 VEGF-C及显色试剂盒均购自中杉金桥生物技术有限公司。
3.结果判断
FAK及VEGF-C的表达主要位于胞浆,染色阳性信号颗粒呈棕黄色;NF-κBp65的表达主要位于胞核和胞浆,染色阳性信号颗粒呈棕黄色。染色强度分级标准:通过光学显微镜观察无色为0分;淡黄色为1分;棕黄色为2分;深褐色为3分。着色细胞百分率计分:每张切片随机选取10个高倍视野(×400)下计数着色细胞百分比:0分为阳性细胞≤5%;1分为阳性细胞数6%~10%;2分为11%~50%;3分为51%~75%;4分为≥76%。以两类分数乘积进行判断:0分为阴性,1-4分为(+),5-8分为(++),9-12分以上为(+++),(+~+++)为阳性表达,(++)和(+++)为强阳性表达。
4.统计分析
采用SPSS17.0统计软件进行分析。FAK、NF-κBp65及VEGF-C在NSCLC癌组织中的表达与患者临床病例特征之间的关系应用χ2检验,三个免疫指标之间的相关性采用Spearman等级相关分析,P<0.05为差异有统计学意义。
结 果
1.FAK在NSCLC和癌旁组织中的表达
FAK表达阳性为胞浆内呈棕黄色颗粒(图1A、1B),FAK在NSCLC组织中的阳性表达率为57.3%,显著高于癌旁正常组织的13.3%(表1)。分析FAK与临床病理因素的关系发现,其与NSCLC的分化程度,临床分期及淋巴结转移情况相关,而与其他因素无关(表2)。
2.NF-κBp65蛋白的阳性表达主要位于细胞核及细胞浆(图2A、2B),NF-κBp65在 NSCLC和癌旁正常组织中的阳性表达率分别为85.3%和16.7%,其差异具有统计学意义(P<0.05)(表1)。NF-κBp65蛋白表达与NSCLC的临床分期、淋巴结转移等显著相关(P<0.05)(表2)。
3.VEGF-C在NSCLC中的表达主要位于胞浆,阳性表达为棕黄色颗粒(图3A、3B),在癌组织中的阳性表达率为65.3%,而在癌旁组织中表达为阴性(表1)。VEGF-C在NSCLC中高表达与肿瘤的分化程度、临床分期及淋巴结转移密切相关,但与患者性别和组织学类型等无关(表2)。

表1 FAK、NF-κBp65及VEGF-C在NSCLC和癌旁组织的表达Table 1 Expression of FAK、NF-κBp65、VEGF-C in cancerous and adjacent tissues
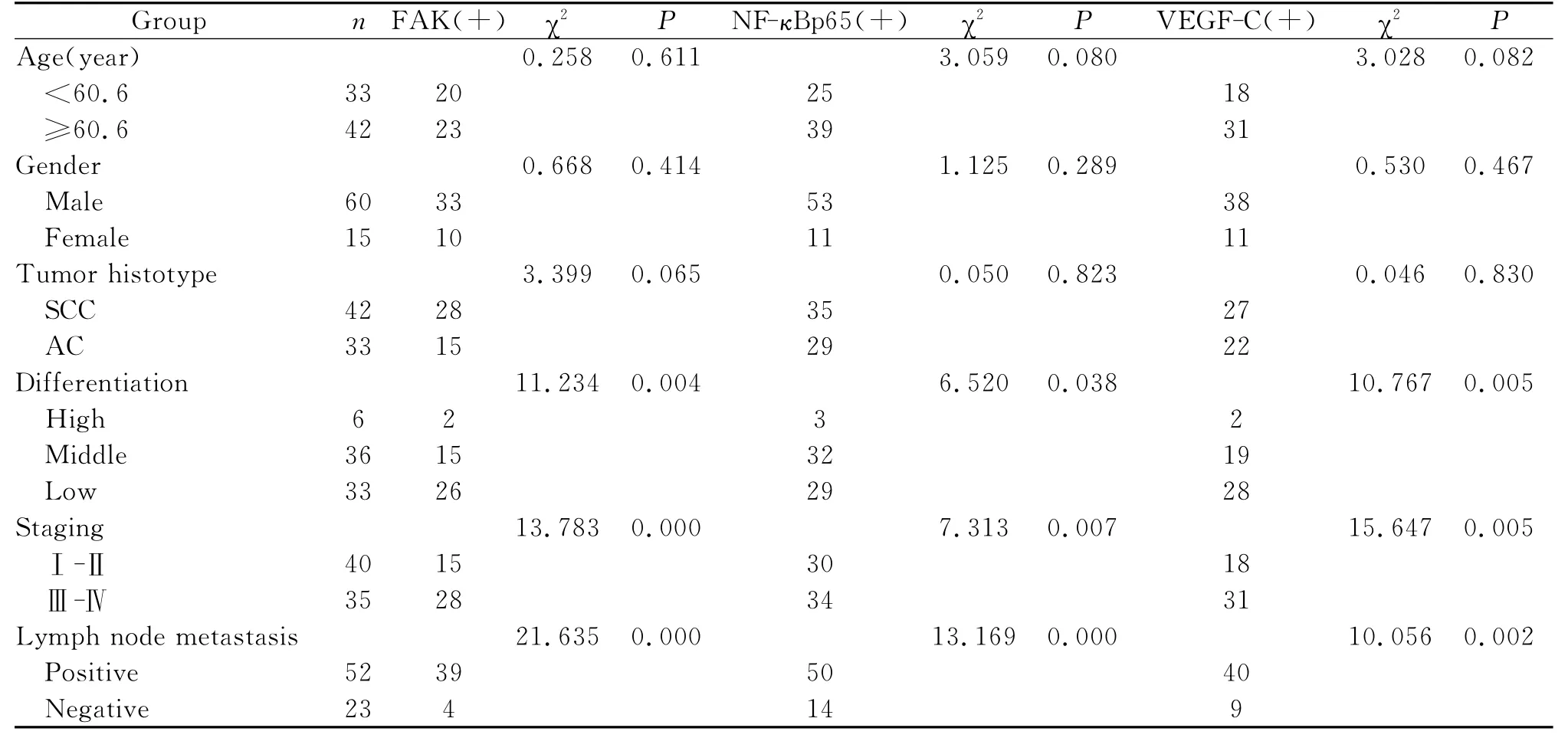
表2 FAK、NF-κBp65及VEGF-C表达与NSCLC临床病理特征的关系Table 2 The relationship between FAK、NF-κBp65、VEGF-C expression in NSCLC and clinicopathological characteristics
4.FAK、NF-κBp65和 VEGF-C在 NSCLC中表达的相关性
本实验研究发现FAK和NF-κBp65在癌组织中共阳性表达41例,共阴性表达10例,NF-κBp65和VEGF-C共阳性表达43例,共阴性表达10例,两组数据经Spearman相关分析,r值分别为0.228和0.274,P 值均小于0.05,因此 FAK 和 NF-κBp65,NF-κBp65和 VEGF-C之间分别存在正相关关系(表3,表4)。

表3 FAK、NF-κBp65在非小细胞肺癌中表达的相关性Table 3 The relationship between FAK and NF-κBp65in NSCLC
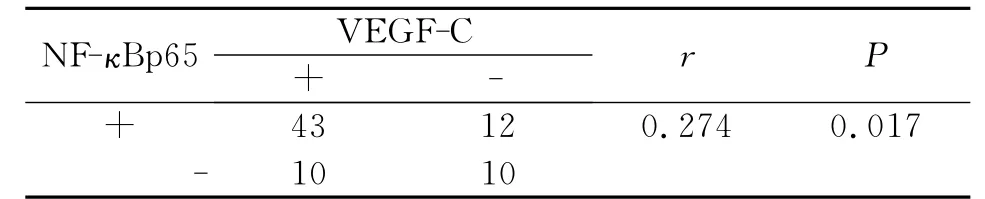
表4 NF-κBp65、VEGF-C在非小细胞肺癌中表达的相关性Table 4 The relationship between FAK and NF-κBp65in NSCLC
讨 论
FAK是1992年由Hanks等从v-src转染的鸡胚成纤维细胞中克隆鉴定出来,因与细胞黏附关系密切,故命名为黏着斑激酶。FAK是一种非受体蛋白酪氨酸激酶,分布于细胞黏着斑部位,是介导细胞与细胞之间,细胞与细胞外基质信号转导的重要的胞内分子,与肿瘤细胞生存、增殖、凋亡、迁移及血管生成等密切相关[3]。已有研究表明,FAK在多种肿瘤中高表达[4-6]。本研究发现,在NSCLC组织中FAK表达的阳性率明显高于正常肺组织(P<0.05),且与NSCLC分化程度有关,低分化组的阳性率高于高分化组,而肿瘤的分化程度与其侵袭和转移能力密切相关,提示FAK在调节NSCLC的发生发展中扮演着重要角色。与Park等[4]对FAK在胃癌中的表达情况研究结果相似。
NF-κB是一种具有多向性调节作用的真核细胞转录因子,广泛存在于细胞中。NF-κB信号通路不仅具有调控细胞增殖、分化和凋亡等重要生理功能,而且其异常活化与肿瘤的发生发展密切相关,研究证实,在癌细胞的发生及浸润转移的过程中,NF-κB的活性明显增强[7-10]。本研究显示,肺癌组织中NF-κB的阳性表达率明显高于癌旁正常肺组织,且差异有统计学意义(P<0.05);说明 NF-κB的高表达与肺癌的发生有关。结果分析显示,NF-κB的表达与NSCLC的分化程度、TNM分期和淋巴结转移密切相关,且癌细胞分化程度越低,分期越高NF-κB表达的阳性率越高。
VEGF-C是第一个被发现的淋巴管生长因子,可与受体VEGFR-3结合,促进淋巴细胞增生,形成新生的淋巴管[11]。肿瘤细胞可以通过表达VEGFC诱导淋巴管生成而促进肿瘤淋巴结转移,已在动物实验及临床研究中得到证实[12]。抑制VEGF-C的表达可以抑制肿瘤淋巴结转移,改善肿瘤治疗预后[13],进一步证明了VEGF-C在淋巴管生成及肿瘤淋巴转移中的作用。本研究显示VEGF-C蛋白在肺癌组织中的表达显著高于癌旁正常组织,且VEGF-C蛋白阳性表达与肿瘤的分化程度、淋巴结转移等密切相关。证实非小细胞肺癌癌细胞可以表达、分泌 VEGF-C,与李杰等[14]的研究结论一致。因此,VEGF-C蛋白阳性表达预示着淋巴结转移的可能性,淋巴转移是影响肿瘤患者预后的重要因素。此结果提示,不同分化程度及TNM分期是肿瘤预后不同的原因。
研究证实,FAK可以通过FAK-PI3K信号通路在RAS的参与下激活PI3K,进而通过蛋白激酶B(即PKB)成员AKT磷酸化一系列下游分子如NF-κB,导致bcl-2转录增强[15]。本研究亦得到相似结果。已有研究证实,NF-κB和VEGF在多种肿瘤中的表达存在正相关关系,本研究虽得到与已有研究一致的结论,但仍需要大样本实验研究进一步证实。
综 上 所 述,FAK、NF-κBp65 和 VEGF-C 在NSCLC的发生发展中起着重要作用,且三者的阳性表达与肿瘤的分化程度、TNM分期及淋巴结转移密切相关。因此,联合检测三者在NSCLC组织中的表达,可以作为预测肿瘤恶性程度及预后的指标,为肺癌的诊断和治疗提供新的思路及方法。
图 版 说 明
图1A 免疫组化染色肺腺癌中FAK阳性表达,DAB染色×400
图1B 免疫组化染色FAK在癌旁组织中的表达,DAB染色×400
图2A 免疫组化染色肺鳞癌中NF-κBp65阳性表达,DAB染色×400
图2B 免疫组化染色NF-κBp65在癌旁组织中的表达,DAB染色×400
图3A 免疫组化染色肺腺癌中VEGF-C阳性表达,DAB染色×400
图3B 免疫组化染色VEGF-C在癌旁组织中的表达,DAB染色×400
EXPLANATION OF FIGURES
Fig.1AFAK positive expression in AC ×400
Fig.1BFAK expression in adjacent Lung tissue×400
Fig.2ANF-κBp65positive expression in SCC×400
Fig.2BNF-κBp65expression in adjacent Lung tissue×400
Fig.3AVEGF-C positive expression in AC×400
Fig.3BVEGF-C expression in adjacent Lung tissue×400

[1]Hocking WG,Hu P,Oken MM,et al.Lung cancer screening in the randomized prostate,lung,colorectal,and ovarian(PLCO)screening trial.J Natl Cancer Inst,2010,102(10):722-731
[2]Siegel R,Naishadham D,Jemal A.Cancer statistics,2012 I.CA Cancer J Clin,2012,62:10-29
[3]Lim ST,Chen XL,Lim Y,et al.Nuclear FAK promotes cell proliferation and survival through FERM enhanced p53degradation.Mol-Cell,2008,29(1):9-22
[4]Park JH,Lee BL,Yoon J,et al.Focal adhesion kinase(FAK)gene amplification and its clinical implification in gastric cancer.Hurn Pathol,2010,41(12):1664-1673
[5]Chatzizacharias NA,Giaginis C,Gatzidou E,et al.Expression and clinical significance of FAK and Src proteins in human endometrial adenocarcinoma.Pathol Oncol Res,2011,17(2):277-285
[6]Theocharis S,Klijanienko J,Giaginis C,et al.FAK and Src expression in mobile tongue squamous cell carcinoma:associations with clinicopathological parameters and patients survival.J Cancer Res Clin Oncol,2012,138(8):1369-1377
[7]Mackenzie L,Mccall P,Halziieremia S,et al.Nuclear factor kappaB predicts poor outcome in patients with hormone-naive prostate cancer with high nuclear androgen receptor.Hum Pathol,2012,43:1491-1500
[8]Yang P,Guo L,Duan ZJ,et al.Histone methyltransferase NSD2/MMSET mediates constitutive NF-kappaB signaling for cancer cell proliferation,survival,and tumor growth via a feed-forward loop.Mol Cell Biol,2012,32:3121-3131
[9]Lertwittayapon T,Tencomnao T,Santiyanont R.Inhibitory effect of alter-natively spliced RAGEvl on the expression of NF-κB and TNF-alpha in hepatocellular carcinoma cells.Genet Mol Res,2012,11:1712-1720
[10]Li F,Wang Y,Wang X,et al.Ganoderic acids suppress growth and angiogenesis by modulating the NF-kappab signaling pathway in breast cancer cells,Int J Clin Pharmacol Ther,2012,50:712-721
[11]Joukov V,Pajusola K,Kaipainen A,et al.A novel vascular endothelial growth factor,VEGF-C,in a ligand for the Flt4 (VEGFR-3)and KDR(VEGFR-2)receptor tyrosine kinase.ENBOJ,1996,15:290-298
[12]Skobe M,Hawighorst T,Jackson DG,et al.Induction of tumor lymphangiogenesis by VEGF-C promotes breast cancer metastasis.Nature Med,2001,7(2):192-198
[13]Shibata MA,Morimoto J,Shibata E,et al.Combination therapy with short interfering rna vectora against VEGF-C and VEGF-A suppresses lymph node and lung metastasis in a mouse immunocompetent mammary cancer model.Cancer Gene Ther,2008,15(12):776-786
[14]李杰,李宝兰,张海青等.非小细胞肺癌中血管内皮生长因子C表达与淋巴结转移关系的研究.中华医师杂志,2008,88(42):2982-2985
[15]Matter MLl,Ruoslahti E.A signaling pathway from the alpha5betal and alpha(v)beta3in tegrins that elevates bcl-2transcription.J Bid Chem,2001,276(30):27757-27763
