雌激素对成年和老年雌性大鼠血管平滑肌细胞雌激素受体α表达的影响及其机制
2014-01-17敖锋沈艳吴艳万瑜宋健,*
敖 锋 沈 艳 吴 艳 万 瑜 宋 健,*
(1武汉大学医学院人体解剖学与组织胚胎学系;2武汉大学医学院结构生物学研究中心,武汉430071)
临床和流行病学调查证实,绝经或卵巢切除后女性冠心病发病率明显增高,这一现象提示雌激素对女性心血管系统具有保护效应。但2002年美国的一项对接受雌激素+孕酮补充治疗的绝经后妇女随机、双盲和对照试验(women’s health initiative,WHI)提示:雌激素补充治疗总体上引起心血管疾病和中风的风险增高[1]。这一结论引发了一场有关雌激素补充治疗利弊的论战。通过近13年的争论及对WHI原始资料后续详细的分析,目前更新的WHI结论是:在接近绝经或绝经早期开始给予雌激素补充治疗可减少女性冠心病的发病率;但对于绝经时间已较长或年龄>60岁的妇女,雌激素补充治疗的这种保护效应丧失[2]。WHI的这一更新结论虽然得到了广泛认可,但却引出了一个更具挑战性的疑问:既然雌激素补充治疗对心血管系统具有保护作用,为什么用于绝经时间较长的老龄妇女时会失效呢?
众所周知,雌激素的效应是通过其受体(estrogen receptor,ER)介导的,其中 ERα在介导心血管保护效应中占主导地位[3-5]。由此,我们推测:在绝经晚期的或老龄妇女,很可能由于雌激素的长时间缺失而导致ERα基因失活,故重新补充雌激素难以发挥ERα介导的心血管保护效应。为检验这一假设,研究检测了成年、老年雌性大鼠血管平滑肌细胞(vascular smooth muscle cell,VSMC)ERα的表达及补充雌激素对表达水平的影响,并从表观遗传学角度探讨了其调控机制。
材料和方法
1.主要材料和试剂
成年(2-3月龄)和老年(≥20月龄,相当于人类60岁以上)雌性Sprague-Dawley大鼠由武汉大学医学部动物实验中心提供。17β-雌二醇(E2;E4389;Sigma)、无酚红培养基 DMEM/F-12(GNM11039;GIBCO)、炭吸附特级胎牛血清(1351579;Biological Industries)、兔抗平滑肌肌球蛋白重链抗体(SM MHC;P00009;Abcam)及ERα抗体(ab37438;Abcam)等均通过商品化途径购置。
2.VSMC的培养及鉴定
采用酶消化法从成年、老年雌性大鼠主动脉分离VSMC,分别在无 E2或有10-10mol/L 、10-8mol/L(10-8mol/L 相当于妊娠大鼠最高血浆浓度)E2存在下培养至3-4代。培养的VSMC经SM MHC免疫细胞化学染色鉴定。
3.RT-qPCR检测ERαmRNA表达
用TRIzol Reagent提取细胞总RNA,按照RevertAid H Minus Reverse Kit使用说明书逆转录合成cDNA。ERα基因 RT-qPCR扩增引物序列为[6]:上 游 5'-AATTCTGACAATCGACGCCAG-3',下游5'-GTGCTTCAACATTCTCCCTCCTC-3'。内参GAPDH的引物序列为:上游5'-GATGGGTGTGAACCACGAGAAA-3',下 游 5'-ACGGATACATTGGGGGTAGGA-3'。以cDNA 为模板,按照SYBR Green SuperRealPreMix Plus说明书步骤进行PCR反应。反应条件为:95℃预变性15min,然后依次进入95℃10s,57℃30s,72℃20s,共40个循环,最后72℃延伸10s。
4.Western blot检测ERα蛋白表达
常规提取各组细胞总蛋白,SDS-PAGE电泳分离后转膜,经抗ERα(一抗)及HRP标记的山羊抗兔IgG(二抗)作用后,ECL显影,凝胶成像系统扫描成像,Quantity One进行相对定量分析,ERα蛋白表达水平用目的条带与内参GAPDH的灰度比值表示。
5.BSP法检测ERα基因启动区甲基化水平
按照 TIANamp Genomic DNA kit使用说明提取基因组DNA并进行甲基化修饰。修饰后的产物采用 Wizard DNA Clean-up System 提供的方法纯化及去磺基化后直接行PCR扩增。应用在线CpG岛分析工具MethPrimer设计ERα基因启动区甲基化引物:上游5'-TTGTAAATTTAGTTTTTTTTGGAGTG-3',下 游 5'-ACTAATCTCCCCTATTCTTAAACATC-3'。 反 应 条 件 为:95 ℃ 预 变 性2min,然后95℃30s,57℃30s,72℃25s,共30个循环,最后72℃延伸3min。PCR扩增产物用2%琼脂糖凝胶电泳分离后,凝胶纯化试剂盒回收目的片段,链接T载体后测序,测序结果导入DNAMAN软件进行比对,计算CpG岛甲基化率。
6.统计学分析
DNA甲基化率数据采用 Mann-Whitney U检验、其它数据采用t检验进行统计学分析,分析软件为Graphpad Prism 5。P<0.05表示差别具有显著性。
结 果
1.VSMC的鉴定
免疫细胞化学染色显示,分离培养的成年、老年雌性大鼠VSMC均高表达SM MHC,阳性细胞率在90%以上(图1)。
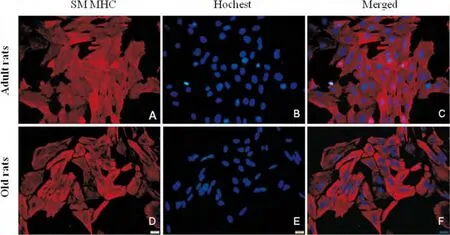
图1 VSMC免疫细胞化学鉴定(×400)。红色荧光:SM MHC染色(Cy3);蓝色荧光:Hochest核染。Fig.1Immunocytochemical identification of cultured VSMCs from adult and old female rats(×400).Red:SM MHC staining(Cy3);Blue:Neuclei counterstaining with Hochest.
2.ERα的表达
RT-qPCR和 Western blot分析显示(图2A、图2B):无E2存在时,成年雌性大鼠VSMC表达一定水平ERα。当加入生理剂量E2时,ERα表达随E2浓度增加显著上升,其中10-10mol/L E2组约上升至1.75倍,10-8mol/L E2组约上升至2.5倍。
老年雌性大鼠VSMC在无E2存在时,无论是mRNA还蛋白质水平几乎均检测不到ERα,且即使补充E2达最高生理剂量(10-8mol/L)也无法诱导ERα的重新表达。
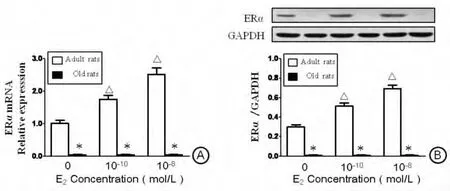
图2 ERα在成、老年VSMC中的表达。A:ERαmRNA的表达(实时荧光定量PCR检测);B:ERα的蛋白表达(Western blot检测)。*P<0.05,与同E2剂量组成年大鼠VSMC比较;△P<0.05,与前一E2剂量组同龄大鼠VSMC比较。n=5Fig.2Expression of ERαin VSMCs at mRNA and protein levels.A:RT-qPCR analysis for ERαmRNA expression.B:Western blot analysis for ERαprotein expression.*P<0.05,compared with the adult VSMCs in the same E2-dose group;△P<0.05,compared with the same-aged VSMCs in the adjacent previous E2-dose group.N=5
3.ERα基因启动区CpG岛甲基化水平的变化
用MethPrimer对ERα基因DNA序列分析显示:在ERα基因的转录起始区域存在着一个典型的CpG岛(图3A),本研究分析了CpG岛及其附近CpG位点的甲基化(图3B)。
如图3C所示,无E2存在时,成年雌性大鼠VSMC ERα基因启动区CpG岛呈现较低水平的甲基化(<20%);加入10-8mol/L E2后,甲基化水平显著下降。而老年雌性大鼠VSMC在无E2存在时ERα基因启动区CpG岛甲基化水平高达80%以上,且加入10-8mol/L E2对甲基化水平无显著影响。

图3 成、老年大鼠VSMC ERα基因启动区甲基化水平的BSP分析。A:BSP引物在ERα基因转录启动区的位置。上方水平细线显示ERα基因启动区及其CpG岛的位置,下方水平粗线显示BSP检测的位置(﹣634-﹣397),其中垂直线段为CpG位点。B:ERα基因启动区CpG岛(方框内)及其附近CpG位点甲基化水平;每一横行代表一个克隆的不同CpG位点,每一纵列代表不同克隆的相同CpG位点;空心圆和实心圆分别代表未甲基化和甲基化的CpG位点。C:CpG岛甲基化水平比较。*P<0.05,与同E2剂量组成年大鼠 VSMC比较;△P<0.05,与0mol/L E2组同龄大鼠 VSMC比较。n=10Fig.3BSP analysis for methylation level of ERαgene promoter in the VSMCs.A:BSP primer locations in the promoter regions of the rat ERαgene.The upper thin horizontal line represents the ERαpromoter with a CpG island.The lower bold horizontal line represents the BSP examined region(-634to-397),the CpG sites indicated by vertical ticks.B:Methylation status of CpG island(framed by agrey box)and adjacent CpG sites in ERαgene.Each row represents CpG sites in an individual clone and each column,the same CpG sites in different clones.White dots represent unmethylated CpG sites,and black,methylated.C:Histogram of methylated CpG sites in the CpG island;*P<0.05,compared with the adult VSMCs in the same E2-dose group,△P<0.05,compared with the same-aged VSMCs in the 0mol/L E2group.n=10
讨 论
研究以培养的成年和老年雌性大鼠VSMC为模型,体外给予生理剂量雌激素模拟成年及绝经后老龄妇女雌激素补充治疗。为排除环境微量雌激素的干扰,采用了含10%活性炭吸附特级胎牛血清、无酚红的完全培养基。
结果显示:成年大鼠VSMC无论在有或无雌激素存在时均表达ERα,且表达水平随雌激素浓度增加而上升。这提示成年大鼠VSMC不仅表达ERα,且表达水平受体内雌激素水平的诱导或调控。而老年雌性大鼠VSMC无论是在mRNA水平还是蛋白质水平均检测不到ERα表达,即使补充雌激素达最高生理剂量也无法诱导ERα的重新表达,提示在月龄≥20的雌性大鼠,VSMC的ERα基因已经永久失活。
为探讨老年雌性大鼠VSMC ERα基因失活的机制,本研究进一步对比分析了两个年龄组VSMC在有或无雌激素存在条件下ERα基因启动区CpG岛甲基化水平的变化。结果提示:成年雌性大鼠VSMC ERα基因本身存在低水平CpG岛甲基化(<20%),但给予雌激素后,甲基化水平显著降低,说明雌激素对ERα表达的诱导效应是通过影响其基因甲基化来实现的。但老年雌性大鼠VSMC ERα基因启动区CpG岛甲基化已高达80%以上,且加入最高生理剂量雌激素也不逆转。这说明老年雌性大鼠VSMC ERα基因的失活可能是由于年龄相关的生理因素变化(特别是雌激素长期缺失)导致其启动区CpG高度甲基化所致。
临床研究表明,绝经后妇女卵巢功能衰退,体内雌激素水平明显下降,到绝经后期由于卵泡耗竭,卵巢停止分泌雌激素[7],引起内源性雌激素严重缺乏。Christopher等报道,内皮细胞ERα的激活依赖于雌激素,且表达水平受雌激素的调控,短期雌激素的缺失即会引起ERα的表达骤减[8],这证据支持ER的表达与雌激素水平息息相关,老年雌性机体组织中ERα的失活很可能是雌激素长期缺乏所致。Post等[9]研究发现心血管组织ERα基因的甲基化与年龄相关,年龄越大,启动子的甲基化水平越高,且老年动物心血管组织的ERα基因因DNA高甲基化而失活。这些研究虽与本研究采用的动物或细胞类型不同,研究的侧重点也不同,但获得的证据支持本研究结论,即成年雌性大鼠VSMC ERα的表达受雌激素水平的调控;老年雌性大鼠VSMC由于内源性雌激素的长期缺失,导致VSMC ERα基因发生高水平甲基化而沉默。
已有众多研究显示,雌激素的血管保护作用之一是抑制VSMC增殖,从而防止或延缓动脉粥样硬化早期出现的内膜增厚,而这一效应主要由ERα介导[5]。由此我们推测:对于绝经早期的妇女,补充雌激素可诱导ERα表达升高并介导其抗动脉粥样硬化作用;但在绝经晚期或老龄妇女,由于ERα已失活,重新补充雌激素难以发挥ERα介导的血管保护效应。
[1]Rossouw JE,Anderson GL,Prentice RL,et al.Risks and benefits of estrogen plus progestin in healthy postmenopausal women:Principal results from the Women’s Health Initiative randomized controlled trial.JAMA,2002,288(3):321-333
[2]Lobo RA.What the future holds for women after menopause:where we have been,where we are,and where we want to go.CLIMACTERIC,2014,17(2):1-6
[3]Lenfant F,Trémollières F,Gourdy P,et al.Timing of the vascular actions of estrogens in experimental and human studies:why protective early,and not when delayed?Maturitas,2011,68(2):165-173
[4]Nakamura Y,Suzuki T,Miki Y,et al.Estrogen receptors in atherosclerotic human aorta:inhibition of human vascular smooth muscle cell proliferation by estrogens.Molecular and Cellular Endocrinology,2004,219(1-2):17-26
[5]Gary Pare,Andree Krust,Karas RH,et al.Estrogen Receptor-αMediates the Protective Effects of Estrogen A-gainst Vascular Injury.Circ Res,2002,90(10):1087-1092
[6]Guohong Li,Yiu-Fai Chen,Green GL,et al.Estrogen Inhibits Vascular Smooth Muscle Cell Dependent Advential Fibroblast Migration In Vitro.Circulation,1999,100(15):1639-1645
[7]乐杰.妇产科学.第7版.北京:人民卫生出版社,2008:14
[8]Christopher E,Ken L.Estrogen cause dynamic alternations in endothelial estrogen receptor expression.Circulation Research,2002,91(9):814-820
[9]Post WS,Goldschmidt-Clermont PJ,Wilhide CC,et al.Methylation of the estrogen receptor gene is associated with aging and atherosclerosis in the cardiovascular system.Cardiovasc Res,1999,43(4):985-991
